Hogyan kezdődött az élet a Földön? Egy fiatal, sziklás bolygón hogyan jöhettek össze a vegyi anyagok a megfelelő módon, hogy kialakuljanak a legelső sejtek? Hogyan kezdtek el ezek a kezdetleges sejtek életként viselkedni: növekedni, osztódni és előnyös tulajdonságokat átadni a következő generációnak?
Az élet eredete különösen homályos, mert a geológiai feljegyzések – a kőzetrétegek és a beágyazott fosszíliák, amelyek a Föld és az élet történetére vonatkozó nyomokat tartalmaznak – nagyjából 3,9 milliárd évvel ezelőtt eltűntek, a bolygó kérgének mozgása miatt. Ennek eredményeképpen a tudósok nem rendelkeznek közvetlen bizonyítékokkal a korai Földön uralkodó körülményekről, beleértve a bizonyítékokat a molekulákról, amelyek az ősi tavakban kavaroghattak és az élet építőköveit alkották.
Ez rengeteg kérdést vet fel, pontosan azokat a nagy kérdéseket, amelyek Jack Szostakot vonzzák. Ő és mások úgy vélik, hogy a laboratóriumban rekonstruálni tudják azt a hosszú utat, amely az űrben lévő vegyi anyagoktól a Föld kialakulásáig, a bolygón lévő élet előtti kémiáig, a korai protocellákig, és végül az anyagcserével és fehérjeszintézissel rendelkező fejlett sejtekig vezetett. Az ilyen kiterjedt kutatásokhoz számos terület szakértelme szükséges, beleértve a kémiát és a biokémiát, a geológiát és a geofizikát, valamint a csillagászatot.
Szostak (ejtsd: shah-stak) lehet az ideális személy a válaszok keresésére. Nobel-díjas, a Harvard Medical School genetika professzora, a Bölcsészettudományi Kar kémia és kémiai biológia professzora, a Massachusetts General Hospital (MGH) Rich Distinguished Investigatora és a Howard Hughes Medical Institute kutatója, akit mások zseniális, céltudatos tudósként jellemeznek. De ismert az enyhe modorú alázatáról is, beleértve a hajlandóságát, hogy mélyen belemerüljön a számára új témákba, és a kollegialitásáról, hogy segít előmozdítani az ötletek megosztását, ami előreviszi a tudományt.
A saját kutatásai az élethez vezető út egy szegmensére összpontosítanak: a protocellára, “egy nagyon-nagyon egyszerű őssejtre, amely olyan vegyi anyagokból állhatott össze, amelyek már korán, a Föld felszínén léteztek” – magyarázza Szostak. Azt reméli, hogy megérti, hogyan növekedhetett és osztódhatott, hogyan kezdett el szaporodni, és végül hogyan fejlődött tovább. “Lehet, hogy nem tudjuk, mi történt valójában, de talán különböző lehetséges utakat tudunk kidolgozni” – mondja. “Mindössze annyit tehetünk, hogy megpróbálunk olyan dolgokat összerakni a laboratóriumban, amelyek hihetőnek tűnnek.”
“Irányított evolúció”
Ez év augusztusában töltötte be Szostak negyvenedik évét a Harvardon és harmincötödik évét az MGH-ban (ahol a laboratóriuma található), és ezt az időszakot fontos felfedezések jellemezték a legkülönbözőbb területeken. Az 1980-as években laboratóriuma élesztővel végzett kísérleteket a DNS-rekombináció genetikájának és biokémiájának megértésére – ez a munka vezetett a kettős szálszakadás javítási modelljéhez, amely leírja, hogy a hosszú DNS-szálak hogyan szakadnak el, cserélnek szegmenseket, majd egyesülnek újra. Ez késztette a későbbi kutatásokat a meiózis, a spermiumok és petesejtek kialakulásához vezető sejtosztódás során végbemenő rekombináció mechanizmusára.
Az ő csoportja ugyanebben az időszakban fontos felfedezéseket tett a telomerekről – a kromoszómák végén található védősapkákról, amelyek biztosítják a DNS megfelelő replikációját a sejtosztódás során. Ezért a kutatásért Szostak később megkapta a 2009-es élettani vagy orvosi Nobel-díjat, amelyet megosztva Elizabeth Blackburn, Sc.D. ’06-os kutatóval, aki jelenleg a San Franciscó-i UC emeritája, és Carol Greiderrel, a Johns Hopkins Egyetem kutatójával együtt kapott.
Mire Szostak 2009 októberében megkapta a kora reggeli telefonhívást Svédországból, már több mint 20 évet töltött alapvető hozzájárulásokkal a tudomány más területein. Az 1980-as évek közepén a telomerek felfedezései után (a kutatások a megrövidült telomereket az öregedés számos betegségével hozták összefüggésbe) sok tudós lépett be a területre, Szostak pedig úgy döntött, hogy irányt vált. “Elég egyértelmű volt, hogy mik legyenek a következő kísérletek, és úgy éreztem, hogy bármit is csinálunk, úgyis megcsinálják” – emlékezett vissza. “Soha nem éreztem, hogy sok értelme van olyan dolgokat csinálni, amelyeket úgyis megcsinálnak. Szóval ez tényleg arra késztetett, hogy körülnézzek, és elgondolkodjak azon, hogy milyen másfajta tudományos kérdésekkel kezdhetnék el foglalkozni.” 1984-ben elfogadta az ajánlatot, hogy laboratóriumát az akkori Sidney Farber Rákintézetből az MGH-ba költöztesse, hogy csatlakozzon az ottani, alapkutatással foglalkozó kutatókhoz. “Ez egy elképesztő ajánlat volt: minden kutatásomat 10 évig teljes mértékben finanszírozták volna” – emlékszik vissza Szostak. “Tökéletes volt számomra, mivel lehetővé tette, hogy irányt váltsak anélkül, hogy egy új területen aggódnom kellett volna a pályázatok megírása miatt.”
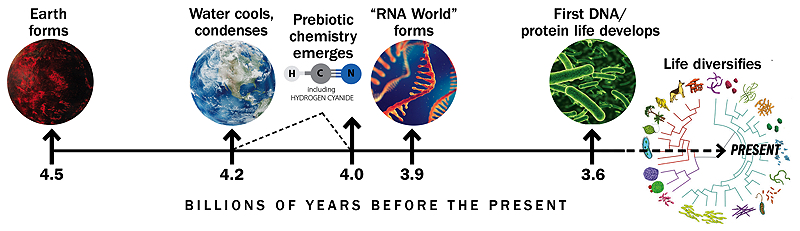
Timeline based on similar graphic by Gerald Joyce
A lehetőségek mérlegelése után a ribozimeknek nevezett RNS-enzimek mellett döntött, egy olyan területen, amelyet “érdekesnek, követhetőnek és nem erősen versenyképesnek” látott. Ő és végzős diákjai elkezdtek eszközöket fejleszteni az RNS, a sejtekben lévő egyszálú molekulák, amelyek a DNS-ben található genetikai információt másolják. Csapata kémcsövekben új szerepek betöltésére késztette az RNS-t, például célmolekulák felismerésére és reakciók katalizálására. Az “irányított evolúció” néven ismert folyamat során mutációkat vittek be az RNS-szálakba, olyan változatokat kerestek, amelyek hasznos funkciókat tudtak ellátni, és lehetővé tették, hogy ezek az új molekulák szaporodjanak. Hasonló munkát végeztek DNS-sel, peptidekkel és fehérjékkel is.
1994-ben Szostak a Nemzeti Tudományos Akadémia molekuláris biológiai díját kapta meg Gerald Joyce kutatóval együtt, aki jelenleg a Salk Institute for Biological Studies kutatója, az RNS in vitro evolúciójának egyidejű, de egymástól független kidolgozásáért. “Ez egy olyan technológia, amellyel olyan molekulákat hozhatunk létre, amelyek teljesítik az utasításainkat” – magyarázta Joyce egy interjúban, hasonlóan ahhoz, ahogyan a mezőgazdasági tudósok teheneket tenyésztenek, hogy több tejet termeljenek, vagy olyan növényeket fejlesztenek, amelyek ellenállnak a szárazságnak. “Ez ennek a molekuláris változata. És ez olyasmi, amit ma már nagyon széles körben gyakorolnak” – teszi hozzá (lásd “Az evolúció hasznosítása”, 2017. január-február, 15. oldal), egy olyan módszer, amellyel új molekulákat fejleszthetnek ki különféle felhasználási célokra, beleértve a gyógyszereket is.
Sostak számára az irányított evolúcióval kapcsolatos munka új kérdéseket vetett fel. “Egyre jobban kezdett érdekelni, hogyan indult el az evolúció teljesen magától a korai Földön” – emlékszik vissza. “Egy dolog szelektív nyomást gyakorolni és darwini evolúciót végezni a laboratóriumban, ahol vannak enzimek, diákok és műszerek. De a darwini evolúció valahogy magától indult el”. Mivel a fejlődés képessége az élet egyik legfontosabb jellemzője, Szostak a tudomány egyik alapvető kérdését tette fel: Hogyan kezdődött az élet?
Origins: “Három nagy, alapvető kérdés”
A kanadai-amerikai Szostak Londonban született, ahol apja repülőmérnöki diplomát szerzett. A család végül visszatért Kanadába, ahol Ottawában, majd Montrealban éltek, apja pedig a kanadai légierőnél dolgozott. (Szostak akcentusa megőrizte kanadai származásának nyomait.) Édesanyja hosszú éveken át adminisztratív munkakörben dolgozott egy ipari vegyipari vállalatnál, és Szostak tinédzserként ott kapta első nyári munkáját, ahol a cég festéklaboratóriumában színtartóságot vizsgált. “A munka ismétlődő és unalmas volt, de ez adta meg nekem az első betekintést abba, hogy milyen fontos a termékek tesztelése és újratesztelése a valós használatra” – emlékszik vissza. Ekkor már “komolyan érdekelte” a tudomány, a matematika és a mérnöki tudományok. Biokémiából 25 évesen doktorált a Cornell Egyetemen, és fontos mentorának nevezi tanácsadóját, Ray Wut: “Nagyszerű laboratóriumi környezetet teremtett, de azt is megmutatta, hogyan kérjek segítséget egy projekthez, ha problémákkal szembesülök.”
Noha Szostak karrierje során végzett néhány gyakorlati, alkalmazott kutatást – az egyik általa alapított cég, a Ra Pharma felfedezett egy gyógyszert a myasthenia gravis nevű betegségre, amellyel hamarosan megkezdődnek a III. fázisú klinikai vizsgálatok -, a legnagyobb szenvedélye az alaptudományok iránt van.
“Ez egy izgalmas időszak az idegtudományok terén, mert most olyan problémákkal lehet foglalkozni, amelyekre 30 évvel ezelőtt még csak gondolni sem lehetett.”
“Számomra három nagy, alapvető tudományos kérdés szuperérdekes: az élet eredete, a világegyetem eredete és az elme vagy a tudat eredete” – ajánlja Cambridge Oxford Street-i Mallinckrodt Laboratóriumában lévő csendes, szinte üres irodájában ülve. (Az iroda alkalmi megbeszélésekre szolgál; Szostak főként az MGH-ban lévő laboratóriumában dolgozik.) Az élet eredete után az elme eredete érdekli leginkább. Az 1980-as években, amikor azt tervezgette, mihez kezdjen a telomerkutatásai után, fontolgatta, hogy áttér az idegtudományok tanulmányozására, és még a Harvardon is beült a témával foglalkozó szemináriumokra. “Lenyűgöző volt, de egyben lehangoló is, mert a technológia annyira primitív volt” – emlékszik vissza. Azóta érdeklődéssel figyeli, hogyan fejlődtek a tudományterület eszközei. “Ez egy izgalmas időszak a fiatalok számára az idegtudományok terén, mert az új technológiáknak köszönhetően olyan problémákkal lehet most foglalkozni, amelyekre 30 évvel ezelőtt még csak gondolni sem lehetett” – mondja. “Mégis az általános probléma még mindig olyan hatalmas és némileg ijesztő. Ahogy én látom, e nagy problémák közül a legegyszerűbbeken dolgozom”. Mivel az élet eredetével kapcsolatos kérdések jól illeszkednek a jelenlegi kutatási technológiákhoz, teszi hozzá, úgy véli, hogy ez “egy megoldható probléma.”
Modell protocellák és “rendetlen” RNS
Szostak csapata a 2000-es évek eleje óta készít modell protocellákat, hogy kiderítse, hogyan állhattak össze és fejlődhettek eredetileg. Ezek a primitív struktúrák “rendkívül egyszerűek” voltak a ma a Földön élő legegyszerűbb egysejtű baktériumhoz képest – magyarázza. A protocellák valószínűleg minimális zsíros membránt és kezdetben csak egyetlen gént tartalmaztak, amely valamilyen előnyt biztosított a sejtnek. A modern baktériumok ezzel szemben “legalább több száz, de jellemzően több ezer génnel rendelkeznek.”
Az egyes elméletek szerint a korai élet az óceán mélyén lévő hidrotermális nyílások közelében alakult ki, Szostakot jobban meggyőzik azok a kutatások, amelyek szerint a legkorábbi sejtek a szárazföldön, tavakban vagy medencékben fejlődtek ki, valószínűleg vulkanikusan aktív régiókban. Az ultraibolya fény és a villámcsapások segíthettek a légkörben lévő molekulákat cianiddá és más hasznos anyagokká alakítani, hogy az élet építőkövei létrejöjjenek. A sekély vízben ezek az anyagok nagy koncentrációban halmozódhattak fel, a vulkáni tevékenység pedig forró és hideg hőmérséklet-ingadozásokat hozhatott létre, amelyek hasznosak voltak bizonyos kémiai reakciókhoz.
A Föld és az élet kezdeteinek története
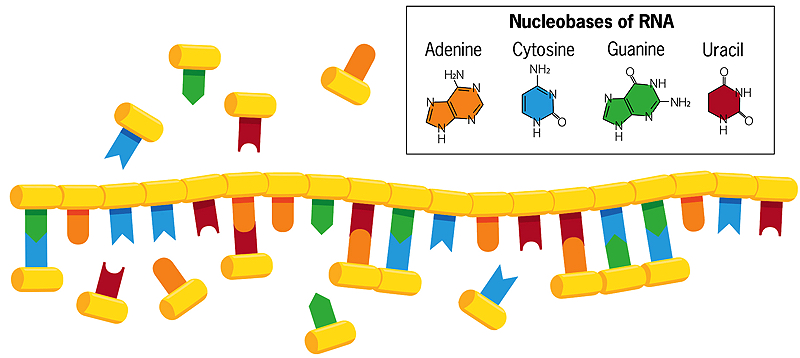
A kettős szálú DNS-től eltérően, amelyben a citozin és a timin bázisok guaninnal és adeninnel alkotnak párost az ellenkező szálon, az RNS egy spirális szálának bázisai a vízben szabadon lebegő nukleobázisokkal (a fenti képen látható) társulásokat alkothatnak. Ha ezek a szabadon lebegő bázisok ezután összeolvadnak egymással, az RNS-szál egy új, tükörfordított példánya jön létre, amely a víz melegítésekor szétválik az eredetitől. Amikor ez az új szál viszont replikálódik, egy olyan tükörmásolatot hoz létre, amely megegyezik az eredeti RNS-száléval. Néha hibák fordulnak elő ebben a másolási folyamatban, és a hasznos hibák megörökítik magukat. Így minden lánc, saját replikációjának sablonjaként működve, fejlődik, és kölcsönhatásba lép a környezetével.
Egyes tudósok, köztük Gerald Joyce, azt feltételezik, hogy az élet a sejteken kívül kezdődhetett, amikor a szabadon lebegő molekulák találkoztak egymással, és olyan kötéseket alkottak, amelyek lehetővé tették, hogy életként viselkedjenek. Szostak azonban azt állítja, hogy a sejtmembránra szükség volt, részben azért, mert az összetartotta volna a hasznos genetikai molekulákat, és megakadályozta volna, hogy a genetikailag kódolt ribozimek által előállított hasznos anyagcseretermékek elússzanak a környező vízben, vagy más, elhaladó protocellák elkapják őket.
A laboratóriumában végzett kísérletek megmutatták, hogyan nőhet és osztható egy ilyen membrán. A kutatók zsírsavakat, például olajsavat vízzel és egy pufferrel (hogy az oldat pH-ja stabil maradjon) kombináltak, majd az oldatot rázogatták. Mikroszkóp alatt vizsgálva az összetevők vezikulákká álltak össze: kör alakú, folyadékkal teli struktúrák kétrétegű membránnal. További zsírsavak hozzáadásával a környezethez – amelyek tápanyagként szolgáltak – a vezikulák hosszú, hajszerű szálakat növesztettek, amelyek olyan törékenyek voltak, hogy még a mikroszkópos tárgylemezre gyakorolt enyhe légmozgás is darabokra törte őket. Szostak csapata hasonló eredményeket ért el különböző membránképző molekulákkal és különböző környezetekben, ami arra utal, hogy ez egy hihető módja a protocellamembrán növekedésének, majd osztódásának. De hogyan adhatná át ez a szerkezet a hasznos genetikai anyagot a leánysejtek következő generációjának? “A genetikai anyag az, ami valójában sokkal nehezebb problémának tűnik” – mondja.”
A genetikai információ tárolására és továbbítására a mai sejtek a DNS-re – az adenin, citozin, guanin és timin nukleobázisokból álló kettős spirál molekulára – támaszkodnak, hogy az öröklött tulajdonságokat megosszák az egymást követő generációkkal. A DNS sejtekben történő replikációjához azonban az egyszálú RNS molekulára és fehérjeenzimekre is szükség van, a genetikailag kódolt fehérjék pedig túlságosan összetettek ahhoz, hogy spontán módon keletkezhettek volna a Föld korai időszakában. Mivel az RNS egyszerre képes genetikai információt tárolni és továbbítani (mint a DNS), és kémiai reakciókat katalizálni (mint a fehérjeenzimek), sok kutató úgy véli, hogy az őssejtek RNS-molekulákat használtak mind genetikai, mind enzimatikus szerepek betöltésére.
Az 1960-as évek végén Leslie Orgel brit tudós azt javasolta, hogy az RNS, vagy valami hasonló lehetett az első molekula a Földön, amely replikálódott és fejlődött; ez az “RNS-világ” hipotézis néven vált ismertté. Orgel és mások évtizedekig dolgoztak azon, hogy megértsék, hogyan állhattak össze és replikálódhattak az RNS-láncok, de erőfeszítéseik nem jártak teljes sikerrel. “Kezdetben nagy előrelépés történt, aztán megakadt a munka, mert egy tucat különböző probléma merült fel, és akkoriban egyikre sem volt egyértelmű válasz” – magyarázza Szostak. “Nagyjából mindenki frusztrált lett, és azt gondolta: ‘Talán az élet nem az RNS-szel kezdődött. Talán van valami egyszerűbb, könnyebben előállítható, könnyebben reprodukálható.”
“Ma már sokkal többet tudunk, és csak azáltal, hogy a dolgokat egyedi, kisebb problémákra bontottuk, néhányat meg tudtunk oldani.”
A kutatók az RNS alternatívái után kutattak, “és ez 10-20 évnyi igazán érdekes kémiai munkát eredményezett, sok érdekes molekulát találva” – jegyzi meg Szostak. “De mindeddig semmi olyan egyszerűbb vagy jobb, az RNS-nél, ami valóban működne, nem jött létre”. Egyes kutatók támogatják az “anyagcsere-első” hipotézist, amely szerint az élet genetikai anyag nélkül, önfenntartó reakciók sorozatával kezdődhetett, de Szostak és mások továbbra sincsenek meggyőződve erről. Körülbelül hét évvel ezelőtt kezdte újra áttekinteni azokat az akadályokat, amelyekkel Orgel és kortársai szembesültek az RNS-szintézis megértése során. “Ma már sokkal többet tudunk” – magyarázza – “és csak azáltal, hogy a dolgokat egyedi, kisebb problémákra bontottuk, néhányat meg tudtunk oldani.”
Szostak laboratóriuma most szinte teljes egészében arra összpontosít, hogyan másolhatta magát az ősi RNS. A modern RNS nagyon szabályos, kiszámítható módon áll össze, a nukleotid-építőelemek láncszerűen kattannak össze. Minden blokk tartalmaz egy cukrot (ribóz), egy foszfátot és a négy nukleobázis (más néven nitrogénbázis) – azadenin, citozin, guanin és uracil (általában A, C, G és U) – egyikét. A ribóz-foszfát egységek egymáshoz kapcsolódva alkotják az RNS “gerincét”. A modern sejtekben fehérjeenzimek katalizálják azt a reakciót, amely a nukleotidegységeket RNS-lánccá kapcsolja össze.
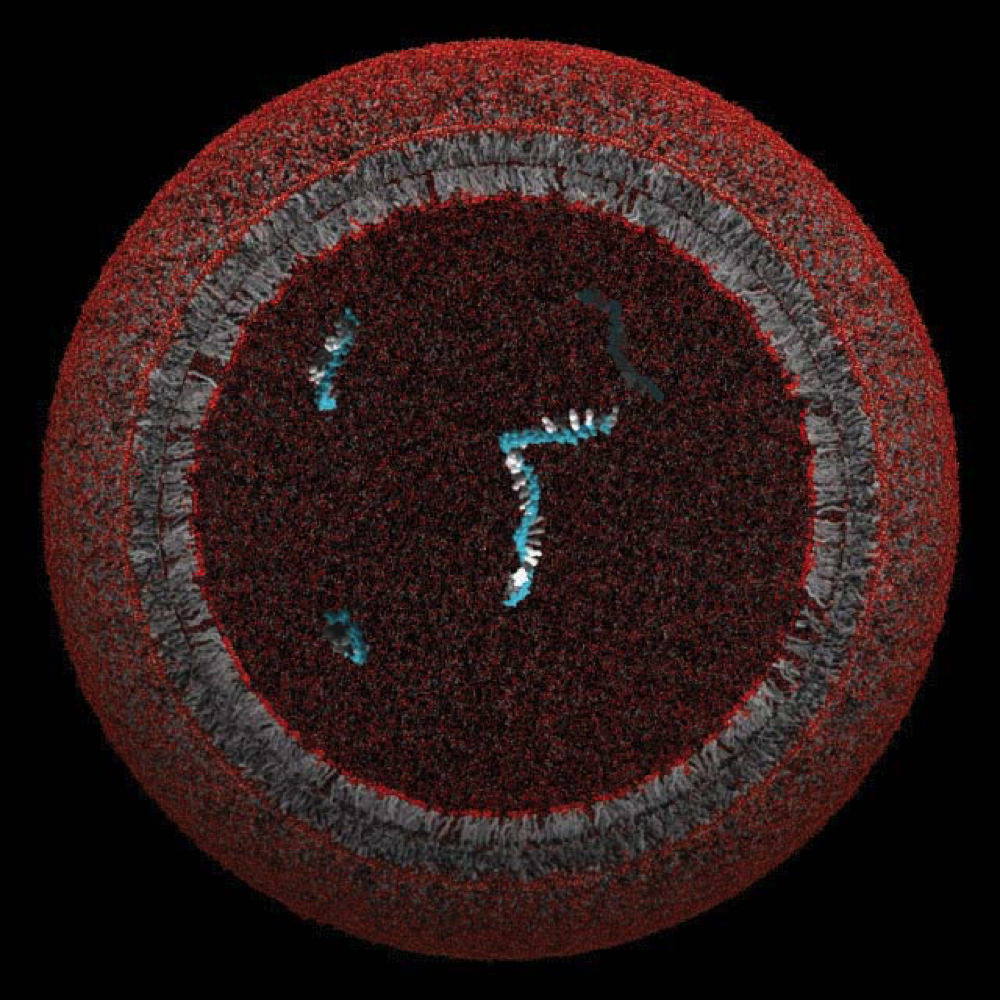
Modell protocella, amelynek lipidmembránja egyetlen gént zárhatott be és védhetett
A kép a Szostak Laboratórium jóvoltából
A korai Föld protocelláiban az RNS-lánc sablonként szolgált volna, amelyen egy új, komplementer nukleotidlánc állt össze, mielőtt levált volna, hogy további sablon legyen, amelyen más, szabadon lebegő nukleotidok össze tudtak kattanni. A kiszámítható modern RNS-szel ellentétben azonban a korai RNS-nek nem álltak rendelkezésére fehérjék, amelyek katalizálták volna az építési folyamatot. (Mivel a fehérjék nem tudnak kialakulni a szintézisükhöz szükséges összetett és magasan fejlett sejtgépezet nélkül, a legtöbb kutató úgy véli, hogy az ősföldön valószínűleg nem léteztek.) A korai RNS ezért valószínűleg kuszább volt, sokkal több variációval a cukorgerincben és a bázisokban, mondja Szostak. Csapata jelenleg kísérletezik, “hogy némi képet kapjunk arról, hogy milyen variabilitást tolerálnának, és mit gyomlálnának ki. A jelenlegi modellünk az, hogy valami olyannal kezdjük, ami rendezetlen és sok különböző variációt tartalmaz, és a replikációs ciklusok során végül valami olyat kapunk, ami közelebb áll a modern homogén RNS-hez.”
A Szostak és Seohyun Kim végzős hallgató 2018-as tanulmánya a korai RNS lehetséges variabilitását és annak A, C, G és U építőelemeit mutatja be. A tudósok előrelépést értek el annak megértésében, hogyan keletkezhetett a C és az U prebiotikus kémiai reakciók révén, de az A és a G esetében nehézségekbe ütköztek. Szostak és Kim szerint az RNS különböző nukleobázisokkal indulhatott, és kísérleteik kimutatták, hogy a G (guanozin) helyett hatékonyan működik az A (adenin) nukleozidból előállítható inozin. “Ez leegyszerűsíti az általános problémát” – magyarázza Szostak. “Most már csak azt kell tudnunk, hogyan állítsuk elő az A-t.”
A laboratóriumban a közelmúltban végzett más kísérletek az RNS-másolási folyamat beindításához szükséges fémionokra összpontosítottak. A kutatók általában magnéziumot használnak, “de azt nagyon magas koncentrációban kell használnunk”, aminek negatív mellékhatásai vannak: az RNS lebomlását vagy a sejtmembrán pusztulását váltja ki. “Remélhetőleg találunk valami egyszerű, hihető módot arra, hogy kevesebb magnéziummal is működjön minden, vagy talán újra kell gondolnunk az egész problémát, és más irányból kell megközelítenünk” – magyarázza Szostak. “Csak tapogatózunk a sötétben, próbáljuk meglátni, hol lehet a megoldáshoz vezető út.”

A vulkanizmusnak tulajdonítható melegedés és lehűlés, mint például a Yellowstone-i Grand Prismatic Springnél, elősegíthette az RNS korai evolúcióját.
Fotó: Istock Images
Egyik út nem működik, sőt, hibákat eredményez. 2016-ban Szostak laboratóriuma a Nature Chemistry című folyóiratban publikált egy tanulmányt, amelyben kimutatta, hogy egy peptid segíthette az RNS enzimek nélküli replikációját. Nem sokkal később Tivoli Olsen kutatótárs csatlakozott a laborhoz, és nem tudta reprodukálni ezeket az eredményeket. A cikk átnézése során kiderült, hogy a csapat félreértelmezte az adatokat, és Szostak visszavonta a cikket. “Nehéz problémákon dolgozunk, és a tudományban a legnehezebb dolog, ahogy szerintem Feynman mondta, hogy ne csapjuk be magunkat” – mondja Szostak. A lehetséges megoldás izgalmas volt, “és azt hiszem, csak elvakított minket arra, hogy mi történik”. Hozzáteszi, a “mentsvár” az, hogy maguktól fedezték fel a hibákat, bár azt kívánta, bárcsak ez még “a cikk megjelenése előtt történt volna, nem pedig utána”. Azt mondanám, hogy sok elképzelésünk végül tévesnek bizonyul, de általában elég gyorsan rájövünk erre.”
Optimistán tekint más laboratóriumok legújabb felfedezéseinek lehetőségeire; például John Sutherland, az angolországi Cambridge-ben működő Medical Research Council (MRC) Laboratory of Molecular Biology laboratóriumának munkatársa nemrég felfedezett egy új technikát a nukleotidok aktiválására – ezen építőelemek kémiai módosítására a replikációs folyamat működtetése érdekében. Sutherland még a publikálás előtt megosztotta ezeket az eredményeket Szostak laboratóriumával, és Szostak azt mondja, hogy vizsgálják, hogyan lehetne ezt a technikát beépíteni a saját kísérleteikbe.
Mihelyt a csapata működő, RNS-darabokat tartalmazó protocellákat állít össze, azt várják, hogy néhány specifikus RNS-szekvenciában lévő információ bizonyos előnyöket biztosít az azt körülvevő protocellának. Korábbi munkák például arra utalnak, hogy egyes RNS-szekvenciák olyan ribozimokká hajthatók össze, amelyek kissé fejlettebb lipideket állíthatnak elő a sejtmembrán számára. “Minden olyan RNS-szekvencia, amely bármit tesz, ami segíti a saját sejtjeit a túlélésben vagy a gyorsabb szaporodásban, elkezdi átvenni az uralmat a populáció felett” – magyarázza Szostak. “Ez a darwini evolúció kezdete. És akkor újra biológusok leszünk.”
A Nobel-díj elnyerése után Szostak elhagyhatta volna a laboratóriumot, hogy utazásoknak és előadói meghívásoknak szentelje magát, de “Ő továbbra is a tudományra koncentrál” – mondja Gerald Joyce. “Ez az, amit a legjobban csodálok benne.” Egyesek talán intellektuális luxusnak tartják az alapkutatást, de annak művelői azt állítják, hogy minden alkalmazott tudomány az alapkutatás eredményeiből indul ki. “Amikor Crick és Watson leült, és elkezdett kartonpapír modelleket készíteni a DNS szerkezetéről, fogalmuk sem volt arról, hogy 70 évvel később ez egy dollármilliárdokat érő iparágat fog létrehozni” – jegyzi meg John Sutherland.
Szostak továbbra is elkötelezett a nagy, kihívást jelentő kérdések aprítása mellett, folytatva az évtizedek munkáját. “Remélem, hogy képes leszek felépíteni egy fejlődő cellás rendszert, mielőtt nyugdíjba vonulok” – mondja. Optimista az esélyeit illetően. “Azt hiszem, közeledünk a célhoz. Van még néhány nehéz probléma, aztán azt hiszem, néhány éven belül remélhetőleg minden megoldódik”.