- Geometriatáblázat
- TANULÁSI CÉLOK
- FONTOS TUDOMÁNYOK
- Főbb pontok
- Főbb fogalmak
- VSEPR modell
- Molekuláris geometriák
- How to Determine Molecular Geometry – YouTube: Ez a videó az egyszerű molekulák fő geometriai alakjainak gyors meghatározására szolgáló egyik módszert ismerteti.
- Molekuláris geometriák
- TANULÁSI CÉLOK
- FONTOS FELADATOK
- Főpontok
- Főbb fogalmak
- AXE módszer
- Fő geometriák (magányos elektronpárok nélkül):
- Trigonális sík
- Tetraéderes
- Octaéderes
- Interaktív: Elektrongeometria: A molekulák a megosztott és nem megosztott elektronok mintázata miatt különböző alakot vesznek fel. Ezekben a példákban a molekulák alakját befolyásoló összes elektron megosztott az atomokat a molekulák kialakításához összetartó kovalens kötésekben.
- Magányos elektronpárok
- TANULÁSI CÉLOK
- FONTOS TUDOMÁNYOK
- Főbb pontok
- Főbb kifejezések
- Molekuláris geometriák magányos elektronpárokkal
- Koordinációs szám és a központi atom
- A magányos pár elektronjainak taszító hatása
- Interaktív: A nem megosztott elektronok és a “hajlított” forma: A 3D modell segítségével láthatjuk, hogy a hidrogén és az oxigén közötti kötésekben a nem megosztott elektronok hogyan taszítják a megosztott elektronokat, ami a molekula “hajlított” alakját okozza.
- LICENCIA ÉS ATTRIBUTIÓK
- CC LICENCIZÁLT TARTALOM, MEGOSZTOTT ELŐZET
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Geometriatáblázat
A VSEPR elmélet meghatározza a molekuláris geometriákat (lineáris, trigonális, trigonális bipiramis, tetraéderes és oktaéderes).
TANULÁSI CÉLOK
Alkalmazza a VSEPR modellt egy olyan molekula geometriájának meghatározására, amely nem tartalmaz magányos elektronpárokat a központi atomon.
FONTOS TUDOMÁNYOK
Főbb pontok
- A VSEPR-modell elmélete szerint a negatív elektromos töltéssel rendelkező területek taszítják egymást, így azok (és az általuk képzett kémiai kötések) a lehető legtávolabb maradnak egymástól.
- A molekuláris geometriák figyelembe veszik az atomok számát és a magányos elektronpárok számát.
- A magányos elektronpár nélküli fő geometriák a következők: lineáris, trigonális, tetraéderes, trigonális bipiramis és oktaéderes.
Főbb fogalmak
- VSEPR elmélet: egy kémiai modell, amelyet az elektronpárok elektrosztatikus taszításán alapuló egyedi molekulák alakjának előrejelzésére használnak
VSEPR modell
A valenciahéj elektronpár-taszítás (VSEPR) modell az atomok legkülső (valencia) héjában lévő kötő és nem kötő elektronpárokra összpontosít, amelyek két vagy több másik atomhoz kapcsolódnak.
A VSEPR-modell alapvetően azt tételezi fel, hogy ezek a negatív elektromos töltéssel rendelkező területek taszítják egymást, ami azt eredményezi, hogy ezek (és az általuk kialakított kémiai kötések) a lehető legtávolabb maradnak egymástól. Ezért az egyszerű háromatomos molekulában található két elektronfelhő ![]() ellentétes irányban fog kinyúlni. A 180°-os szögeltolódás a két kötési pályát a lehető legtávolabbra helyezi egymástól; ezért azt várjuk, hogy a két kémiai kötés ellentétes irányban nyúlik ki, így egy lineáris molekula jön létre.
ellentétes irányban fog kinyúlni. A 180°-os szögeltolódás a két kötési pályát a lehető legtávolabbra helyezi egymástól; ezért azt várjuk, hogy a két kémiai kötés ellentétes irányban nyúlik ki, így egy lineáris molekula jön létre.

 képlethez. A két X atom (fehérrel) 180°-ra van egymástól.
képlethez. A két X atom (fehérrel) 180°-ra van egymástól.Ha a központi atom egy vagy több nem kötő elektronpárt is tartalmaz, akkor ezek a további negatív töltésű területek hasonlóan viselkednek, mint a kötődött atomokhoz kapcsolódóan. A különböző kötő és nem kötő párokat tartalmazó orbitálisok a valenciahéjban a központi atomtól olyan irányban nyúlnak ki, hogy a kölcsönös taszításuk minimális legyen. Ha a központi atom részlegesen foglalt d-orbitálisokkal rendelkezik, akkor öt vagy hat elektronpárt is képes lehet befogadni, olyasmit alkotva, amit néha “kiterjesztett oktettnek” neveznek.”
Molekuláris geometriák
A molekuláris geometriákat (lineáris, trigonális, tetraéderes, trigonális bipiramidális és oktaéderes) a VSEPR elmélet határozza meg. A VSEPR elméletet alkalmazó geometriák táblázata megkönnyítheti a molekulák rajzolását és megértését. A molekulageometriák táblázata az első ábrán található. A második ábra a táblázat szemléltetésére szolgál.


How to Determine Molecular Geometry – YouTube: Ez a videó az egyszerű molekulák fő geometriai alakjainak gyors meghatározására szolgáló egyik módszert ismerteti.
Molekuláris geometriák
A VSEPR elmélet az egyszerű molekulák öt fő alakját írja le: lineáris, trigonális sík, tetraéder, trigonális bipiramis és oktaéder.
TANULÁSI CÉLOK
A VSEPR-modell alkalmazása olyan molekulák geometriájának meghatározására, ahol a központi atom egy vagy több magányos elektronpárt tartalmaz.
FONTOS FELADATOK
Főpontok
- Lineáris:
 típusú egyszerű háromatomos molekula; két kötési pályája 180° távolságra van egymástól.
típusú egyszerű háromatomos molekula; két kötési pályája 180° távolságra van egymástól. - Trigonális síkú: háromszög alakú és egy síkban, 120°-os kötésszögekkel.
- Tetraéderes: négy kötés egy központi atom körül, 109,5°-os kötésszögekkel.
- Trigonális bipiramis: öt atom a központi atom körül; három egy síkban, 120°-os kötésszögekkel és kettő a molekula ellentétes végein.
- Oktáéderes: hat atom a központi atom körül, mindegyik 90°-os kötésszögekkel.
Főbb fogalmak
- VSEPR elmélet: A Valenciahéj elektronpár-taszítás (VSEPR) modell az egyes molekulák alakjának előrejelzésére szolgál az elektronpáros elektrosztatikus taszítás mértéke alapján
AXE módszer
A molekulák geometriájának egy másik módja az elektronszámlálás “AXE-módszere”. Az AXE-ben az A jelöli a központi atomot, és mindig van egy implicit egyes indexe; X jelöli a központi és a külső atomok közötti szigma kötések számát (több kovalens kötés – kettős, hármas stb. – egy X-nek számít); és E jelöli a központi atomot körülvevő magányos elektronpárok számát. Az X és E összege, amelyet sztérikus számnak nevezünk, a valenciakötés-elmélet által használt hibridizált pályák teljes számához is kapcsolódik. A VSEPR az X-ek és E-k sztérikus számát és eloszlását használja a molekulák geometriai alakjának előrejelzésére.

Megjegyezzük, hogy a geometriákat csak az atomok helyzete szerint nevezzük meg, nem az elektronelrendezés szerint.

Fő geometriák (magányos elektronpárok nélkül):
A lineáris modellben az atomok egyenes vonalban kapcsolódnak egymáshoz, és a kötésszög egyszerűen a két szomszédos kötés közötti geometriai szög. Egy egyszerű, ![]() típusú háromatomos molekulának a két kötési pályája 180° távolságra van egymástól. Olyan háromatomos molekulákra, amelyek esetében a VSEPR elmélet lineáris alakot jósol, példaként említhető a
típusú háromatomos molekulának a két kötési pályája 180° távolságra van egymástól. Olyan háromatomos molekulákra, amelyek esetében a VSEPR elmélet lineáris alakot jósol, példaként említhető a ![]() (amely nem rendelkezik elegendő elektronnal ahhoz, hogy megfeleljen az oktett-szabálynak) és a
(amely nem rendelkezik elegendő elektronnal ahhoz, hogy megfeleljen az oktett-szabálynak) és a ![]() . A szén-dioxid elektronpontos képletének felírásakor vegyük észre, hogy a C-O kötések kettős kötések; ez a VSEPR elmélet számára nem jelent különbséget. A központi szénatom továbbra is két másik atomhoz kapcsolódik. A két oxigénatomot összekötő elektronfelhők 180°-ban helyezkednek el egymástól.
. A szén-dioxid elektronpontos képletének felírásakor vegyük észre, hogy a C-O kötések kettős kötések; ez a VSEPR elmélet számára nem jelent különbséget. A központi szénatom továbbra is két másik atomhoz kapcsolódik. A két oxigénatomot összekötő elektronfelhők 180°-ban helyezkednek el egymástól.

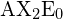 ként szerepel.
ként szerepel.Trigonális sík
A trigonális sík alakú molekulák háromszög alakúak és egy síkban, vagy sík felületen állnak. Egy ![]() molekulának, például az
molekulának, például az ![]() molekulának három elektronsűrűségű régiója van, amelyek a központi atomtól kifelé nyúlnak. Az ezek közötti taszítás akkor lesz a legkisebb, ha bármelyik kettő közötti szög 120o.
molekulának három elektronsűrűségű régiója van, amelyek a központi atomtól kifelé nyúlnak. Az ezek közötti taszítás akkor lesz a legkisebb, ha bármelyik kettő közötti szög 120o.
Tetraéderes
A tetra- négyet jelent, a -éderes pedig egy szilárd test egyik oldalára vonatkozik; a “tetraéderes” szó szerint azt jelenti, hogy “négy oldala van”. ” Ezt az alakot akkor találjuk, ha egy központi atomon négy kötés van, magányos elektronpárok nélkül. A VSEPR elmélet szerint az elektronkötések közötti kötésszögek 109,5o. A tetraéderes molekulára példa a metán ![]() . A négy egyenértékű kötés három dimenzióban négy geometriai szempontból egyenértékű irányba mutat, ami megfelel a szénatomra központosított tetraéder négy sarkának.
. A négy egyenértékű kötés három dimenzióban négy geometriai szempontból egyenértékű irányba mutat, ami megfelel a szénatomra központosított tetraéder négy sarkának.

A trigonális bipiramis alakja akkor alakul ki, ha a molekulában egy központi atomot öt atom vesz körül. A geometriában három atom egy síkban van, 120°-os kötésszögekkel; a másik két atom a molekula ellentétes végein helyezkedik el. A periódusos rendszer 15. csoportjának egyes elemei ![]() típusú vegyületeket alkotnak; ilyen például a
típusú vegyületeket alkotnak; ilyen például a ![]() és a
és a ![]() .
.

Octaéderes
Az okta- nyolcat jelent, a -éderes pedig a szilárd test egyik oldalára vonatkozik, így az “oktaéderes” szó szerint azt jelenti, hogy “nyolc oldala van”. A kötésszögek mindegyike 90°, és ahogyan négy elektronpár minimális taszítást tapasztal, amikor egy tetraéder sarkai felé irányul, úgy hat elektronpár próbál az oktaéder sarkai felé mutatni. Egy példa az oktaéderes molekulára (![]() ) a kén-hexafluorid (
) a kén-hexafluorid (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktív: Elektrongeometria: A molekulák a megosztott és nem megosztott elektronok mintázata miatt különböző alakot vesznek fel. Ezekben a példákban a molekulák alakját befolyásoló összes elektron megosztott az atomokat a molekulák kialakításához összetartó kovalens kötésekben.
Magányos elektronpárok
A nem kötő elektronok olyan pályákon vannak, amelyek helyet foglalnak, taszítják a többi pályát, és megváltoztatják a molekula alakját.
TANULÁSI CÉLOK
Tudja felismerni a magányos elektronpárok hatását a molekulák geometriájára.
FONTOS TUDOMÁNYOK
Főbb pontok
- A valenciahéjban lévő különböző kötő és nem kötő párokat tartalmazó pályák a központi atomtól olyan irányokban nyúlnak ki, amelyek minimalizálják taszításukat.
- Egy nem kötő orbitálisnak nincs atommag a távoli végén, amely az elektronfelhőt magához vonzaná; az ilyen orbitálisban lévő töltés ezért a központi atomhoz közelebb koncentrálódik.
- A nem kötő orbitálisok nagyobb taszítást gyakorolnak más orbitálisokra, mint a kötő orbitálisok.
Főbb kifejezések
- Koordinációs szám: a kémiában és a kristályográfiában a központi atom szomszédainak száma egy molekulában vagy kristályban
- magányos pár: Két elektronból álló valenciahalmaz, amely kötés vagy más atomokkal való megosztás nélkül létezik
Molekuláris geometriák magányos elektronpárokkal
Eleddig csak a magányos elektronpárok nélküli geometriákat tárgyaltuk. Ahogy valószínűleg észrevetted a geometriák táblázatában és az AXE módszerben, a magányos párok hozzáadása megváltoztatja a molekula alakját. Korábban említettük, hogy ha a központi atom egy vagy több nem kötő elektronpárt is tartalmaz, akkor ezek a további negatív töltésű területek hasonlóan viselkednek, mint a kötött atomokhoz kapcsolódóan. A különböző kötő és nem kötő párokat tartalmazó orbitálisok a valenciahéjban a központi atomtól olyan irányokban fognak kinyúlni, amelyek minimalizálják a kölcsönös taszításukat.

Koordinációs szám és a központi atom
A koordinációs szám az adott atomot, gyakran központi atomnak nevezett atomot körülvevő elektronpárok számára utal. A magányos párokat tartalmazó molekulák geometriája különbözni fog a magányos párokat nem tartalmazó molekuláktól, mivel a magányos pár üres térnek tűnik a molekulában. A geometria mindkét osztályát olyan képzeletbeli geometriai alakzatok (többnyire szabályos tömör sokszögek) alakjáról nevezték el, amelyek középpontja a központi atom lenne, és amelyeknek minden csúcsán egy-egy elektronpár lenne.
A vízmolekulában (![]() ) a központi atom
) a központi atom ![]() , és a Lewis-féle elektronpont-képlet azt jósolja, hogy két pár nem kötő elektron lesz. Az oxigénatom tehát tetraéderesen koordinált lesz, ami azt jelenti, hogy a tetraéder középpontjában helyezkedik el. A koordinációs pozíciók közül kettőt az O-H kötéseket alkotó közös elektronpárok foglalnak el, a másik kettőt pedig a nem kötő elektronpárok. Ezért, bár az oxigénatom tetraéderesen koordinált, a
, és a Lewis-féle elektronpont-képlet azt jósolja, hogy két pár nem kötő elektron lesz. Az oxigénatom tehát tetraéderesen koordinált lesz, ami azt jelenti, hogy a tetraéder középpontjában helyezkedik el. A koordinációs pozíciók közül kettőt az O-H kötéseket alkotó közös elektronpárok foglalnak el, a másik kettőt pedig a nem kötő elektronpárok. Ezért, bár az oxigénatom tetraéderesen koordinált, a ![]() molekula kötésgeometriája (alakja) hajlítottnak írható le.
molekula kötésgeometriája (alakja) hajlítottnak írható le.

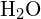 molekula kötési geometriája (alakja) hajlítottnak írható le.
molekula kötési geometriája (alakja) hajlítottnak írható le.A magányos pár elektronjainak taszító hatása
A kötő és nem kötő elektronpályák között fontos különbség van. Mivel egy nem kötő pályának nincs atommag a távoli végén, amely az elektronfelhőt magához vonzaná, az ilyen pálya töltése a központi atomhoz közelebb koncentrálódik; ennek következtében a nem kötő pályák nagyobb taszítást gyakorolnak más pályákra, mint a kötő pályák. A ![]() -ben a két nemkötő pálya közelebb tolja egymáshoz a kötő pályákat, így a H-O-H szög 104,5° lesz a 109,5°-os tetraéderes szög helyett.
-ben a két nemkötő pálya közelebb tolja egymáshoz a kötő pályákat, így a H-O-H szög 104,5° lesz a 109,5°-os tetraéderes szög helyett.
A ![]() elektronpontos szerkezete egy pár nemkötő elektront helyez a nitrogénatom valenciahéjába. Ez azt jelenti, hogy három kötött atom és egy magányos pár van a nitrogén körüli négyes koordinációs számhoz, ugyanúgy, mint ahogyan a
elektronpontos szerkezete egy pár nemkötő elektront helyez a nitrogénatom valenciahéjába. Ez azt jelenti, hogy három kötött atom és egy magányos pár van a nitrogén körüli négyes koordinációs számhoz, ugyanúgy, mint ahogyan a ![]() -ben is előfordul.
-ben is előfordul.

 Lewis pontszerkezete…: A központi nitrogénhez kapcsolódó magányos pár a tetraéderes 109,5°-tól eltérő kötésszögeket hoz létre.
Lewis pontszerkezete…: A központi nitrogénhez kapcsolódó magányos pár a tetraéderes 109,5°-tól eltérő kötésszögeket hoz létre.Ezért megjósolhatjuk, hogy a három hidrogénatom a nitrogénatomra központosított tetraéder sarkaiban fog elhelyezkedni. A magányos pár orbitálisa a tetraéder negyedik sarka felé fog mutatni, de mivel ez a pozíció üres lesz, maga a ![]() molekula nem lehet tetraéderes, hanem piramis alakot vesz fel, pontosabban egy trigonális piramis (háromszög alaprajzú piramis) alakját. A hidrogénatomok mind egy síkban helyezkednek el, a nitrogén a síkon kívül helyezkedik el. A nem kötő elektronok kissé összenyomják a kötési pályákat, így a H-N-H kötésszögek körülbelül 107°-osak.
molekula nem lehet tetraéderes, hanem piramis alakot vesz fel, pontosabban egy trigonális piramis (háromszög alaprajzú piramis) alakját. A hidrogénatomok mind egy síkban helyezkednek el, a nitrogén a síkon kívül helyezkedik el. A nem kötő elektronok kissé összenyomják a kötési pályákat, így a H-N-H kötésszögek körülbelül 107°-osak.
A magányos párokat tartalmazó 5 koordinált molekulákban ezek a nem kötő pályák (amelyek közelebb vannak a központi atomhoz, és így nagyobb valószínűséggel taszítják őket más pályák) előnyösen az egyenlítői síkban helyezkednek el. Ezáltal 90°-os szögben helyezkednek el legfeljebb két tengelyirányú kötőpályához képest. Ezért megjósolhatjuk, hogy egy ![]() molekula (amelyben a központi A atom négy másik X atomhoz és egy nem kötő elektronpárhoz van koordinálva), mint például a
molekula (amelyben a központi A atom négy másik X atomhoz és egy nem kötő elektronpárhoz van koordinálva), mint például a ![]() , “fűrészes” alakú lesz.
, “fűrészes” alakú lesz.

A nem kötő párokat kötődő atomok helyettesítve a háromszög alakú bipiramis koordináció még egyszerűbb molekulaformákra redukálódik.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interaktív: A nem megosztott elektronok és a “hajlított” forma: A 3D modell segítségével láthatjuk, hogy a hidrogén és az oxigén közötti kötésekben a nem megosztott elektronok hogyan taszítják a megosztott elektronokat, ami a molekula “hajlított” alakját okozza.
LICENCIA ÉS ATTRIBUTIÓK
CC LICENCIZÁLT TARTALOM, MEGOSZTOTT ELŐZET
- Kuráció és felülvizsgálat. Rendelkezésre bocsátotta: Boundless.com. Licenc: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenc: CC BY-SA: Attribution-ShareAlike
- Molekuláris geometria. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/Molecular_geometry. Licenc: CC BY-SA: Attribution-ShareAlike
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licenc: CC BY-SA: Attribution-ShareAlike
- Molekuláris geometria. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/Molecular_geometry. Licenc: Public Domain:
- VSEPR geometriák. Provided by: Wikimedia. Található a következő címen: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenc: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Található a következő címen: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenc: Public Domain: Nincs ismert szerzői jog. Licencfeltételek:
- Linear-3D-balls. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenc: CC BY: Attribution
- Molekuláris geometria. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/Molecular_geometry. Licenc: CC BY-SA: Attribution-ShareAlike
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenc: CC BY-SA: Attribution-ShareAlike
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licenc: CC BY-SA: Attribution-ShareAlike
- Molekuláris geometria. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/Molecular_geometry. Licenc: Public Domain:
- VSEPR geometriák. Provided by: Wikimedia. Található a következő címen: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenc: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Található a következő címen: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenc: Public Domain: Nincs ismert szerzői jog. Licencfeltételek:
- Linear-3D-balls. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenc: CC BY: Attribution
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenc: Public Domain: Nincs ismert szerzői jog
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenc: Public Domain: No Known Copyright
- koordinációs szám. Provided by: Wiktionary. Található a következő címen: http://en.wiktionary.org/wiki/coordination_number. Licenc: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. 2013. szeptember 18. Provided by: OpenStax CNX. Található a következő címen: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licenc: CC BY: Attribution
- Boundless. Provided by: Boundless Learning. Található a következő címen: http://www.boundless.com//chemistry/definition/lone-pair. Licenc: CC BY-SA: Attribution-ShareAlike
- Molekuláris geometria. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/Molecular_geometry. Licenc: Public Domain:
- VSEPR geometriák. Provided by: Wikimedia. Található a következő címen: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licenc: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Található a következő címen: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licenc: Public Domain: Nincs ismert szerzői jog. Licencfeltételek:
- Linear-3D-balls. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licenc: CC BY: Attribution
- VSEPR elmélet. Provided by: Wikipedia. Található a következő címen: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenc: Public Domain: Nincs ismert szerzői jog
- VSEPR elmélet. Provided by: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licenc: Public Domain: Nincs ismert szerzői jog
- VSEPR elmélet. Provided by: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory. Licenc: Public Domain: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Provided by: Wikimedia. Located at: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licenc: Public Domain: No Known Copyright
egy kémiai modell, amelyet az egyes molekulák alakjának előrejelzésére használnak az elektron-páros elektrosztatikus taszítás alapján
a molekula vagy ion központi atomjával közvetlenül szomszédos atomok összessége
kettő (egy pár) valenciaelektron, amelyeket nem használnak fel kovalens kötés kialakítására
.