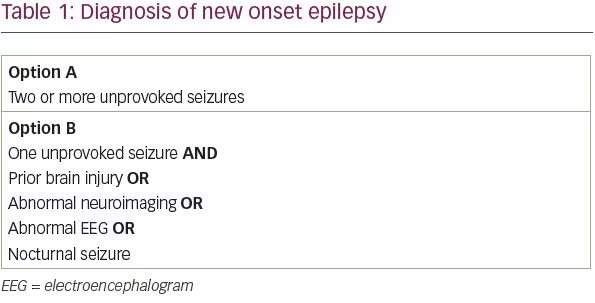
A Nemzetközi Epilepsziaellenes Liga (ILAE) 2014-ben felülvizsgálta az epilepszia definícióját, hogy maximalizálja az epilepsziás betegek korai felismerését és kezelését.1 Az ILAE 2005-ben fogalmazta meg először az epilepszia fogalmi meghatározását, amely szerint “az agy olyan rendellenessége, amelyet az epilepsziás rohamok kiváltására való tartós hajlam jellemez”. A gyakorlatban ez a meghatározás olyan betegeknek felelt meg, akiknél két vagy több, 24 óránál hosszabb időközönként bekövetkező, nem provokált rohamot észleltek. Tudjuk azonban, hogy nem minden olyan betegnél, akinek egyetlen kiváltás nélküli rohama van, egyforma valószínűséggel fordul elő második roham. Az ILAE új definíciója szerint azok a betegek, akiknél egyetlen egyszeri nem provokált rohamot észleltek, és az ismétlődő roham valószínűsége meghaladja a 60%-ot, most már megfelelnek az epilepszia diagnózisának kritériumainak.
Az egyetlen nem provokált rohamot követő roham ismétlődésének kockázatát vizsgáló tanulmányok szisztematikus áttekintésében a betegek 21-45%-a szenvedett újabb nem provokált rohamot az első két évben.2 Gyakorlati szempontból négy olyan kockázati tényezőt azonosítottak, amelyek megközelítőleg megduplázzák a betegnél a roham kiújulásának kockázatát: korábbi agysérülés, a feltételezett rohamfókusznak megfelelő rendellenes idegrendszeri képalkotó lelet, fókuszos vagy generalizált epileptiform kisülések az elektroenkefalogramon (EEG), vagy éjszakai roham3.-6 Így az egyszeri, nem provokált rohamot és e négy kockázati tényező legalább egyikét mutató betegeknél valószínűleg több mint 60%-os esélye van a roham kiújulásának, és epilepszia diagnosztizálható (1. táblázat).
Noha egy korai nagy tanulmány szerint a rendellenes neurológiai vizsgálat a roham kiújulásának fokozott kockázatával járt együtt, ugyanennek a csoportnak a követéses vizsgálata nem talált kockázatnövekedést.3,7 Ugyanez a követéses vizsgálat megállapította, hogy az epilepsziás testvér megléte növeli a kiújulás kockázatát az idiopátiás epilepsziás betegek körében, de még ezeknél a betegeknél is csak 46%-os a kiújulás kockázata 5 év múlva. Ezért a neurológiai vizsgálati eredményeket és az epilepszia családi anamnézisét figyelembe kell venni az első rohamot kapó beteg értékelésénél, de ezek a jellemzők önmagukban nem elegendőek az epilepszia diagnózisának felállításához.
Az antiepileptikus gyógyszeres kezelés figyelembevétele újonnan kezdődő epilepsziában
A legtöbb korai vizsgálatban, amely a kezdeti, nem provokált rohamot követő roham kiújulásáról szólt, antiepileptikummal (AED) kezelt és nem kezelt betegek egyaránt szerepeltek, ami megnehezíti a kiújuló roham valódi kockázatának becslését. A FIRST tanulmány szerint az első rohamot követően AED-et nem kapó betegek 51%-ánál fordult elő újabb roham 2 éven belül, míg az AED-et kapó betegek mindössze 25%-ánál fordult elő újabb roham ugyanezen időszakon belül.8 Későbbi vizsgálatok azonban kimutatták, hogy bár az AED-kezelés csökkenti a roham kiújulásának kockázatát a kezdeti rohamot követő első 2 éven belül, nem befolyásolja a hosszú távú rohamremisszió vagy az életminőség valószínűségét.9,10. Mivel a korai AED-kezelés nem garantálja, hogy megváltoztatja a beteg általános kimenetelét, és az AED-ek nem teljesen jóindulatú gyógyszerek, nem minden epilepsziával diagnosztizált beteg dönt a kezelés azonnali megkezdése mellett.
Az AED-kezeléssel kapcsolatos minden döntést a beteggel együttműködve, a kockázatok és előnyök gondos megvitatása után kell meghozni, mérlegelve a rohamok okozta károk kockázatát az AED-ek lehetséges káros hatásaival szemben. A beteg és az orvos AED-kezelés megkezdésére vonatkozó döntését befolyásoló egyik tényező lehet a nagyobb sérülés- vagy halálozási kockázattal járó rohamtípus, például a tónusos-klónikus rohamok vagy a status epilepticus jelenléte.11-13
Az epilepsziatípus jellemzése
A beteg epilepsziatípusának – fokális vagy generalizált – meghatározása a kezdeti diagnózis felállításakor fontos, mert segít a prognózis előrejelzésében és a megfelelő AED kiválasztásában. Ezt a meghatározást általában a rohamok szemiológiája, valamint a mágneses rezonanciás képalkotás (MRI) és az EEG leletei alapján végzik. A lateralizált motoros vagy szenzoros tünetek, az erőltetett szemferdülés vagy fejfordulás, automatizmusok, nyelvi zavarok és tapasztalati jelenségek fokális kezdetre utalnak, míg a kétoldali myoklonikus rángások vagy a kezdeti kétoldali tónusos aktivitás generalizált kezdetre utalnak.
A szemiológia önmagában azonban félrevezető lehet: a fokális rohamoknak a kezdetben hiányozhatnak a lateralizációs jellemzők, és a generalizált epilepsziás betegek több mint felének fokális rohamtünetei vannak.14 Ráadásul a fokális epilepsziás betegek háromnegyede legalább néhány rohama esetén amnesztikus, 30%-uk pedig minden rohama esetén amnesztikus.15 Továbbá a betegek akár 60%-ánál nincs a rohamaikat megelőző aura.16 Ezek a tényezők sok beteg esetében kihívássá teszik az epilepszia diagnózisát és jellemzését.
A legtöbb első rohamot kapó betegnél MRI-t kell végezni, kivéve, ha ellenjavallat áll fenn. Az MRI nagyobb hozammal rendelkezik, mint a komputertomográfia (CT) a fokális epileptogén elváltozások kimutatásában.17-19 A fokális elváltozás jelenléte megerősítheti a fokális kezdetet, ha az elváltozás helye megfelel a beteg szemiológiájának. Az egyértelmű elektroklinikai primer generalizált epilepsziás szindrómával, például juvenilis myoclonus epilepsziával rendelkező betegek esetében nem feltétlenül van szükség neuroimagingre.
Ha MRI-re kerül sor, az ajánlott szekvenciák közé tartozik a 3D T1 szekvencia 1 mm-es izotróp szeletekkel (pl., magnetizációval előkészített gyors gradiens echo ), axiális és koronális T2 és FLAIR szekvenciák ≤3 mm-es szeletekkel, valamint axiális T2* szekvencia a hemosiderin és meszesedés kimutatására (pl. szuszceptibilitás-súlyozott képalkotás vagy gradiens echo ).20 Kontrasztanyag nem szükséges minden betegnél, de 50 év feletti betegeknél megfontolandó, mivel ebben a korcsoportban nagyobb az áttétes vagy primer agydaganat valószínűsége. Ha lehetséges, a 3 Tesla MRI-t előnyben kell részesíteni az 1,5 Teslával szemben, mivel érzékenyebb az epileptogén elváltozásokra.21,22 Az utóbbi időben a 7 Tesla MRI-berendezések még tovább növelték az érzékenységet, de ezek általában csak kutatási protokollok keretében állnak rendelkezésre.23
Az EEG a másik lényeges modalitás az újonnan kezdődő epilepszia diagnosztizálásához és jellemzéséhez. Egyetlen rutin EEG elégtelen lehet az epileptiform eltérések kimutatására; egy nemrégiben végzett, 15 vizsgálatot tartalmazó metaanalízis szerint a rutin EEG érzékenysége 17%.24 E hozam növelése érdekében az orvosoknak fontolóra kell venniük egy meghosszabbított 60 perces EEG, egy alvásfüggő EEG vagy akár három sorozatos rutin EEG elvégzését.25-27 Az ambuláns EEG-felvételek szintén növelik az epileptiform eltérések kimutatásának valószínűségét; a meghosszabbított felvétel előnyei 48 óra után csökkennek, mivel a rendellenességek 95%-a ezen az időtartamon belül kerül kimutatásra28. A fekvőbeteg-video-EEG-vizsgálat speciális esetekben, például az epilepsziás rohamok megkülönböztetése a pszichogén nem epilepsziás rohamoktól, megfontolandó.29
Az epilepsziaellenes gyógyszer kiválasztása – fokális epilepszia
A SANAD-vizsgálat – az újonnan kezdődő fokális epilepszia első vonalbeli kezelése
Az újonnan kezdődő epilepsziában az AED-kezelés célja a rohamok kontrollálása egyetlen AED-vel a mellékhatások minimalizálása mellett. Bár számos gyógyszer áll rendelkezésre a fokális epilepszia kezelésére, kevés kontrollált vizsgálat áll rendelkezésre, amelyek összehasonlítanák hatékonyságukat és tolerálhatóságukat. A 2007-ben közzétett SANAD-vizsgálat egy korszakalkotó tanulmány volt, amelyben 1721 fókuszos epilepsziás beteget vizsgáltak, akiket karbamazepinnel, gabapentinnel, lamotriginnel, oxkarbazepinnel vagy topiramáttal kezeltek véletlenszerűen.30 Az elsődleges eredmény a kezelés kudarcáig eltelt idő volt, amelyet a gyógyszer abbahagyásaként definiáltak a nem kontrollált rohamok vagy mellékhatások miatt. A lamotrigin szignifikánsan jobb volt, mint a karbamazepin, a gabapentin és a topiramát, és nem szignifikánsan jobb, mint az oxkarbazepin. A 12 hónapos remisszióig eltelt idő tekintetében azonban a karbamazepin szignifikánsan jobb volt, mint a gabapentin, és nem szignifikánsan jobb, mint a lamotrigin, a topiramát és az oxkarbazepin30 .
A SANAD-vizsgálat eredményei arra utalnak, hogy a hatékonyság és a tolerálhatóság kombinációja miatt a lamotrigin a legjobb első vonalbeli kezelés a fokális epilepsziában, a karbamazepin pedig ésszerű alternatívát jelent azoknál a betegeknél, akik képesek tolerálni.
Újabb antiepileptikumok a fokális epilepszia első vonalbeli kezelésében
A SANAD-vizsgálat közzététele óta több új fokális epilepszia elleni gyógyszer került forgalomba. Bár kezdetben mindezeket a gyógyszereket kiegészítő kezelésként vizsgálták, ma már sokukat monoterápiaként alkalmazzák, és néhányat, különösen a levetiracetamot, ma már általánosan első vonalbeli kezelésként alkalmazzák. Ezen újabb gyógyszerek nagy előnye, hogy gyakori rohamokban szenvedő betegeknél az adagok gyorsan növelhetők, a Stevens-Johnson-szindróma kockázata nélkül, amely a lamotrigin és kisebb mértékben a karbamazepin ismert mellékhatása.
Az új AED-ek közül négyet – levetiracetam, zonisamid, lacosamid és eslicarbazepin – hasonlítottak össze a régebbi AED-ekkel randomizált, kontrollált vizsgálatokban, amint azt a 2. táblázat mutatja.31-41 A vizsgálatokat a PubMed klinikai vizsgálatok szűrője és a “monoterápia” és “” keresőkifejezések segítségével azonosították, és akkor vették figyelembe, ha olyan felnőtt, fokális epilepsziás betegeket vizsgáltak, akik egy újabb AED-et hasonlítottak össze a standard AED-ek egyikével (a SANAD-vizsgálatba bevontakkal).
A négy új AED közül a levetiracetam a legjobban tanulmányozott és a legszélesebb körben felírt; könnyű titrálhatósága és kedvező mellékhatásprofilja miatt nagyrészt ez vált az újonnan kezdődő epilepszia alapértelmezett első vonalbeli AED-jévé. A levetracetam ma már a leggyakrabban felírt első vonalbeli AED az idősebb felnőtteknél, a felírások 45,5%-át teszi ki.42 A vizsgálatok azt mutatták, hogy a levetiracetam hasonló hatékonysággal rendelkezik a régebbi AED-ekhez képest, bár egy vizsgálat alcsoport-elemzésében rosszabbnak bizonyult a karbamazepinnél (2. táblázat).
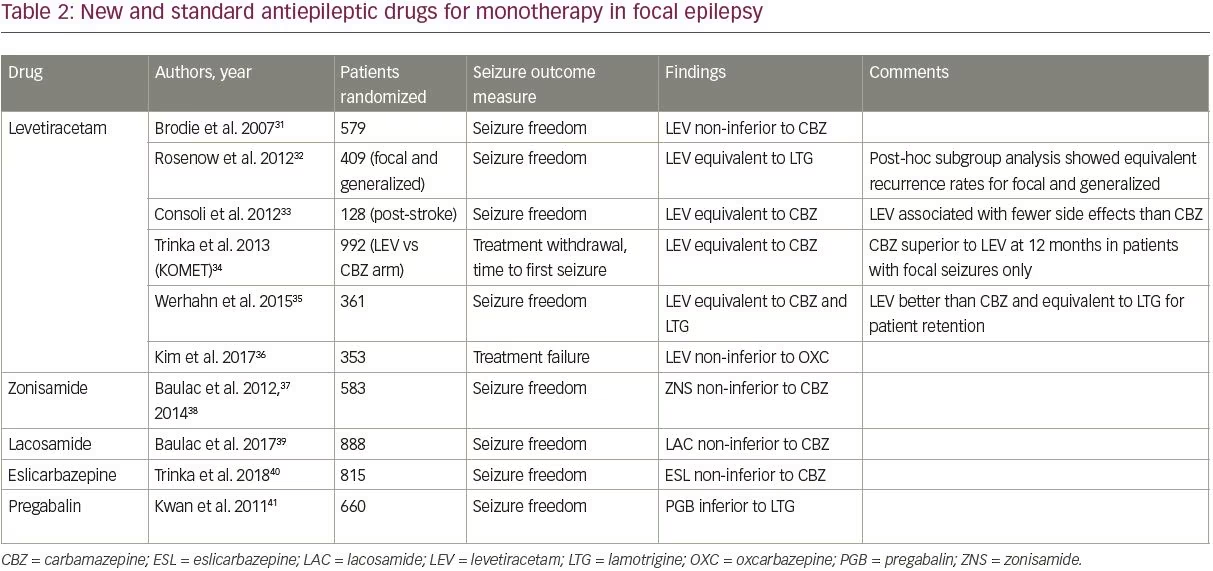
Fontos, hogy csak két vizsgálat hasonlította össze a levetiracetamot a lamotriginnel; mindkét vizsgálat hasonló hatékonyságot talált a két gyógyszer esetében.32,35 Jelenleg folyik a SANAD II vizsgálat fókuszos epilepsziás ága, amely a levetiracetam és a lamotrigin hosszú távú hatékonyságát és tolerálhatóságát összehasonlító legnagyobb vizsgálat lesz (ISRCTN30294119).
A levetiracetamon kívül az új AED-eket monoterápiaként értékelő jó minőségű adatok korlátozottak. A zoniszamid, a lakozamid és az eszlikarbazepin egy-egy vizsgálatban nem bizonyult rosszabbnak a karbamazepinnél (2. táblázat); a zoniszamidot a SANAD II vizsgálat fókuszos ágában is vizsgálják. Ez a három szer a beteg társbetegségeitől és ellenjavallataitól függően az első vonalbeli kezelés lehetőségének tekinthető. A pregabalint a lamotriginnel összehasonlítva is vizsgálták, és rosszabbnak bizonyult,41 ezért nem ajánlott
első vonalbeli kezelésként.
A brivaracetam jól tolerálható volt a politerápiáról monoterápiára való áttérés két randomizált vizsgálatában, de a vizsgálatok végén a brivaracetamot szedő betegek száma túl alacsony volt ahhoz, hogy monoterápiaként meghatározzák hatékonyságát;43 a régebbi AED-ekkel való közvetlen összehasonlításban szintén nem vizsgálták. Így jelenleg nincs elegendő bizonyíték arra, hogy a brivaracetam monoterápiát első vonalbeli kezelésként ajánljuk.
A klobazam, a perampanel és a cenobamát olyan új AED-ek, amelyek monoterápiaként is alkalmazhatók. Mind a klobazám, mind a perampanel hatékony és jól tolerált volt kis retrospektív vizsgálatokban, amelyekben fokális és generalizált epilepsziás betegek egyaránt részt vettek.44,45 A klobazám szintén jobbnak bizonyult a karbamazepinnél és a fenitoinnál egy gyermekbetegeken végzett randomizált vizsgálatban, de nem hasonlították össze közvetlenül a régebbi AED-ekkel felnőtt populációban.46 A cenobamát, a gyors és lassú nátriumcsatorna inaktiválást fokozó, napi egyszeri adagolású szer, a közelmúltban bizonyította hatékonyságát kiegészítő szerként fokális epilepsziás betegeknél, de monoterápiaként még nem vizsgálták.47
A fókuszos epilepszia első vonalbeli kezelésének összefoglalása
A ligetracetám ugyanolyan jól, vagy kissé rosszabbul teljesített, mint a régebbi AED-ek a fej-fej mellett végzett vizsgálatokban,31-36 és ésszerű első vonalbeli kezelés olyan betegeknél, akiknek nincs pszichiátriai előzménye, különösen akkor, ha a rohamok gyakoriak, vagy a betegeknek nehézséget okoz a lamotrigin titrálási ütemezése. Pszichiátriai társbetegséggel rendelkező betegek esetében a lamotrigint javasoljuk első vonalbeli kezelésként. A folyamatban lévő SANAD II vizsgálat véglegesebb választ fog adni arra a kérdésre, hogy e két AED közül melyik a jobb mind a hatékonyság, mind a tolerálhatóság tekintetében. A beteg társbetegségeitől és mellékhatástűrésétől függően a régebbi AED-ek (karbamazepin, oxkarbazepin, topiramát) és az újabb AED-ek (zoniszamid, lakozamid, eszlikarbazepin) közül több is ésszerű alternatíva lehet. A brivaracetám, a klobazám, a perampanel és a cenobamát a jövőben életképes lehetőségek lehetnek, de jelenleg nincs elegendő bizonyíték. A gabapentin és a pregabalin nem alkalmazható első vonalbeli kezelésként.
Az antiepileptikum kiválasztása – generalizált vagy nem osztályozott epilepszia
The SANAD trial-first-line treatment of new onset generalized epilepsy
A 2007-es SANAD vizsgálat tartalmazott egy második kart is, amely generalizált epilepsziás vagy a kezelés megkezdésekor véglegesen nem osztályozható epilepsziás betegeket vizsgált.48 A valproát szignifikánsan jobb volt a topiramátnál a kezelés sikertelenségéig eltelt idő tekintetében az általános elemzésben, és szignifikánsan jobb volt mind a topiramátnál, mind a lamotriginnél a generalizált epilepszia megerősített diagnózisával rendelkező betegeknél. A 12 hónapos remisszióig eltelt idő tekintetében a valproát mindkét csoportban szignifikánsan jobb volt, mint a lamotrigin, de egyik csoportban sem különbözött szignifikánsan a topiramáttól. Így a valproát tűnt a három vizsgált gyógyszer közül a hatékonyság és a tolerálhatóság legjobb kombinációjának.
A valproát SANAD-ban elért sikere ellenére a vizsgálati környezeten kívüli alkalmazása problémás a mellékhatásai miatt. A szülőképes korú nők körében a valproát teratogenitás miatt ellenjavallt, mivel jelentősen növeli a veleszületett rendellenességek és a hosszú távú neurokognitív deficitek kockázatát.49-52 2018-tól az Európai Unió betiltotta a valproát alkalmazását a szülőképes korú nőknél, kivéve, ha azok terhességmegelőző programban vesznek részt.53 A valproátnak számos egyéb nemkívánatos mellékhatása is van, többek között súlygyarapodás, hajhullás, policisztás ovárium szindróma és hepatikus enkefalopátia.54-57 Alternatív első vonalbeli kezelésekre van szükség, különösen a szülőképes korú nők esetében.
A valproát újabb alternatívái a generalizált epilepszia kezelésére
A levetiraketám a generalizált epilepszia legátfogóbban vizsgált új AED-je. A fent leírt monoterápiás vizsgálatok közül kettőben generalizált epilepsziás betegek is részt vettek.32,34 A KOMET vizsgálatban a levetiracetam egyenértékű volt a valproáttal mind a kezelés megvonási aránya, mind az első rohamig eltelt idő tekintetében.34 A levetiracetam a rohammentességi arány tekintetében is egyenértékűnek bizonyult a lamotriginnel egy heterogén mintában; az alcsoportok post-hoc elemzése azt mutatta, hogy ez mind a fokális, mind a generalizált epilepsziára igaz volt.32
Marson és munkatársai nemrégiben ismertették a SANAD II vizsgálat generalizált epilepsziás ágának eredményeit.58 A valproát jobb volt a levetiracetamnál a kezelés megszakadásáig eltelt idő, az első rohamig eltelt idő és a 24 hónapos remisszióig eltelt idő tekintetében. Érdekes módon a kezelés sikertelenségéig eltelt időbeli különbség inkább a nem megfelelő rohamok kontrolljának volt tulajdonítható, mint a mellékhatásoknak, ami arra utal, hogy a valproát nem volt rosszabbul tolerálható, mint a levetiracetam ebben a mintában.
Amint fentebb említettük, mind a klobazam, mind a perampanel jó hatékonyságúnak és tolerálhatónak bizonyult a generalizált epilepsziában szenvedő betegek bevonásával végzett retrospektív megfigyelési vizsgálatokban, de randomizált vizsgálatban egyik gyógyszert sem hasonlították össze a régebbi gyógyszerek egyikével sem.44,45 Tudomásunk szerint a többi új AED közül egyiket sem vizsgálták monoterápiaként generalizált epilepsziás betegeknél.
A generalizált és nem osztályozott epilepszia első vonalbeli kezelésének összefoglalása
Noha a SANAD II eredményei arra utalnak, hogy a valproát továbbra is a leghatékonyabb AED a generalizált vagy nem osztályozott epilepsziában, mellékhatásai miatt nem javasoljuk első vonalbeli kezelésként. A lamotrigin jó választás, ha a rohamok gyakorisága elég alacsony ahhoz, hogy lehetővé tegye a lassú dózisnövelést. Ha gyors kezdésre van szükség, a levetiracetam alkalmazható. Ha a rohamok e két szerre refrakterek, a kockázatok és előnyök gondos megbeszélése után valproát alkalmazható.
Tanácsadás újonnan kezdődő epilepsziás betegeknek
Az újonnan diagnosztizált epilepsziás betegeknek általában sok kérdésük van a betegséggel és annak az életükre gyakorolt hatásával kapcsolatban. A leggyakoribb kérdések az epilepszia hosszú távú prognózisára, az AED-kezelés megkezdésére és arra vonatkoznak, hogy az AED-kezelés egész életen át tart-e. A fentiek szerint a betegeket tájékoztatni kell arról, hogy az azonnali AED-kezelés csökkenti a rohamok korai kiújulásának kockázatát, de nem változtatja meg az epilepszia általános prognózisát, és az AED-kezelés megkezdéséről szóló döntést egyénre szabottan kell meghozni. A betegeket tájékoztatni kell arról, hogy a betegek körülbelül felénél az első AED-kezeléssel sikerül a rohamokat kontrollálni, míg további 20%-uk reagál a második vagy harmadik gyógyszerre.59 Továbbá, a betegeknek tisztában kell lenniük azzal, hogy az AED-kezelés abbahagyására irányuló kísérleteket csak legalább 2 év rohammentesség után szabad megkezdeni, és hogy a betegek közel felénél a rohamok kiújulnak az AED megvonása után.60
A rohamok kontrollján kívül a leggyakoribb gyakorlati kérdések a vezetéssel kapcsolatosak. Bármely tudatzavarral járó roham – abszolút, tónusos-klónikus vagy fokális tudatzavar – jelentős károkat okozhat, ha a beteg vezetés közben jelentkezik. A legtöbb államban egy rohammentes intervallumot írnak elő, mielőtt a beteg újra vezethetne. Az orvosoknak biztosítaniuk kell, hogy a betegek ismerjék államuk törvényeit. Egyes államokban az orvosok kötelesek jelenteni epilepsziás vagy rohamot kapó betegeiket a gépjármű-felügyeletnek, míg más államokban nem.61 Fontos megjegyezni, hogy a kötelező jelentéstétel nélküli államokban az orvosok nem feltétlenül élveznek jogi védelmet, ha a beteg beleegyezése nélkül közlik az epilepszia diagnózisát. Ezekben az esetekben az orvosoknak mérlegelniük kell a beteg további vezetésének kockázatát (különösen a kereskedelmi járművezetők esetében) a beteg titoktartási kötelezettségének megsértéséből eredő jogi következményekkel szemben. A vezetéssel kapcsolatos minden beszélgetést dokumentálni kell a beteg orvosi kartonjában.
A szülőképes korú nőket emellett tanácsokkal kell ellátni az epilepszia és az AED-ek terhességre gyakorolt hatásairól. A betegeknek tisztában kell lenniük azzal, hogy a rohamok, különösen a generalizált tónusos-klónikus rohamok és egyes AED-ek káros hatással lehetnek a fejlődő magzatra. Azoknál a nőknél, akik nem terveznek terhességet, a méhen belüli eszközzel vagy depot injekcióval történő hosszú hatású fogamzásgátlás előnyös, mivel ezek minimalizálják a felhasználói hiba lehetőségét. A betegeknek tudniuk kell azt is, hogy az enzimindukáló AED-ekkel történő kezelés csökkentheti a hormonális fogamzásgátlás hatékonyságát.62 Minden epilepsziás nőnek, aki terhességet tervez, előre tájékoztatnia kell neurológusát; ha a terhesség nem tervezett, a neurológust a lehető leghamarabb tájékoztatni kell. Ezenkívül minden szülőképes korú epilepsziás nőnek folsavat kell szednie, függetlenül attól, hogy a terhességet tervezik-e vagy sem, mivel ez csökkenti a neurális csődefektusok kockázatát, amelyek az első trimeszter korai szakaszában alakulnak ki, gyakran még a terhesség ismerete előtt.63
A legnehezebb téma, amelyet az újonnan diagnosztizált betegekkel meg kell beszélni, az epilepsziás hirtelen váratlan halál (SUDEP). A SUDEP kockázati tényezői közé tartozik a magas rohamgyakoriság, a korai életkor, a betegség hosszú időtartama, a generalizált tónusos-klónikus rohamok, az éjszakai rohamok, az egyedül élők, a férfi nem, az alkoholfüggőség és a szerrel való visszaélés.64-66 A legtöbb neurológus úgy véli, hogy minden epilepsziás beteget tájékoztatni kell a SUDEP-ről, míg egyesek szerint a SUDEP-tanácsadás csak a magas kockázatú betegek esetében szükséges.67 Javasoljuk, hogy a SUDEP-t minden újonnan kezdődő epilepsziás beteggel beszéljék meg a gyógyszeres kezelés betartásának fontosságáról szóló kezdeti megbeszélés részeként, a magas kockázatú betegek esetében pedig gyakoribb és kiterjedtebb tanácsadást javasolunk.