Az agy és a véralvadási folyamat közötti kölcsönhatásoknak hosszú története van, beleértve azt a megfigyelést is, hogy a központi idegrendszeren belüli véralvadási mechanizmus számos eltérést mutat a más szervekben találtaktól – az agy endotheliuma például kevés trombomodulint fejez ki.
Bármi legyen is a mechanizmus, nehéz elkerülni azt a megfigyelést, hogy az antikoagulációs kezelés (pl., alacsony molekulatömegű heparinnal) gyakran drámaian visszafordítja a tüneteket, beleértve a migrént, a memóriazavarokat és a kórképet. Ezek a megfigyelések arra utalnak, hogy az agyi patológia sok esetben talán nem is annyira infarktus, hanem inkább a vérellátás “elapadása” és az oxigénellátás károsodása lehet a háttérben.”
Migraine & Stroke
“Tinédzserként szenvedett fejfájástól?”
“Igen, doktor úr. Egy ideig szinte hetente voltak. Pár évre elmúltak, de mostanra hevesen visszatértek. A családomban előfordulnak.”
Így beszél a 30 éves APS-es nőbeteg (a család férfi tagjai ritkábban jelennek meg az APS-klinikákon).
Ez egy ilyen fontos diagnosztikai támpont a lehetséges APS-es beteg felmérésében. Mégis, az APS sokéves tapasztalata ellenére meglepően kevés adat áll rendelkezésre, amely az APS valódi szerepét értékeli a migrén tágabb világában. Nagyon sok ok van az asszociáció tanulmányozására – az antikoagulációra adott válasz – általában jó, gyakran feltűnő – a migrénes/APS-es betegek testvéreinek és más családtagjainak vizsgálata. És mindenekelőtt a migrén és a stroke között mostanában jelentett összefüggések.
Az APS/Hughes-szindróma nagyon is neurológiai állapot. Úgy tűnik, hogy az agyműködés valóban különösen érintett – minél több APS-beteget látunk, annál szélesebb & körben terjednek a neuropszichiátriai hullámok.
A migrénhez hasonlóan a stroke is az APS/Hughes-szindróma egyik elismert szövődménye. Olyan számadatokról számoltak be, hogy a fiatal (45 év alatti) stroke-osok közül minden ötödiknek pozitív az aPL-tesztje.14-19
Az aPL-nek a stroke etiológiájában való felismerése azonban a migrénhez hasonlóan általában még mindig gyenge. Például a klinikailag jól felismert gyermekkori stroke az aPL-vizsgálatok elsődleges célpontja.
Néhány évvel ezelőtt az Egyesült Királyság kormánya nagyszabású stroke-kezdeményezést indított, amely a lakosságot a stroke tüneteiről, jeleiről és kezeléséről tájékoztatja. Az antifoszfolipid szindróma nem szerepelt a listán.
Görcsrohamok
1985-ben megfigyeltük, hogy lupuszos betegeknél a pozitív aPL-tesztekkel rendelkező betegeknél gyakoribbak a rohamok.20 Azóta világossá vált, hogy az epilepszia minden formája az APS fontos kísérője. Olyannyira, hogy egy, a tinédzserek idiopátiás epilepsziáját vizsgáló tanulmányban minden ötödik esetben aPL-pozitívnak találták.21

Az első szülésznői vagy szülészorvosi szűrésnek tartalmaznia kell egy egyszerű kérdőívet az APS kizárására.
Image Credit: SPL/Science Source
A megfigyeléseknek számos következménye van. Hadd mondjak két klinikai példát:
Először is, az APS-ben a temporális lebeny epilepszia alulfelismert lehet. Egyik páciensem, egy klasszikus APS-ben szenvedő nő, EEG-technikus lett. A képzés során négy testvérét használta kísérleti nyúlként. Háromnak kóros halántéklebeny-aktivitása volt. Érdekes látni, hogy az APS-es betegek anamnézisfelvétele során milyen gyakran fordul elő epilepszia a családban.
A második klinikai anekdota máshol már megjelent.22 Egy 42 éves betegnek enyhe lupus volt a kórtörténetében. A fő problémája azonban – amely jelentős hatással volt elfoglalt életére – a visszatérő rohamok voltak, mind a petit mal, mind a grand mal rohamok, ez utóbbiak szakorvosi ellátást és többféle antiepileptikum kombinációját igényelték. Londoni tartózkodása alatt trombózis alakult ki nála (aPL-pozitívnak bizonyult), és rutinszerű véralvadásgátló kezelést kezdtek nála warfarinnal. Azonnali és váratlan előnye a rohamok gyakoriságának és súlyosságának jelentős csökkenése volt, ami sokkal kevésbé agresszív antiepileptikus kezelést igényelt.”
“A HALHASSZÜLETTSKANDÁLY: Az Egyesült Királyságban naponta három olyan csecsemő születik halva, aki élhetett volna. A brit nők 200 szülése közül egy halva születik. Itt az ideje, hogy az NHS új politikát és új hozzáállást alkalmazzon”. -The Times (London), 2012. nov. 28.
Memóriazavar
Az APS talán leggyakoribb megnyilvánulása a memóriazavar. A probléma gyakran csak akkor lát napvilágot, amikor a beteget megkérdezik a tünetről. Így sok beteg vallja be, hogy aggódik az Alzheimer-kór miatt. A mai napig kevés a részletes klinikai vizsgálat. Időről időre, és meg kell mondanunk, meglehetősen felületes módon, pszichometriai teszteket végeztünk kiválasztott APS-betegeken – és az eredmények gyakran meglepőek voltak. Annál is inkább, mivel az antikoaguláció megkezdésekor a memóriatesztekben feltűnő javulást tapasztaltak.23
Multiple Sclerosis
Az APS-ben észlelt neurológiai jellemzők, köztük a látászavarok és az ingadozó myelopathia előtérbe kerülése miatt nem meglepő, hogy az esetek egy részét MS-ként diagnosztizálják.24,25
A téma korántsem egyszerű. A neurológiában egyesek kijelentik, hogy a pozitív aPL-tesztek valójában néha a klasszikus MS-ben is előfordulnak. Én inkább megfordítanám a képet. Az ilyen betegek, legalábbis néhányan, először APS-esek lehetnek, és csak másodsorban MS-esek. Bár anekdotikusan számos ilyen eset reagál az antikoagulációra, másoknál a válasz a legjobb esetben is csak határeset. Uthman nemrégiben áttekintette az APS vs. MS meglehetősen jelentős szakirodalmát26.
Egyéb neurológiai jellemzők
Ezek közé tartoznak az egyensúlyzavarok (számos esetben Meniere-kórként jelentkezik), chorea (néha súlyos),27,28 anoszmia, alvászavarok (beleértve a kataplexiát és a narkolepsziát), és újabban autonóm zavarok, egy sor POTS (poszturális ortosztatikus tachycardia szindróma) esettel.29
Az egyik kérdés, amelyről vita folyik, a pszichiátriai manifesztációk gyakorisága.
Az volt a véleményem, hogy az akut pszichózis inkább a lupusz, mint az APS jellemzője, de ebben tévedhetek. Egyik betegem, egy APS-ben és OCD-ben (kényszerbetegségben) szenvedő nő, javult az antikoagulációs kezelés hatására. Érdekes módon a tizenéves fia, aki szintén OCD-s (és aPL-pozitív) beteg volt, azt tapasztalta, hogy a neuropszichiátriai megnyilvánulásai sokkal kevésbé voltak hangsúlyosak, amikor aszpirinkezelést kezdtek.
Nem az agy
Csont &ízületek – szenvedett már törést? Egy kérdés, amely talán nem része az APS-betegek rutinszerű anamnézisfelvételének. Pedig a spontán csonttörés egyre ismertebbé válik, miután Dr. Shirish Sangle 27 spontán lábközépcsonttörésről számolt be APS-betegeknél.30
Az egyéni beszámolók arra utalnak, hogy a (iszkémiás) csonttörések a betegség fontos manifesztációja lehetnek: Kollégámnak, Munther Khamashta professzornak van egy Hughes-szindrómás betege normális DEXA- és mellékpajzsmirigy-vizsgálatokkal, akinek 57 spontán törése volt. Nyilvánvaló, hogy ez a klinikai kutatás fontos területe.
Hasonlóképpen, az avaszkuláris nekrózis (AVN) okozta csípőfájdalom sem ritka APS-es betegeinknél. Az MRI korai AVN-t mutatott ki néhány olyan esetben, ahol nem volt más kockázati tényező, például szteroid. Klinikai benyomásom az, hogy a csípőfájdalom gyakran javul, ha heparint vagy warfarint kezdenek alkalmazni.
Szív-A fő aggodalomra ad okot az angina pectoris és más kardiális tünetek jelenléte APS-ben. A myocardialis ischaemiáról és koszorúér-trombózisról szóló néhány korai beszámoló ellenére csak az utóbbi években váltak gyakoribbá azok a publikációk, amelyek e szövődmények nagy gyakoriságát mutatják.
Két példa erre Greco és munkatársai kutatása, amely a pozitív aPL-tesztek viszonylag nagy gyakoriságát mutatja a szívizom ischaemiás betegeknél, valamint az a feltűnő megfigyelés, hogy a tablettát szedő, dohányzó nőknél, akik aPL pozitívak voltak, 22-szeres relatív kockázata volt a myocardialis infarktus kialakulásának.31,32.
A kardiológiai kapcsolatokat fokozza az X kardiális szindrómával, normális koszorúér-angiográfiával járó anginával való összefüggésről szóló jelentés.33 Joggal feltételezhető, hogy az aPL-vizsgálat a kardiológiai klinikák standardjává válik, különösen a 40 év alatti, tüneteket mutató nőknél.
A migrénhez hasonlóan a stroke is az APS/Hughes-szindróma egyik elismert szövődménye. Olyan számadatokról számoltak be, hogy 5-ből 1 fiatal (45 év alatti) stroke-os pozitív aPL-tesztet kapott.
GI traktus & máj-Mióta megfigyeléseinket a különböző artériák, köztük a cöliákus és a mesenterialis artériák fokális szűkületével kapcsolatban tettük, inkább az aPL/APS-ben szenvedő betegek hasi anginás tüneteire összpontosítottunk.34 Ezt az állapotot nehéz számszerűsíteni, de számos olyan esetet láttunk, akiknél a clopidogrel vagy a heparin az étkezés utáni fájdalom (néha kifejezett) javulását eredményezte.
Noha a máj érintettsége lupusban ritka, APS-ben gyakran látunk kóros májfunkciós teszteket. Bár ezek előre jelezhetnek súlyos májtrombózist, mint például a Budd-Chiari-szindróma vagy a terhességben a közelgő katasztrofális APS-re figyelmeztető HELLP-szindróma, gyakrabban jóindulatúbb a prognózisuk.35,36
Egy nagyon pozitív esetleírás:
Szegény a prognózis?
Több mint harminc évvel később is jól van, az orvosai által Portugáliában kezelt óvatos, élethosszig tartó warfarinnal.
Goldblatt-kór, a vese & APS – Az egyébként normális artériák világos hátterében látható veseartéria-szűkület utánozhatja Goldblatt korai megfigyeléseit a magas vérnyomás kialakulásáról kísérletileg elzáródott veseartériákkal rendelkező állatokban. A veseartéria-szűkület lokalizált elváltozásainak Sangle általi felfedezése más erekben is hasonló leletekhez vezetett, ami a lokalizált trombotikus/endothelialis patológiára vonatkozó elméletekhez vezetett.37
Bőr: livedo reticularis, egy rejtély – Bár a bőrfekélyek, a tágult vénák és a subungualis szálkás vérzések az APS-ben a bőr trombózisának jól ismert következményei, a livedo reticularis aura rejtélyes.38,39
Diagnosztikai szempontból jelenléte fontos támpont a Hughes-szindrómára gyanús betegeknél – beleértve a szeronegatív APS-t is.
A cikkben említett néhány állapotot – SM, migrén, többszörös törések, memóriaproblémák – áttekintve például elgondolkodhatunk azon, hogy a livedo reticularis jelenlétének vagy hiányának gondos feljegyzése jelentősnek bizonyulhat-e ezen állapotok differenciáldiagnózisában.
Egy dolog biztos: A livedo jelenléte további dimenziót ad a klinikai kép súlyosságához.
Várandósság
A szindróma főszereplője természetesen a terhesség, ahol az aPL-pozitív terhességeknél az egészséges szülések sikerességének aránya 15% alatti értékről 90% fölé emelkedett. Kétségtelen, hogy ezeknek az eseteknek a diagnózisa és kezelése jelentős előrelépést jelentett a szülészet világában.40
Szomorú, hogy mindannyian, akik az APS-szindrómával foglalkozunk, olyan aPL-pozitív betegeket láttunk el (akik közül néhányan korai vetélést szenvedtek), akik a terhesség késői szakaszában elvesztették a babát. Halva születés.
Két évvel ezelőtt a The Times of London vezető cikket közölt “A halva születési botrány” címmel, kiemelve az Egyesült Királyságban a halva születések rossz adatait.41 Pedig az aPL-pozitív nők halva születésének néhány esete megelőzhető lett volna. Egy nemrégiben készült utahi tanulmány például megállapította, hogy az aPL terhességeknél háromszoros-ötszörösére nőtt a halvaszületés esélye.42
Segítene a rutinszerűbb aPL-vizsgálat a terhesség során? A költségekkel kapcsolatos megfontolások érvényesek. A vetélés gyakori, és számos oka van. Ezért a jelenlegi ajánlás szerint a vizsgálatot azoknak a nőknek kell fenntartani, akiknél három vagy több vetélés történt. Ez valóban szigorúnak tűnik. Talán egy egyszerű szűrési folyamat segíthetne.
Azt javasoltam, hogy az első szülésznői vagy szülészorvosi szűrés része legyen egy egyszerű, három részből álló kérdőív:
- Volt már trombózisa?
- Migrénben szenved?
- Volt-e a családjában autoimmun betegség (pl., lupusz, RA, szklerózis multiplex, pajzsmirigybetegség)?
Bizonyos vagyok benne, hogy egy ilyen egyszerű kérdőív segíthet egy kis veszélyeztetett csoport azonosításában.
A legtöbb központban, miután az anyát és a babát biztonságosan hazaküldték, nincs hosszú távú követés. Mégis gyakran előfordul, hogy az APS-es betegek, akik mondjuk 40 éves korukban jelentkeznek trombotikus problémával, 20 évvel korábbi vetélésről számolnak be. Egy ideális világban a visszatérő vetélésekben szenvedő nők rendszeres hosszú távú nyomon követést érdemelnének. A világ azonban messze nem ideális.
Lupus & APS
Az APS korai klinikai vizsgálatai lupuszklinikákon zajlottak, és akár “lupuszos jellegzetességeket” is tartalmazhattak. Talán meglepő módon az idő kevés különbséget mutatott az elsődleges APS és a lupusszal társuló APS között. Kétségtelen, hogy vannak a lupusnak olyan klasszikus jellemzői (pl. Libman Sachs endocarditis, stroke, görcsrohamok), amelyek inkább az APS-hez kapcsolódnak. Az is valószínűnek tűnik, hogy az aPL-pozitivitás lupusban magasabb krónikus indexet kölcsönöz.
Az idő múlásával egy pozitív eredmény is napvilágot látott: Nagyon szokatlan, hogy az elsődleges APS-ben szenvedő betegeknél a későbbiekben lupusz alakuljon ki.
A nagy 3
A Hughes-szindróma, a Sjögren-kór és a pajzsmirigy alulműködés közötti kapcsolat olyan gyakori, hogy átvettem a “nagy 3” elnevezést. Klinikailag ez egy fontos társulás, mert a három betegség klinikai tünetei – fáradtság, hideg keringés, fájdalmak, egyensúly- és memóriazavarok – mindhárom betegségben közösek. Hasonlóképpen sok ilyen beteget terhel a fibromyalgia címke.
A három, egymással összefüggő szindróma mindegyike jól reagálhat a kezelésre – például a klinikai Sjögren-kór a hidroxiklorokinra és így tovább. Sok ilyen beteg az én kétfás kezelésemet kapja – fűzfa (aszpirin) és cinchona (kinin).
Seronegatív APS
Hiszem, hogy a klinikus gyakornok laborban töltött idejének egyik előnye annak felismerése, hogy sok laboratóriumi vizsgálat variálható. Sok-sok tanulmány próbálta felmérni a titer, az immunglobulin-osztály, a hármas vagy kettős pozitivitás, az “egyéb” aPL, például az anti-foszfatidil-szerin stb. jelentőségét.43,44
Tágabb értelemben mindezeknek van jelentősége, de a klinikumban néhány nem illik bele, például azok a betegek, akiknek az APS valamennyi klinikai jellemzője fennáll, és akiknek az aPL-tesztje megrögzötten negatív marad.
Néhány évvel ezelőtt írtunk egy tanulmányt, amelyben bevezettük a szeronegatív APS kifejezést, felhívva a figyelmet azokra a betegekre, akiknél az APS klinikai jellemzői erősek, de a tesztek negatívak.45 A fogalom a szeronegatív RA és a szeronegatív lupus korai időszakára nyúlik vissza – mindkét megjelölés, bár kizárólag klinikai megfigyelésen alapult, fontos terápiás és prognosztikai következményekkel járt.
A szeronegatív APS három lehetséges magyarázata: 1) A diagnózis téves (nem minden esetben valószínű); 2) a korábban pozitív tesztek idővel negatívvá váltak (tapasztalatom szerint nem gyakori); vagy 3) új tesztekre van szükség.46
A szeronegatív APS-sel kapcsolatos nyitottságra talán a leghatásosabb okot a családi vizsgálatok adják. Néhány hete láttam egy egypetéjű ikerpárt – az első klasszikus szeropozitív APS-szel, aki később magával hozta (teljesen) egypetéjű ikertestvérét is. A második ikertestvérnek azonos tünetegyüttesei voltak, de az első ikertől eltérően nála negatív volt az aPL-teszt. Mindkét beteg reagált a kezelésre.
Kórházunkban évente egyszer beteggyűlést tartunk. A legutóbbi találkozón egy egyszerű, anonim kérdőívet állítottunk össze két kérdéssel: Ön APS-es beteg vagy barátja/házastársa? Van-e önnek autoimmun betegségben (pl. lupusz, RA, RA, pajzsmirigy, szklerózis multiplex, APS) szenvedő közeli női rokona (testvére, anyja, nagynénje)? Az eredmény: A betegek hatvan százalékának közeli hozzátartozói autoimmun betegséget mutattak ki. A barátok/házastársak kevesebb mint 20%-a válaszolt pozitívan.
Lehet, hogy a saját tapasztalataimat torzítja az APS-betegek családtagjaitól származó beutalók elfogultsága – de szeropozitív vagy sem, a legtöbb szeronegatív APS-beteg ugyanolyan jól reagál a kezelésre.
Ha a családi vizsgálatban szereplő személyek közül néhányan valóban szeronegatív APS-ben szenvedtek, mégis potenciálisan reagáltak a kezelésre, akkor a lehetőségek izgalmasak. Talán migrénes, fiatal stroke-os, fiatal anginás betegeink nagyobb százalékának jót tenne, ha közelebbről megvizsgálnánk az APS-re utaló további nyomokat – például a száraz Schirmert, a livedót, az autoimmun betegség családi kórtörténetét.
Kezelési szempontok
Sok szempontból kiábrándító bevallani, hogy 30 év elteltével kevés új kezelés létezik. Az új orális antikoagulánsok bevezetése az APS kezelésében kiszámíthatóan óvatos volt, és túl korai lenne általánosítani.47
A statinokat, az IVIG-t és a hidroxiklorchint is bedobták a keverékbe, és természetesen a B-sejt-ellenes terápia is kedvező anekdotákat kapott. Egy nemrégiben készült párizsi tanulmány szerint a veseátültetésben alkalmazott szirolimusznak védő hatása lehet az aPL által kiváltott vaszkulopátiára.48
Az APS jelenlegi kezelése 2016-ban tehát még mindig nagyrészt az aszpirinre, a klopidogrélre, a heparinra és a warfarinra korlátozódik.
Az alacsony dózisú aszpirin, ellenzői ellenére, természetesen sok APS-es betegnél az első választás. A klopidogrél azonban továbbra is hasznos alternatíva a gyomorhurutos betegeknél vagy asztmásoknál. De van egy harmadik szerepe is a klopidogrelnek – ami a gyakorlati orvoslásban fontos -, mégpedig azoknál a betegeknél, akik bármilyen okból is próbálkoztak az aszpirinnel, egyértelmű előnyök nélkül.
Heparin-Az alacsony molekulasúlyú heparin a legtöbb országban nagyrészt felváltotta a régi heparint, és ezzel együtt a trombocitopéniától és a csontritkulástól való félelem is nagyrészt megszűnt. Ez fontos szempont, mert sok gyakorló orvos vonakodik a heparin használatának meghosszabbításától.
Két megfigyelés: Először is, számos beteg drámaian javul heparinra, hogy aztán warfarinra már kevésbé jól érezzék magukat.
Hová menjünk tovább? Ha az adagolási problémák, a warfarinnal szembeni rezisztencia és a compliance (remélhetőleg) kizárt, az egyik azonnali lehetőség a heparinra való ideiglenes visszatérés. Néhány esetben az ideiglenesből félhosszú távú lett. A mi APS-klinikánkon van néhány tucat ilyen betegünk, akik saját elhatározásukból két évig vagy még tovább is szubkután heparint kaptak. Igen, tapasztaltak véraláfutásokat, de eddig nem láttunk romló DEXA-vizsgálatokat.
A második (és nagyon klinikai) megfigyelés egy heparinkísérletre vonatkozik. Rendszeres megfigyelés, hogy a terhesség alatt heparint szedő aPL/APS betegek gyakran a teljes nyolc-kilenc hónapig fejfájásmentesek. Ez vezetett bennünket egy klinikai eszköz – egy terápiás kísérlet – kifejlesztésére, amely jó szolgálatot tett nekünk. A kísérlet egy három- vagy négyhetes LMW heparinkúra.49
Hadd mondjak egy példát az alkalmazására: Az aPL/APS-betegeknél, akiknél az aszpirin/klopidogrél ellenére (és normális agyi MRI-vel) egyre súlyosabb fejfájás jelentkezik, egy három vagy négy héten át tartó, 10 000 egységnyi dalteparin (vagy enoxaparin) kipróbálása jelentős eredményeket érhet el. Először is, meglepően egyértelmű jelzést adhat arról, hogy az antikoaguláció a helyes út. Másodszor, a traumatizált betegnél, aki végigjárta a többszöri szakorvosi konzultáció megszokott útját, határeseti klinikai sikerrel, ez jelentős fordulópont lehet – a javulás első érezhető jele.
Warfarin – A warfarinnal kapcsolatban kevés újat tudunk mondani. A média rágalmazta, de továbbra is az egyik leghasznosabb gyógyszer a fegyvertárunkban. A warfarin, egyszerűbben fogalmazva, véd az APS-ben a stroke és a szívroham ellen.
Elhangzott már, hogy sok APS-es betegnél – különösen a neurológiai tünetekkel rendelkezőknél – gyakran van szükség magasabb INR-értékre. Határozott híve vagyok az önellenőrző INR-gépek használatának, amikor csak lehetséges a betegeinknél.
Somorú, hogy néhány antikoaguláns klinika ellenzi az önellenőrző gépek használatát. Számomra ez helytelen. Nézze meg, milyen szabadságot ért el az önellenőrzés az inzulinfüggő cukorbetegeknél.
Az orvosok szerint kötelességünk (amíg jobb, újabb antikoagulánsok nem jönnek létre) támogatni a warfarint, mint egy nagyrészt biztonságos, hatékony gyógyszert, amely sok ezer életet mentett meg.
2015-ben a Hughes-szindróma jelenlegi kezelése még mindig nagyrészt aszpirinre, klopidogrélre, heparinra & warfarinra korlátozódik.
Miszerint
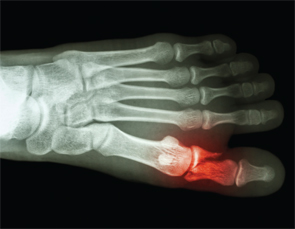
A spontán csonttörés egyre ismertebbé válik, miután 27 spontán lábközépcsonttörésről számolt be dr. Shirish Sangle APS-betegeknél.
Image Credit: Puwadol Jaturawutthichai/.com
A család – Nem meglepő, hogy a családi anamnézis fontos támpont a Hughes-szindróma esetében. Autoimmun betegség (különösen pajzsmirigybetegség) rendszeresen felbukkan diagnózisként betegeink rokonainál. De milyen gyakran diagnosztizálják ezeket a családi eseteket? Példaként említhetjük egy APS-beteg 17 éves lányát, aki fejfájásban és mirigylázban szenved, a szklerózis multiplexben szenvedő testvért, vagy egy újonnan diagnosztizált APS-beteg anyját és nagynénjét, akik a 40-es éveik elején stroke-ot kaptak.
Nem elképzelhetetlen, hogy az APS megváltoztatta a történelem menetét, mint abban az esetben, amelyről barátom, dr. Gerald Weissmann, Anna angol királynőről, akinek 17 sikertelen terhessége volt és gyermektelenül halt meg, ezzel véget vetve a Stuartok uralkodásának és a hannoveriek kezdetének – III. György, az amerikai gyarmati adók, a forradalom és az USA születése50.
Az utódok – A legtöbb tanulmány eddig azt sugallta, hogy az aPL-pozitív anyák utódainak nincsenek jelentős káros hatásai (kivéve talán az egyeseknél később kialakuló, öröklött APS-jellemzőket). A magzati és újszülöttkori problémákról szóló néhány aggasztó esetjelentés azonban további vizsgálatok szükségességét jelzi. Dr. Anne Parke, Angela Tincani, Maria Claire Boffa és mások folyamatban lévő vizsgálatai idővel biztosítani fogják e hiányzó adatok egy részét.51,52
Klasszifikáció vs. diagnózis-
Kedves doktor úr, hálás lennék, ha tudna tanácsot adni ezzel a beteggel kapcsolatban. Szájon át szedhető fogamzásgátló tablettára trombózis alakult ki nála. Egyszer volt pozitív aPL-tesztje, de 12 héttel később nem volt megismételt tesztje.”
A lupus esetében is előfordul, hogy a besorolási kritériumok néha összekeverednek a diagnózissal. Sok beteg nem fegyverkezik fel “12 hét különbséggel” végzett tesztekkel (ezt a kritériumot azért vezettük be, hogy fedezzük annak kockázatát, hogy egy közbeeső fertőzés átmeneti pozitív aPL-teszthez vezethetett – ez nem volt fontos tényező ennek a betegnek az értékelésében).
A pénzügyi megfontolások is felmerülnek, mint például az alábbi, a libanoni Bejrútból származó tanulmányban.
“Csak 50,5%-ban vizsgálták mind az aCL-t, mind az LA-t is. … Az egyes vizsgálatok költségei körülbelül 50 USD-t tettek ki a beteg számára. … Még nem tudjuk, hogy a vizsgálati költségek részben magyarázhatják-e azt, hogy a betegek nagyon kis százaléka mégis elvégeztette az utólagos megerősítő vizsgálatot.”
Az idő múlása egy pozitív eredményt is hozott: Nagyon szokatlan, hogy a primer APS-ben szenvedő betegeknél a későbbiekben lupusz alakul ki.
Az APS számos nem trombotikus manifesztációjának felismerése tovább növelte a diagnózis és az osztályozás szétválasztásának fontosságát. Talán a potenciális kockázati markerek mérésében elért laboratóriumi előrelépések idővel segítségünkre lesznek.44
Repülésfélelem – Ez a klinikai anekdota rendszeresen előfordul a klinikámon. Olyannyira, hogy úgy vélem, további vizsgálatot igényel. Számos APS-es betegem, különösen a kezelés megkezdése előtt, súlyosan szenved a hosszú távú repülőút utáni elhúzódó jet lagtól, fáradtsággal, fejfájással és zavartsággal, ami néha napokig tart.
Érdekes, hogy amint sikeresen megkezdődik a heparin- vagy warfarin-kezelés, ez a jelenség megszűnik. Nem tudni, hogy ezek a tünetek az enyhe agyi hipoxiához kapcsolódnak-e, amely a kissé csökkent kabinnyomás következménye, vagy sem. Mindazonáltal néhány APS-es betegem hosszú távú repülőút előtt LMW heparin injekcióval egészíti ki aszpirinkezelését. Bár a placebohatás jelentős lehet, e (figyelmes) betegek klinikai tapasztalatai kellőképpen lenyűgöznek ahhoz, hogy úgy gondoljam, hogy az elhúzódó jetlag jelensége sok betegünknél nagyon is valós.”
A jövő – A 2013-ban Rio de Janeiróban megrendezett 14. Nemzetközi Antifoszfolipid Antitest Kongresszuson megkérdezték tőlem az APS jövőjére vonatkozó előrejelzéseimet.23 Összefoglalva úgy vélem, hogy:
- Az aPL-vizsgálat világméretűvé és rutinszerűvé válik;
- A vény nélkül kapható aPL-vizsgálati készletek elérhetővé válnak;
- A migrénben szenvedők jelentős részhalmaza új reményt kap;
- Az APS-t felismerik, mint a migrén és a stroke közötti fő kapcsolatot;
- A fiatal nők (különösen a 45 év alattiak) szívrohama csökken;
- A 45 év alattiak stroke-ja csökken;
- A felgyorsult artériás betegség egyes eseteiről fel fogják ismerni, hogy azok a (kezeletlen) aPL-hez kapcsolódnak;
- A memóriazavar egyes esetei kezelhetőek;
- AAPS továbbra is mélyreható hatással lesz a lupus klinikai értékelésére és kezelésére; és
- Végül, hogy visszatérjek a nyitó témához, a halvaszületés előfordulása csökkenni fog, részben a terhesség alatti aPL-vizsgálatok proaktívabb megközelítésének köszönhetően.
Megismételjük az 1983-as közleményből vett mondatot:1
Azok számára, akiket a különböző autoantitestek SLE-ben való tanulmányozásának évei nihilizmusba edzettek, ritka izgalmat jelentenek a most közölt összefüggések következményei.
Harminc évvel később ez a klinikai izgalom továbbra is töretlen.
 Graham R.V. Hughes, MD, FRCP, reumatológus szakorvos és a Londoni Lupus Központ vezetője. A londoni kórházban képezte magát, majd két évig New Yorkban dolgozott a DNS-kötő teszt bevezetésén Dr. Charles Christian vezetésével. 1971-ben nyitott egy szakklinikát Londonban, amely egyedülállóan a lupusszal és a kapcsolódó betegségekkel foglalkozik. Alapítója és szerkesztője a Lupus című nemzetközi folyóiratnak. 1983-ban leírta az antifoszfolipid szindrómát, és 1991-ben ezért a munkájáért elnyerte az ILAR (világkutatási) díjat. További kitüntetései: Doctor Honoris Causa a Marseille-i és a barcelonai egyetemeken, valamint az ACR mestere.
Graham R.V. Hughes, MD, FRCP, reumatológus szakorvos és a Londoni Lupus Központ vezetője. A londoni kórházban képezte magát, majd két évig New Yorkban dolgozott a DNS-kötő teszt bevezetésén Dr. Charles Christian vezetésével. 1971-ben nyitott egy szakklinikát Londonban, amely egyedülállóan a lupusszal és a kapcsolódó betegségekkel foglalkozik. Alapítója és szerkesztője a Lupus című nemzetközi folyóiratnak. 1983-ban leírta az antifoszfolipid szindrómát, és 1991-ben ezért a munkájáért elnyerte az ILAR (világkutatási) díjat. További kitüntetései: Doctor Honoris Causa a Marseille-i és a barcelonai egyetemeken, valamint az ACR mestere.
- Hughes GR. Trombózis, abortusz, agyi betegség és a lupus antikoaguláns. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipin antitestekben: Kimutatás radioimmunoanalízissel és összefüggés a trombózissal SLE-ben. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE: Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. A Prosser White szónoklat 1983: Kötőszöveti betegségek és a bőr. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Pulmonális hipertónia szisztémás lupus erythematosusban. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Asszociáció az antikardiolipin antitestekkel. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Az antikardiolipin szindróma. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Hughes-szindróma: Az antikardiolipin szindróma. Egy történeti áttekintés. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Az antifoszfolipid szindróma molekuláris mechanizmusának felülvizsgálata: A vaszkuláris károsodáson túl. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Agyreaktív limfocitotoxikus antitestek SLE-s betegek szérumában. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. A limfocitotoxikus anititestek agyi reaktivitása szisztémás lupus erythematosusban agyi érintettséggel és anélkül. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. A limfocita antitestspecifikusságok kapcsolata a klinikai betegséggel. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Asszociáció az antikardiolipin antitestekkel. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. “Cerebralis betegség az antifoszfolipid szindrómában” in Hughes-szindróma-antifoszfolipid szindróma. Khamashta MA, szerk. Springer, London: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rheumatology (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Az ischaemiás stroke kockázata migrénes betegeknél: Megfigyelési tanulmányok szisztematikus áttekintése és metaanalízise. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus antikoaguláns és antikardiolipin antitestek agyi ischaemiás fiatal felnőttekben. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Antifoszfolipid szindróma, migrén és stroke. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepszia: A szisztémás lupus erythematosus korai tünete. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepszia a szisztémás lupus erythematosus és a szisztémás antifoszfolipid szindróma (Hughes-szindróma) részeként. Lupus. 2006;15(4):191-194.
- Hughes GR. “Diplomatikus epilepszia” in Understanding Hughes Syndrome. Springer-Verlag, London: 2009.
- Hughes GR. Hughes-szindróma/APS. Mit tanultunk 30 év elteltével? Megnyitó előadás az antifoszfolipid antitestek 14. nemzetközi kongresszusán. Rio de Janeiro, 2013. október. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Can neurologic manifestations of Hughes (antiphospholipid) syndrome can be distinished from multiple sclerosis? 27 beteg elemzése és az irodalom áttekintése. Medicine (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migrén, memóriazavar és “sclerosis multiplex”. Az antifoszfolipid- (Hughes-) szindróma neurológiai jellemzői. Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes-szindróma és szklerózis multiplex. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea az antifoszfolipid szindrómában. Klinikánk 50 betegének klinikai, radiológiai és immunológiai jellemzői és a legújabb irodalom. Medicine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Bécs). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Antiphospholipid antitestek, szisztémás lupus erythematosus és nem traumás lábközépcsonttörések. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr., et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: A case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. X-szindróma és Hughes-szindróma. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Coeliac arteria stenosis and antiphospholipid (Hughes) syndrome/antiphospholipid antibodies. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. A foszfolipidellenes antitestek lehetséges patogenetikai szerepe. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Catastrophic antiphospholipid syndrome and pregnancy: Tizenhárom eset tapasztalatai. Rheumatology (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Renal artery stenosis in antiphospholipid syndrome (Hughes) and hypertension. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: An enigma. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. A terhesség kihívása az SLE-ben szenvedő betegek számára. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. A halvaszületési botrány. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Az antifoszfolipid szindróma (APS) klinikai manifesztációi antifoszfolipid antitestekkel és anélkül (az úgynevezett “szeronegatív APS”). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid szindróma 2014-ben: Újabb klinikai manifesztációk, új patogén szereplők és új biomarkerek. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Szeronegatív antifoszfolipid szindróma. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Az antifoszfolipid szindróma (APS) klinikai manifesztációi antifoszfolipid antitestekkel és anélkül. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A véralvadásgátlás új hajnala antifoszfolipid szindrómás betegeknél. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibition of the mTORC pathway in the antiphospholipid syndrome. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparin, antifoszfolipid antitestek és az agy. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s lupus: A foszfolipidek és a birodalom lefolyása. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Children born to SLE and APS mothers. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Practice patterns of antiphospholipid syndrome at a tertiary teaching hospital in Lebanon. Lupus. 2002;11(11):759–764.