Egy kutatási programot végeztek a nem bauxitból származó timföld kinyerésére szolgáló feldolgozási technológia javítására. Ennek a programnak a sikere biztosította azt a technológiát, amely szükséges volt ahhoz, hogy hazai forrásokból megfelelő mennyiségű, kiváló minőségű timföldet állítsanak elő, így kielégítve az alumíniumgyártással kapcsolatos nemzetgazdasági és stratégiai igényeket. A sósavas eljárás a timföld alacsony minőségű ércekből történő kinyerésére a kutatási programban vizsgált eljárások egyike.
Az eljárás egyik fázisa a kloridion-koncentráció hatását használja ki az alumíniumion oldhatóságára az oldatban. 25 °C-on az AlCl3 oldhatósága tiszta vízben kb. 31 tömegszázalék, és a sósav (HCl) koncentrációjának növekedésével csökken, és 0,1 százalékos lesz, amikor a HCl koncentrációja 37 százalékra nő. Ez a viselkedés számos vizsgálat, eljárás és szabadalom tárgyát képezte. Így lehetséges egy nem bauxitos ércet HCl-lel kioldani, a lúgot dekantálni és szűrni, majd gáznemű HCl-t hozzáadni az AlCl3-6H2O kicsapásához. A maradék savas oldat ezután további ércek kioldására használható, a kicsapódott AlCl3-6H2O pedig kalcinálható, hogy Al2O3-t kapjunk. Ennek az eljárásnak a részletes tárgyalását és értékelését Peters, Johnson és Kirby mutatja be. Az eljárás teljes elemzéséhez, értelmezéséhez és fejlesztéséhez szükséges termodinamikai adatok, mint például az ionaktivitások és az oldhatóságok, ritkák, és a meglévő oldhatósági adatok szűk hőmérsékleti tartományra korlátozódnak. Ezért e vizsgálat céljai a következők voltak: (1) az AlCl3 oldhatóságának meghatározása 25 °C és 85 °C közötti hőmérséklet-tartományban, 0,0 és 37 °C közötti HCl-koncentráció mellett.2 pct; (2) kiszámítani az AlCl3 és a H2O aktivitását különböző elektrolitokat tartalmazó oldatokban , valamint az AlCl3-6H2O oldódásának egyensúlyi állandóját; és (3) kutatási területeket javasolni hasznos adatok előállítására.
- Készülék
- Kísérleti eljárás
- Analízis
- Eredmények
- Egyeztetés más adatokkal
- Thermodinamikai kezelés
- Az AlCl3-6H2O-H2O rendszer oldhatósági terméke és aktivitásai
- Az aktivitások becslése AlCl3-6H2O-H2O rendszerben
- Az AlCl3-6H2O-HCl-H2O rendszer oldhatósági terméke és aktivitásai
- Az aktivitások becslése AlCl3-6H2O-HCl-H2O rendszerben
- AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O rendszer
- Kutatásra ajánlott területek
- Alumínium-klorid vizes sósavoldatokban
Készülék
Az oldhatóságok méréséhez használt készüléket az 1. ábra mutatja. Egy 100 ml-es lombik, A, elektrolitok és némi felesleges só oldatát tartalmazza. Egy 6 mm-es Pyrex-csőre olvasztott, rojtos üvegszűrő, B, egy külső csőhöz csatlakozik, amely két tefloncsőhöz, D és E. A felső egységet C-nél egy neoprén 0-gyűrűvel ellátott, menetes nejlon kompressziós szerelvénnyel csatlakoztatjuk az A-hoz. Egy 6 mm-es OD polietilén cső, F-L, a B-nél szűrt oldatmintát juttatja a második lombikba, K-ba, amikor A nyomás alá kerül a D csapon keresztül, és E-t kinyitjuk. A J-nél lévő szerelvény hasonló a C-nél lévőhöz. A lombikok egy rúdra (G) vannak rögzítve, amely egy hintamechanizmushoz van rögzítve, amelynek H a hintatengelye az A és K lombikok felváltva fel és le történő rázásához. Egy fedett termosztát, 0, ±0,2° C pontossággal szabályozható. A hőmérséklet szorosabb szabályozása szükségtelen, mivel az oldhatóság nagyon gyenge függvénye a hőmérsékletnek.
Kísérleti eljárás
A 25°, 45°, 65° és 85° C-on az oldhatóságok mérése fázisegyensúlyi körülmények között történt analitikai reagens minőségű anyagokkal. Megfelelő mennyiségű AlCl3-6H2O, 37 százalékos HCl-oldat és desztillált víz került az A lombikba, hogy körülbelül 90 ml oldatot képezzenek kis mennyiségű felesleges sókristályokkal (a továbbiakban a “só” az alumínium-klorid-hexahidrátra utal). Az anyagmennyiségeket az AlCl3-6H2O-HCl-H2O hármas rendszerre vonatkozó meglévő oldhatósági adatokból becsültük. Miután az A lombikban kialakult az oldat, és a készüléket összeraktuk, azt N szintig vízbe merítettük, és a termosztátot a kívánt hőmérsékletre állítottuk. A lombikok folyamatos mechanikus keverését alkalmaztuk minden egyes 2-3 napig tartó menet során. Időnként erőteljes kézi keverést is alkalmaztunk az
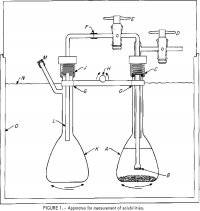
egyensúly biztosítása érdekében, különösen akkor, ha a só a HCl-lal komplex szilárd sót képezhetett. Az egyensúlyozási időszak végén a lombikokat 1 órán át hagyták mozdulatlanul állni függőleges helyzetben, hogy biztosítsák a szilárd részecskék leülepedését. Ezután a D és E csapokat kinyitottuk, hogy az oldat körülbelül felét a mintavételi lombikba, a K-ba juttassuk. A B szintje az A-ban lévő folyadék alatt általában meghatározta a K-ba juttatott oldat mennyiségét. Ismert mennyiségű desztillált vizet fecskendeztünk a lombikba L-en keresztül a minta hígítása és a gázfázisban lévő gőz feloldása érdekében. A HCl parciális nyomása tiszta vízben 25 °C-on meghaladja az 1 torr-t 8 m-nél nagyobb molalitásnál (a mondatban a szám után az m a molal-t jelöli); ezért 8 m-nél kisebb koncentráció esetén kétséges, hogy a mintavétel során bármilyen HCl-veszteség történhet. Emiatt a 25° C-on végzett, 4 m-nél kevesebb HCl-t tartalmazó néhány futtatást egyetlen dugós lombikban végeztük, és az egyensúlyozás után az oldat egy részét óvatosan dekantáltuk és szűrtük a mintavételhez.
Analízis
Az oldatokat megfelelő hígítások után elemeztük a teljes kloridion- és alumíniumion-koncentrációra. Az összes kloridion-koncentrációt potenciometriás titrálással határoztuk meg Ag+ -val. Az Al+++ koncentrációt úgy határoztuk meg, hogy először etiléndiamin-tetraecetsav (EDTA) felesleggel komplexet képeztünk, majd a felesleges EDTA-t Cu++-val visszatitráltuk 3,8 pH-nál.
Az AlCl3-tartalmat az Al+++ analízisből számoltuk ki. A számított AlCl3-mennyiségben lévő kloridion kivonása a teljes kloridion-koncentrációból lehetővé tette a HCl-koncentráció kiszámítását a telített oldatokban.
Ezt a számítási módszert használtuk minden elemzésnél, kivéve azokat, amelyeknél a HCl-koncentráció ismert módon nulla volt, vagyis amikor az AlCl3 volt az egyetlen elektrolit a tiszta vízben. Ezeknél az elemzéseknél az AlCl3-koncentrációt egyszerűen a kloridion-analízisből számították ki, amely a két elemzés közül a pontosabb volt, bár ezeknél a mintáknál még mindig elkészült mind az Al+++, mind a Cl-analízis.
A hozzáadott HCl nélküli kísérleteknél a teljes Cl-analízisből és az Al+++-analízisből számított Cl-analízis különbsége ±0,2 tömegszázalék Cl- volt. Ez azt jelzi, hogy az Al++ analízis átlagosan +0,05 wt-%-os hibát tartalmazott, mivel a Cl-analízisről ismert, hogy lényegesen pontosabb, mint az Al+++ analízis. HCl-tartalmú oldatokban az Al+++ tartalom ±0,05 tömegszázalékos hibája ±0,20 pct HCl-tartalomként jelentkezett; ez azért volt így, mert míg az összes Cl-tartalom nagyon pontos volt, a hozzáadott HCl által hozzáadott Cl-t és így a HCl molalitását a korábban említett különbséggel számították ki.
Eredmények
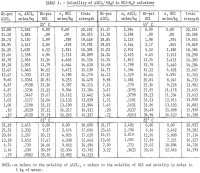
Az eredményeket az 1. táblázat foglalja össze és a 2. ábra mutatja. Az 1. táblázatban megadott adatok alapján a maximális HCl-koncentráció 85 °C-on körülbelül 30 tömegszázalék. A méréseket ennél a koncentrációnál leállítottuk, mivel a rendszerben nagyobb koncentrációknál túlzott egyensúlyi nyomás alakult ki. Azt is meg kell jegyezni, hogy 65° és 85° C-on kevesebb meghatározást végeztek, mint 25° és 45° C-on. A két alacsonyabb hőmérsékleten ismétléseket végeztek, hogy jelezzék az eredmények kielégítő megismételhetőségét. A 2. ábra azt mutatja, hogy az alumíniumsó oldhatósága drasztikusan csökken a HCl-koncentráció növekedésével. Ezért a nembauxitos ércek HCl-oldattal történő kioldása és a tiszta só kicsapása az alumínium kinyerése céljából HCl hozzáadásával megvalósítható eljárás; az ilyen eljárás több szabadalom tárgyát képezi. Az eredmények azt mutatják, hogy az oldhatóság nem változik nagymértékben a hőmérséklet függvényében, és 60 °C-os hőmérséklet-növekedés esetén (25 °C-ról 85 °C-ra) a tiszta só oldhatósága önmagában vízben csak 2,2 százalékkal nő a 25 °C-os oldhatósághoz képest.
Egyeztetés más adatokkal
A tiszta só oldhatósága vízben 25 °C-on pontosan megegyezik Palitzch, valamint Ehret és Frere adataival. A Malquori által megadott eredmények kb. 10 százalékkal magasabbak. A Tanaka által kapott oldhatóság 45° C-on és 65° C-on kb. 3,3 százalékkal magasabb, mint a jelen vizsgálatban kapott érték.
A HCl hatását vízben a só oldhatóságára Seidel és Fisher 0° C-on és Malquori 25° C-on vizsgálta. Az előbbi vizsgálók 0° C-on mért eredményei nagyon jól egyeznek az 1. táblázatban szereplő, 0° C-ra extrapolált adatokkal, míg az utóbbi vizsgálók 25° C-on mért eredményei némileg szórnak, és kis HCl-koncentrációknál nagyjából 3 pet eltérést mutatnak; az 5-30 tömegszázalék HCl-tartományban azonban az egyezés 1 pct-on belül van.
Thermodinamikai kezelés
Az AlCl3-6H2O-H2O rendszer oldhatósági terméke és aktivitásai
Az AlCl3 ionos aktivitási együtthatóját Y12 vízben Mason 1,8 m-ig mérte, az újraszámított értékeket Robinson és Stokes adja meg. Mivel az aktivitási együttható 1,8 m-től a 3,3835 m-es telítési értékig várhatóan több mint ötszörösére nő, a telítési értéket használjuk a számításhoz a korábbi jelentésben részletesen ismertetett módszerrel (1 m = 1 mól 1 kg oldószerben). A módszert, a megfelelő újszerű alkalmazással együtt, ebben a jelentésben röviden összefoglaljuk. Az AlCl3 átlagos ionaktivitását, amelyet a12-vel jelölünk, a következő hatványsorral fejezzük ki az m molalitással kifejezve:

A víz aw aktivitására vonatkozó megfelelő egyenletet a Gibbs-Duhem összefüggés alkalmazásával kapjuk; az eredmény
![]()
Megjegyezzük, hogy az m exponenseit azonos együtthatókkal C, D stb, a 2. egyenletben 1-gyel nagyobbak, mint az 1. egyenletben, és az m együtthatója a 2. egyenletben a Gokcen által tárgyalt Debye-Huckel-elméletből származik.
A só oldódásának reakciója
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),…………………………..(3)
ahol (s) a szilárd, (l) a folyékony anyagot jelenti.
A megfelelő egyensúlyi állandó
![]()
ahol a nevezőt, a szilárd anyag aktivitását egységnek vesszük, mivel annak összetétele változatlan marad, ha más elektrolitokat adunk az oldathoz. Az a12-t az 1n Kp-be közvetlenül az 1. egyenletből, az aw-t pedig a 2. egyenletből helyettesítjük, miután a 2. egyenletet megszoroztuk 0,108093-mal, hogy az 1n aw együtthatója 6 legyen. Mivel a Kp összetételfüggetlen, nyilvánvaló, hogy
![]()
Az 1. és 2. egyenletből szükséges helyettesítések, majd az m = 3 átlagérték behelyettesítését követően.3835 az 1. táblázat első két lefutásából egy egyenletet kapunk az 1. egyenlet hat ismeretlen együtthatójának megoldására, a fennmaradó öt egyenletet pedig úgy kapjuk, hogy az AlCl3 átlagos ionaktivitási együtthatójának mind az öt kísérleti értékét, a 2. táblázatban szereplő y12-t beillesztjük
![]()
![]()
, majd minden eredményt beillesztünk az 1. egyenletbe. Az így kapott hat szimultán egyenletet ezután számítógéppel oldjuk meg. Az eredmények a következők:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
és H = +11,6880.
Ezeknek az értékeknek az 1., 2. és 4. egyenletbe való behelyettesítésével megkapjuk Y12, aw és Kp értékeit. Az eredményeket a 3. táblázatban az “Irodai eredmények” címszó alatt soroljuk fel. Megjegyzendő, hogy a víz aktivitása most már kiszámítható a 2. egyenletből, a víz gőznyomása az oldat felett, P, pedig
aw = P/P°,……………………………….(7)
mivel P° a tiszta víz gőznyomása azonos hőmérsékleten. Megjegyezzük, hogy a víz gőznyomása a telített oldat felett valamivel több mint fele a tiszta víz feletti nyomásnak, mivel aw = 0,509. Az előbbi eredmények a só oldhatóságán alapuló aktivitásokra vonatkozó első adatsort alkotják.
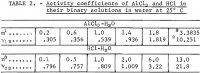
Megjegyz.- Ebben a táblázatban m az AlCl3 molalitására, n a HCl molalitására utal, a molalitás pedig 1 kg vízben lévő mólt jelent.
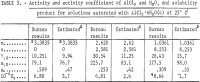
Megjegyz.-Ebben a táblázatban m az AlCl3 molalitására utal, n a HCl molalitására utal, a molalitás pedig 1 kg vízben lévő mol.
Az aktivitások becslése AlCl3-6H2O-H2O rendszerben
A meglévő közvetlen kísérleti adatokon túl az AlCl3-6H2O-H2O rendszerben m = 1,8 esetén két létező megbízható becslési módszert használunk az aktivitások meghatározására. Az első, Kusik és Meissner által leírt módszer a γ12 = 9,94 becsült értéket adja 3,3835 m-nél. Ez a becsült érték szoros összhangban van a jelen vizsgálatban kapott 10,251 értékkel. A víz aktivitásának (aw) megfelelő becsült értéke 0,47, ami szintén szoros összhangban van a jelen vizsgálatban talált 0,509-es értékkel. Az ezekből az értékekből számított Kp egyensúlyi állandó nem áll messze a 6,8 x 10 5-től, figyelembe véve, hogy az a12 negyedik hatványa és az aw hatodik hatványa szorozva kapjuk a Kp-t.
A Bromley-nak köszönhető második becslési módszerrel 10,42-t kapunk a γ12-re, ami közelebb áll az előző módszerrel kapott értékhez. A víz aktivitási együtthatóját a jelen szerzők a Gibbs-Duhem-egyenlet integrálásával kapták meg, amelyben a Bromley-módszerrel becsült a12 értékeket használták. Az eredmény aw = 0,540. A két módszer átlaga 0,505, ami nagyon jó összhangban van az iroda 0,509-es értékével. A Bromley-módszer azonban nem tartalmazza a Kusik-Meissner-módszerben szereplő aw meghatározásának kényelmes módszerét.
A becsült értékek és az oldhatósági adatokból származó értékek egyezése nem mindig olyan jó, mint itt látható minden elektrolitra és minden összetételre. Például még az 1 m-es AlCl3 esetében is a γ12 két becslése csak 13 százalékkal tér el egymástól.
Az AlCl3-6H2O-HCl-H2O rendszer oldhatósági terméke és aktivitásai
A HCl koncentráció növekedésének hatása a só oldhatóságára nagyrészt a kloridionok növekvő koncentrációjának köszönhető. Az egyensúlyi állandó ebben az esetben az egyes ionok a1 és a2 aktivitásával
![]()
ahol γ12 = γ1γ2 az egyes ionok γ1 (Al+++ esetén) és γ2 (Cl- esetén) aktivitásából a γ12 definíciója szerint, n pedig a HCl molalitása. A Kp értéke megegyezik a 4. egyenletben szereplő értékkel, de a 8. egyenlet jobb oldala eltér a 4. egyenletben szereplő értéktől. Megjegyezhetjük, hogy az n növekedésével m-nek, az Al+++ koncentrációjának csökkennie kell, feltéve, hogy γ12 és aw nem csökken nagymértékben; ezért a só kicsapódik, amit elsózási hatásnak nevezünk.
A háromkomponensű oldat aktivitásainak kiszámításához a HCl-re vonatkozó 1. egyenlethez hasonló egyenletre van szükség. Mivel a HCl-re vonatkozó adatok széles koncentrációtartományban pontosan ismertek, tetszőleges számú változót tartalmazó egyenletet vehetünk fel. A következő egyenlet a HCl aktivitási együtthatójára, γ32-re vonatkozó adatok pontos ábrázolását adja, ahol a 3-as index a H+ és a 2-es a Cl- értékét jelöli:
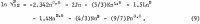
A 2. táblázat harmadik és negyedik sorában a Haase, Naas és Thutnm által erre a célra kiválasztott adatok szerepelnek. Az ezekből az adatokból számított együtthatók értékei a következők:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
és P = +0,02634.
Az AlCl3 és a H2O aktivitásának egyenletei ezeket az együtthatókat, valamint a kereszttermékek (m h/2)(n k/2) együtthatóit tartalmazzák, ahol h és k egész számok, és ezek az egyenletek a következők:
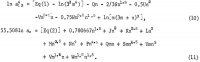
Az ezekben az egyenletekben szereplő öt további együtthatót a 10. egyenlet és a 11. egyenletből 6 1n aw összeadásával határozzuk meg, hogy megkapjuk az 1n Kp-t, valamint az 1. táblázatból kiválasztott alábbi oldhatósági adatok felhasználásával:
m: 2.620, 2,016, 1,333, 0,953 és 0,535.
n: 2,581, 4,460, 6,780, 8,397 és 10,063.
Az így kapott számítások a 10. és 11. egyenletekben szereplő együtthatók következő értékeit adják:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
és W = +4,60246.
Az előző egyenletekből számított γ12, a12, aw és Kp értékek eredményeit a 3. táblázat tartalmazza. A 9. egyenletből kapott γ12 értékek összhangban vannak a Harned és Gary által a HCl és az AlCl3 nagyon alacsony koncentrációinál mért értékekkel.
A HCl(g) parciális nyomása, P32, az oldat felett a következő (4) egyenletből számítható ki:
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
ahol Kp(HCl) a H+ + Cl- = HCl(g) egyensúlyi állandója 25 °C-on, és a32 a HCl átlagos ionaktivitása oldatban. Ehhez az a32-re a 10. egyenlethez hasonló egyenletet kell felírni a 11. egyenlet paramétereinek felhasználásával, amint azt máshol részletesen bemutattuk.
A hőmérséklet hatása a só oldhatóságára kicsi, amint azt az 1. táblázat mutatja. Az ionaktivitásra gyakorolt hatása ezért várhatóan kicsi, mivel a 11. egyenletben szereplő összes paramétert az oldhatósági adatokból is meg lehetett volna kapni, ha a kísérleti hiba kisebb, mint ±0,01 tömegszázalék az alumíniumelemzésnél. Általánosságban elmondható, hogy egy körülbelül 80 °C-ig terjedő hőmérséklet-tartományban minden paraméter a hőmérséklet lineáris függvénye, és ez a függés meghatározható, ha a 11. egyenlet egy másik, a 25 °C-nál legalább 50 °C-kal magasabb hőmérsékleten ismert lenne.
Az aktivitások becslése AlCl3-6H2O-HCl-H2O rendszerben
A jelen jelentésben a Kusik és Meissner által kidolgozott módszer szerint becsült aktivitások, aktivitási együttható és az oldhatósági termék értékei a 3. táblázatban találhatók. A γ12 aktivitási együttható az AlCl3 esetében nagyjából kétszerese a HCl-tartalmú kiválasztott oldatok becsült értékének. A víz aktivitása, aw azonban jól egyezik a becsült értékekkel, kivéve m = 2,620 esetében. Nyilvánvaló, hogy a számítások lényegesen megbízhatóbbak lettek volna, ha a víz gőznyomását, aw-t, megmérték volna, mert az aw úgy kerül be a Kp-be, mint aw, így az aw kis hibái nagy hibákat okoznak a γ12 és a Kp értékekben. Ebből a célból korlátozott számú gőznyomásmérés ajánlott a jelen számítások és becslési módszerek pontosságának tesztelésére.
A 3. táblázatban felsorolt termodinamikai tulajdonságok hőmérsékletfüggése Kusik és Meissner leírása szerint becsülhető. A becslés azonban valószínűleg nagyobb mértékű hőmérsékletfüggést eredményez, mint amire az oldhatóság gyenge hőmérsékletfüggése utal. Nem lehetett kísérletet tenni a hőmérséklet hatásának kiszámítására az Iroda módszerével, mert (1) az a12 az AlCl3 alacsony koncentrációinál nem ismert különböző hőmérsékleteken, (2) az AlCl3 oldhatóságát nem lehetett 0,01 pct-ot megközelítő pontossággal meghatározni Al+++-ban, és (3) a HCl koncentrációjának tartománya 65° és 85° C-on túl kicsi ahhoz, hogy elegendő számú, egymástól nagymértékben eltérő AlCl3 oldhatósági adatot lehessen kiválasztani a 10. és 11. egyenletben szereplő paraméterek pontos meghatározásához.
AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O rendszer
Előzetes adatokat kaptunk az AlCl3, FeCl3 , KCl és NaCl oldhatóságáról 24-31 tömegszázalék HCl-t tartalmazó vizes oldatokban 25° C-on, a nem bauxitikus ércekből kinyerhető AlCl3-6H2O szennyezettségének felmérésére. Ehhez 2 liter ismert mennyiségű sókat tartalmazó oldatot készítettek, ebből az oldatból minden egyes menethez 90 ml-t helyeztek egy lombikba, majd ismert mennyiségű gáznemű HCl-t engedtek be, hogy elérjék a 24-31 tömegszázalékos oldott HCl-tartalmat. Ebben az oldott HCl-tartományban az AlCl3-6H2O színtelen anizotróp kristályai, a FeCl3-2KCl-H2O világos anizotróp kristályai, valamint a KCl és NaCl kocka alakú izotróp átlátszó kristályai csapódtak ki, amelyeket mikroszkópos vizsgálattal azonosítottak. Az alumíniumion- és kloridion-koncentrációkra vonatkozó eljárás és elemzések ugyanazok voltak, mint a jelentésben korábban bemutatott AlCl3-6H2O-HCl-H2O rendszer esetében. Ezenkívül a vasion-koncentrációt szabványos K2Cr2O7-titrálással, a nátriumion-koncentrációt atomabszorpciós technikával, a káliumion-koncentrációt pedig a nátriumion-koncentrációnak az ioncserével történő elválasztás utáni kombinált káliumion- és nátriumion-koncentráció meghatározásából történő kivonásával határoztuk meg. Az eredményeket a 4. táblázat tartalmazza, és a 3. ábra ábrázolja. A Miles-féle hasonló eredményeket szintén a 3. ábrán ábrázoltuk, hogy látható legyen, hogy az egyezés kiváló. A kapcsolódó egyszerűbb, kevesebb komponenst tartalmazó rendszerekre vonatkozó közzétett adatokat Linke állította össze.
A tiszta alumínium-klorid-hexahidrát előállítására szolgáló párologtató vagy HCl-gázzal történő kristályosítási eljárásokban a szennyeződések más fém-kloridokkal való szennyeződése problémává válik, mivel a szennyeződések szintje a kioldó oldatokban felhalmozódik. A 3. ábra mutatja azokat a koncentrációs szinteket, amelyeknél az olyan szennyeződések, mint a NaCl, KCl és FeCl2-2KCl-H2O is különálló fázisokként kristályosodnak ki az oldatból, és így az AlCl3-6H2O kristályok szennyeződését okozzák. Például 2,4 tömegszázaléknál kevesebb FeCl3-nál 1,6 tömegszázalék KCl jelenlétében 25 °C-on a HCl-koncentrációnak 28 tömegszázaléknál kisebbnek kell lennie ahhoz, hogy az AlCl3-6H2O ne szennyeződjön a kettős só, FeCl3-2KCl-H2O által. A 3. ábra hasznos a csapadék frakcionált átkristályosításának újrafeloldásához is az alumíniumsó tisztításához. Ezenkívül néhány átmeneti elem sói, mint például a FeCl3, részleges elektrolízissel minimalizálhatók, hogy a HCl-lel történő savasítás előtt elegendő mennyiségű vasat lemezeljenek ki.
A rendszer termodinamikai kezelése a kloridion-koncentráció szokásos ±0,05 tömegszázalékos hibájával nem kivitelezhető, különösen a H2O(g) és HCl(g) gőznyomás adatainak hiányában. A Kusik-Meissner-módszerrel azonban durva becslések készíthetők az aktivitásokra. Az ilyen becslések várhatóan csak durva értékeket adhatnak az aktivitásokra a hidratált és komplex sókra, valamint a vízre vonatkozóan.

Kutatásra ajánlott területek
Az aktivitásmérések hasznosak a különböző ércek kívánt összetevőinek kioldása, kicsapása és tisztítása termodinamikájának és kinetikájának értelmezésében. Két oka van annak, hogy az aktivitások a víz gőznyomásának méréseiből pontosan meghatározhatók: (1) A gőznyomás nagy pontossággal mérhető nyomáskülönbség-jeladókkal, hogy a 7. egyenlet alapján aw-t kapjunk, majd a 11. egyenletben szereplő paraméterek értékeit kiszámíthassuk, így az összes kapcsolódó tulajdonság kiszámítható a korábban részletesen tárgyalt módon (2) Az oldhatósági termék és az aktivitások egyaránt pontosan meghatározhatók olyan többértékű sók esetében, amelyek hidratált kristályaikban nagyszámú vízmolekulát tartalmaznak. A második ok abból adódik, hogy a 4. egyenletben a víz aktivitásának exponense egyenlő a hidratált kristályban lévő víz mólszámával.
Alumínium-klorid vizes sósavoldatokban
A másik érdekes kísérlettípus az itt tárgyalt hármas rendszerre vonatkozóan a HCl(g) parciális nyomásának mérése különböző, kellően nagy mennyiségű oldott HCl-t tartalmazó oldatokon. Az erre a célra szolgáló kísérleti eljárást máshol ismertetjük. A IIA, IIIA csoportba tartozó és az átmeneti fémek sói kiváló jelöltek az ilyen típusú vizsgálatokra, mivel az 1:1-nél nagyobb valenciájú elektrolitok általában hidratált sókat képeznek.
Az alumínium-klorid hexahidrát, AlCl3-6H2O, oldhatóságát és aktivitását vizes oldatokban az Egyesült Államok Belügyminisztériumának Bányászati Hivatala által végzett, a timföld alacsony minőségű hazai erőforrásokból történő kinyerésére szolgáló ásványfeldolgozási technológia fejlesztésére irányuló kutatás részeként határozták meg. Az AlCl3 oldhatóságát tiszta vízben 31,09 és 31,77 tömegszázalékosnak találták 25° és 85° C-on, és drasztikusan 10 és 0,1 tömegszázalékra csökkent, amikor 20,3 és 37 tömegszázalékos sósav (HCl) megfelelő mennyiségét adták az oldathoz. A hexahidrát oldhatóságának egyensúlyi állandóját, az AlCl3 és a H2O aktivitásait és aktivitási együtthatóit kiszámítottuk és összehasonlítottuk a rendelkezésre álló becslési módszerek eredményeivel. Az eredmények hasznosnak bizonyultak a timföld kinyerésére szolgáló nembauxit ércek kioldása során azáltal, hogy a komponens sók oldhatóságát HCl hozzáadásakor megváltoztatták.
Az AlCl3 , FeCl3, KCl és NaCl egyidejű oldhatóságát HCl-H2O oldatokban is meghatározták, és röviden tárgyalják ezek hatását a kevert sóoldatokból kikristályosított AlCl3-6H2O tisztaságára.