A víz tulajdonságai
Bolygónk egyik különlegessége a folyékony víz jelenléte. A víz minden élet számára alapvető fontosságú, nélküle minden élőlény elpusztulna.
A Föld felszínének mintegy 70%-át víz borítja, és testünk 65-75%-át víz alkotja (vérünk 82%-a víz). Bár a víz unalmasnak tűnhet – nincs színe, íze vagy szaga -, csodálatos tulajdonságai vannak, amelyek miatt szükséges az élet fenntartásához.
(A víz iránti igényünk és a vízben élő óceáni állatok miatt olyan károsak az olajszennyezések.)
A víz kémiai összetétele H2O – két hidrogén- és egy oxigénatom. A víz tulajdonságai azért különlegesek, mert az atomjai úgy kötődnek egymáshoz, hogy vízmolekulát alkotnak, és a molekulák kölcsönhatásba lépnek egymással.
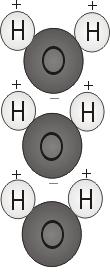
Víz polaritása
Amikor a két hidrogénatom az oxigénnel kötődik, inkább a molekula tetejére tapadnak, mint Mickey egér füle. Ez a molekulaszerkezet adja a vízmolekulának a polaritást, vagyis egy ferde elektromos töltést, amely más atomokat vonz.
A molekula két hidrogénatomos vége pozitív töltésű. A másik vége, az oxigénnel, negatív töltésű. Akárcsak a mágnesben, ahol az északi pólusok vonzzák a déli pólusokat (“az ellentétek vonzzák egymást”), a vízmolekula pozitív vége más molekulák negatív végéhez kapcsolódik.
Mit jelent ez számunkra? A víz polaritása lehetővé teszi, hogy más poláris anyagokat nagyon könnyen feloldjon. Amikor egy poláros anyagot vízbe teszünk, molekuláinak pozitív végei vonzódnak a vízmolekulák negatív végeihez, és fordítva. A vonzások hatására az új anyag molekulái egyenletesen keverednek a vízmolekulákkal.
A víz több anyagot old fel, mint bármely más folyadék – még a legerősebb sav is! Emiatt gyakran nevezik “univerzális oldószernek”. A víz oldóereje nagyon fontos a földi élet szempontjából. Bárhová is kerül a víz, magával viszi az oldott vegyi anyagokat, ásványi anyagokat és tápanyagokat, amelyek az élőlények fenntartásához szükségesek.
A vízmolekulák polaritásuk miatt erősen vonzzák egymást, ami nagy felületi feszültséget biztosít a víznek. A víz felszínén lévő molekulák “összetapadnak”, és egyfajta “bőrt” képeznek a vízen, amely elég erős ahhoz, hogy nagyon könnyű tárgyakat is megtartson. A vízen járó rovarok ezt a felületi feszültséget használják ki.
A felületi feszültség miatt a víz cseppekbe csomósodik, ahelyett, hogy vékony rétegben szétterülne.
Ez teszi lehetővé azt is, hogy a víz a növények gyökerein és szárán, a hőmérőkön és a testünk legkisebb véredényein keresztül mozogjon. Ahogy egy molekula felfelé halad, “magával “húzza” a többit is.
Az anyag három halmazállapota
A víz a négy elem egyike, és az egyetlen olyan természetes anyag, amely mindhárom halmazállapotban – szilárd, folyékony és gáz halmazállapotban – létezhet a Földön szokásos hőmérsékleten.
Sok más anyagot túlmelegíteni vagy lehűteni kell ahhoz, hogy állapotot váltson.
A víz gáz halmazállapota folyamatosan jelen van a légkörünkben vízgőz formájában. A folyékony állapot mindenütt megtalálható a folyókban, tavakban és óceánokban.
A víz szilárd állapota, a jég, egyedülálló. A legtöbb folyadék lehűléskor összehúzódik, mert a molekulák lassabban mozognak, és kevesebb energiával tudnak ellenállni az egymáshoz való vonzásnak. Amikor szilárd halmazállapotúvá fagynak, szorosan elhelyezkedő kristályokat alkotnak, amelyek sokkal sűrűbbek, mint amilyen a folyadék eredetileg volt.
A víz nem így viselkedik. Amikor megfagy, kitágul: a molekulák felsorakoznak, és egy nagyon “nyitott” kristályszerkezetet alkotnak, amely kevésbé sűrű, mint a folyékony víz.
Ezért úszik a jég. És ez jó dolog, hogy így van! Ha a víz úgy viselkedne, mint a legtöbb más folyadék, a tavak és folyók befagynának, és minden élet elpusztulna bennük.
A víz három másik tulajdonsága
A víznek magas a fajhője. Ez azt jelenti, hogy a levegővel ellentétben a víz sok hőt képes elnyelni anélkül, hogy a hőmérséklete megváltozna. Ezért olyan frissítő érzés az úszás egy forró napon.
A víz emellett lassabban veszíti el a hőt, mint a levegő. Ennek eredménye, hogy nyáron a tavak és az óceánok vize általában az évszak elején a leghidegebb, és az évszak végén a legmelegebb (miután sok napon át elnyelte a nap energiáját).
A víz forráspontját (212° F vagy 100°C tengerszinten) befolyásolja a tengerszint feletti magasság. Általában minél nagyobb a tengerszint feletti magasság, annál alacsonyabb a víz forráspontja. Például Denverben, CO-ban (5,280 ft.) a víz 202,4° F-on forr, a nepáli Mount Everesten (29,012 ft.) a víz 156° F-on forr.
Vizes tudományos projektek:
- A víz körforgása
- Vízkerék
- Szuperhűtött víz
- Víztározó
.