Mindannyian mutánsok vagyunk. Minden tulajdonság, amely meghatározza fajunkat, egy genetikai mutáció eredménye valahol az evolúció történetében. És ugyanez igaz a bolygó minden más élőlényére is. Mégis leggyakrabban úgy gondolunk a mutációkra, mint rosszra, ami fogyatékossághoz vagy betegséghez vezet. Milyen gyakran károsak ezek a DNS-változások, és mennyi közülük a potenciálisan hasznos? Egy új tanulmány szerint a halálos mutációk sokkal ritkábbak lehetnek, mint eddig gondoltuk, legalábbis a baktériumokban.
A legtöbb DNS-mutációt olyan hibák okozzák, amelyek akkor történnek, amikor egy sejt elkészíti az összes genetikai információ másolatát, hogy két új sejtre oszthassa magát. Az olyan baktériumoknak, mint az E. coli, körülbelül ötmillió betűnyi DNS-kódot kell lemásolniuk. Az embernél ez a szám a petesejtekben és a spermiumokban mintegy 3,2 milliárd, a test egyéb sejtjeiben pedig ennek kétszerese.
A másolási hibák felismerésére és javítására szolgáló kifinomult rendszerek ellenére néhány hiba időnként kicsúszik a hálóból. A legtöbbjük úgynevezett “pontmutációkat” eredményez, mivel csak egyetlen DNS-betű változásával járnak. Néha azonban még ezek is nagy változásokhoz vezethetnek, megváltoztatva a géneket és az általuk termelt fehérjéket. Ez pedig hatással lehet a szervezet növekedésére vagy működésére.
A mutációk irányíthatják az evolúciót, ha egy egyednek előnyt biztosítanak, ami azt jelenti, hogy nagyobb valószínűséggel marad életben, hogy gyermekei szülessenek, és továbbadják a mutált gént. Annak az esélye, hogy a több millió vagy milliárd betűs kódban véletlenszerűen bekövetkező mutációk előnyösek, csekélynek tűnhet. A földi élet azonban már négymilliárd éve létezik, így az evolúciós időtávok óriásiak.
A mutációk azonban súlyos egészségügyi problémákat is okozhatnak, amelyek egy része szintén öröklődhet. Francia kutatók nemrégiben az E. coli baktériumot használva modellként próbálták kideríteni, hogy a mutációk valójában milyen gyakran károsak. Lydia Roberts és kollégái egy zseniális technikát alkalmaztak, amely lehetővé tette számukra, hogy láthatóvá tegyék azokat a DNS-változásokat, amelyek a baktériumok tényleges osztódása közben történtek.
A baktériumok mutációs arányának becslésére általában agarlemezeken, a mikrobák számára tápanyagban gazdag zselét tartalmazó műanyag tányérokban tenyésztik őket. Ezzel a megközelítéssel azonban az a probléma, hogy a halálos mutációra szert tevő baktériumok nyilvánvalóan elpusztulnak, így a genetikai változásokról szóló információk végleg elvesznek.
A francia kutatók ennek megkerülésére egy apró, 1000 mikroszkopikus csatornát tartalmazó chipet használtak, amelybe folyékony táplevet juttattak. A minden sejtosztódás után keletkező új sejtek a csatornákban maradnak, függetlenül a túlélésüket esetlegesen befolyásoló káros mutációktól.
A csapat ezután time-lapse képalkotást használt, egy fluoreszcens markerrel kombinálva, amely minden alkalommal felvillant, amikor egy mutáció bekövetkezik. Így lenyűgöző videók készültek a szaporodó, mutálódó baktériumokról, amelyek a Mátrix című sci-fi filmben ábrázolt kódsorokra emlékeztetnek.
A Science-ben közzétett eredmények szerint a baktériumokban a pontmutációk állandó ütemben, körülbelül 600 óránként keletkeznek. A kutatók meglepetésére azt is felfedezték, hogy ezeknek a DNS-változásoknak csak mintegy 1%-a volt halálos a baktériumokra nézve – jóval kevesebb, mint korábban gondolták.
Úgy tűnik, hogy legalábbis a baktériumokban a legtöbb mutációnak egyáltalán nincs hatása a túlélésre. Nem “rosszak” és nem is “jók”, hanem egyszerűen csak evolúciós mellékszereplők. A kutatók, akik azon dolgoznak, hogy megértsék, hogyan okoznak a genetikai mutációk betegségeket az emberekben, hasonló kérdéseket tesznek fel. Az olyan nagy projektek eredményei, mint az Egyesült Királyság 100 000 Genom projektje, segíthetnek feltárni, hogy mely mutációk okoznak betegséget, és melyek azok, amelyeknek nincs jelentősége.
Túl jó és rossz
De azt is tudjuk, hogy a mutációk jó vagy rossz kategóriába sorolása néha nagyon nehéz lehet. Gyakran a kontextustól függ, például attól, hogy a mutáció segíti-e a szervezetet egy adott táplálékforrás felhasználásában vagy egy, az élete során jelenlévő betegség leküzdésében. Egyes mutációk pedig hasznosak lehetnek, ha csak egy példányban öröklődnek, de károsak, ha két példányban öröklődnek. Az ilyen “kiegyensúlyozó szelekciónak” kitett génmutáció egyik példája a sarlósejtes betegség.
A sarlósejtes betegségben szenvedők olyan génmutációval rendelkeznek, amely a hemoglobin – a vörösvértestekben található, az oxigént a szervezetben szállító fehérje – megváltozott formáját eredményezi. A megváltozott hemoglobin hosszú, sarló alakú vérsejteket eredményez, amelyek megrekedhetnek a kis vérerekben. Ez mellkasi és ízületi fájdalmat, valamint vérszegénységet, fokozott fertőzésveszélyt és egyéb problémákat okoz.
Ezek a potenciálisan pusztító egészségügyi hatások ellenére a betegség bizonyos országokban viszonylag gyakori. Becslések szerint évente 300 000 olyan csecsemő születik a betegséggel, akik a sarlósejtes génmutáció két példányát öröklik (mindkét szülőtől egyet-egyet), főként Nigériában, a Kongói Demokratikus Köztársaságban és Indiában.
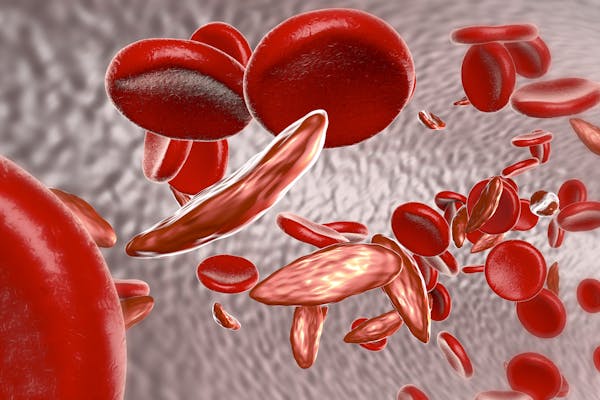
Ez azért van, mert a mutáció egy példányával rendelkező emberek ellenállóak a maláriával szemben, és így nagyobb valószínűséggel élik meg a felnőttkort, és adják tovább a mutáns gént a gyermekeiknek. Tehát bár a sarlós betegség evolúciós hátrányt jelent, a génmutáció nem érintett hordozói túlélési előnyt élveznek azokban az országokban, ahol a malária elterjedt (vagy még mindig elterjedt).
Egy nemrégiben készült amerikai tanulmány szerint a ma ezzel a betegséggel élő összes ember egyetlen őstől származik, aki körülbelül 7300 évvel ezelőtt élt a Szaharában vagy Nyugat-közép-Afrikában. Ez azt mutatja, hogy egyetlen mutáció hogyan terjedhet át sok-sok egyénre egy populációban, ha jelentős előnnyel jár, még akkor is, ha kárt is okozhat. Hasonlóképpen bizonyíték van arra, hogy a cisztás fibrózis génmutációjának egyetlen példánya biztosíthatta őseink számára a kolerával szembeni rezisztenciát, és hogy a Tay-Sachs-kór hordozói tuberkulózisrezisztenciával rendelkeznek.
A mutációk hatásainak jobb megértése nagy szerepet játszhat a betegségek kezelésében. Például a különböző sejttípusok mutációs rátájának tanulmányozása fényt deríthetne arra, hogyan keletkezik a rák a különböző testszövetekben. A baktériumok mutációs rátájának megértése pedig segíthet a tudósoknak az antibiotikumokkal szemben rezisztenciát kifejlesztett mikrobák elleni küzdelemben. Mindez végül az orvostudomány új korszakát fogja bevezetni, amelyben számos betegséget a genetikai információk segítségével diagnosztizálnak és kezelnek majd. És ez csak jó lehet.