- Háttér
- A kálium normális fiziológiája és patofiziológiája
- Egy nem pacemaker kardiomiocita akciós potenciálja
- A szívpacemaker sejt akciós potenciálja
- Áramvezetés
- Refractory period
- Hyperkalaemia, osztályozás és okok
- Klasszifikáció
- Erőforrások
- A hiperkalémia hatásai
- Metabolikus hatások
- Nátrium-kálium-pumpa
- Következtetés
Háttér
A kálium a periódusos rendszerben az alkálifémek csoportjának családjába tartozó lágy, ezüstfehér, erősen reaktív kation. Ez a legnagyobb mennyiségben előforduló kation az emberi szervezet egészében, és a legelterjedtebb ion az intracelluláris kompartmentekben.
A nyugati étrend átlagosan 80-100 mEq káliumot tartalmaz naponta, és normális fiziológiás körülmények között ennek 90%-a passzívan felszívódik, és csak 9,0 mmol marad a széklettel történő kiválasztásra. A szervezetben tárolt 3500-4000 mmol aránytalan a plazma napszakos káliumszintjéhez képest, amelyet általában 3,5-5,3 mmol/l között tartanak fenn szoros homeosztázismechanizmusok révén, a legalacsonyabb szint éjszaka és a kora reggeli órákban van, a legmagasabb csúcsérték pedig a délutáni órákban.
A véráramba való felszívódás után a vese feladata a káliumbevitel és a káliumkibocsátás összehangolása; ehhez több órára van szükség, amely idő alatt az inzulin és a katekolaminok hatására a “belső káliumegyensúly” az intracelluláris és extracelluláris tér közötti kálium-áthelyezéssel fenntartja az ideiglenes homeosztázist. Az alfa-receptorok ingerlése akadályozza a kálium bejutását a sejtekbe, a béta-receptorok ingerlése pedig elősegíti azt a nátrium-kálium ATPáz pumpa aktiválásával.
A nátrium-kálium ATPáz pumpa a szarkolemmában található kapuőrző enzim. Segít megóvni a sejtben visszatartott kálium 98%-át (kb. 144,0 mmol). Ez biztosítja a megfelelő sejtműködéshez szükséges, létfontosságú potenciálkülönbség megőrzését a sejtmembránokon keresztül, különösen az olyan ingerlékeny sejtekben, mint az idegsejtek és a szívizomsejtek.
A kálium normális fiziológiája és patofiziológiája
A kálium gyors felszívódása után az inzulin és az aldoszteron felszabadulásán keresztül segít a saját testszintjének szabályozásában. A szervezetben rejlő egyéb ingerek, amelyek szintén a kálium testszintjét szabályozzák, a béta-2 adrenerg receptorok, a vér lúgos PH-értéke és a sejtek anabolizmusa.
Az inzulin és az aldoszteron felszabadulása: A bevitt kálium gyorsan bekerül a keringésbe. A portális keringésbe jutva inzulin felszabadítására serkenti a hasnyálmirigyet. Ezzel egyidejűleg a juxtaglomeruláris sejtekhez jutó keringő kálium renin felszabadulását eredményezi. A renin a májba jutva angiotenzin I-vé alakul. Az angiotenzin I a tüdőbe jut, ahol angiotenzin II-vé alakul. Az angiotenzin II ezután a keringő véren keresztül befejezi útját vissza a vesékbe, hogy a zona glomerulosát aldoszteron kiválasztására serkentse.
Belső káliumegyensúly: A posztprandiálisan felszabaduló inzulin elsősorban a vázizmokra hat, két útvonalat aktiválva, az AKT-függő útvonalat, amely a GLUT4 glükóztranszporter beépüléséért felelős, és az APK útvonalat, amely a sejtek nátrium-kálium ATPázát aktiválja, hogy a káliumot az intracelluláris térbe tolja. Az AKT-függő útvonallal ellentétben az APK útvonalat sem a metabolikus szindróma, sem a krónikus vesebetegség nem károsítja (1. ábra).
Kiválasztás: A vese glomerulusai által szűrt kálium a szállított nátrium és víz mennyiségével arányosan passzívan visszaszívódik a proximális tubulusban és a Henle-hurokban. Normális esetben a szűrt terhelésnek csak mintegy 10%-a jut el a distalis nephronba.
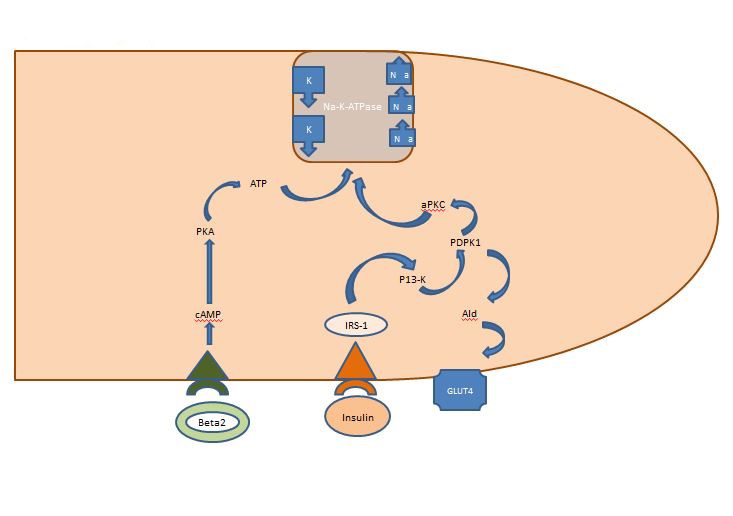
1. ábra. Az inzulin hatása egy vázizomsejtre. A postprandiálisan felszabaduló inzulin két útvonalat aktivál a vázizomzatban, az AKT-függő útvonalat, amely a GLUT4 glükóztranszporter beépüléséért felelős, és az APK útvonalat, amely aktiválja a sejtek nátrium-kálium ATPázát, hogy a káliumot az intracelluláris térbe tolja.
A distalis kanyargós tubulus kezdetén kezdődik a felesleges kálium kiválasztása, amely a distalis nefron felé haladva és a gyűjtőcsatornába haladva fokozatosan növekszik. Ezt a hidrogén-kálium-ATPáz felszabályozása közvetíti az alfa-interkalált sejteken .
A magasabb káliumszint jelenléte a vesék peritubuláris sejtjeiben aktiválja a RAAS rendszert aldoszteron felszabadítására, amely aktiválja a nátrium-kálium ATPázt a bazolaterális membránban, ami az intracelluláris nátrium csökkenését eredményezi, ami a membránfeszültség hiperpolarizálásával a káliumfelvétel fokozott elektrogenikus transzportjához vezet, és lehetővé teszi a vizeletbe való kiválasztását .
Hyperkalaemiában a vastagbélen keresztül ürülő kálium kvótája akár 30%-kal is megnövekedhet, pl, veseelégtelenség esetén, ahol a káliumot ezután a vastagbél enterociták bazolaterális membránjában lévő aktivált nátrium-kálium ATPáz pumpa aktívan felveszi, hogy a másik oldalon, a sejtek apikális nagy kalciumfüggő káliumcsatornáin keresztül a vastagbél lumenébe ürüljön.
A fentiekből tehát kitűnik, hogy a káliumplazmaszint-homeosztázis mechanizmusát elsősorban három egyidejű tranzakció – káliumbevitel, kálium intra/extracelluláris eltolódás és kálium vizeletkiválasztás – kölcsönhatása rendezi, amelyek végső soron mind a nátrium-kálium-pumpára támaszkodnak.
Ahhoz, hogy megértsük a hiperkalémiából eredő közvetlen veszély mechanizmusát és kezelését, meg kell értenünk az akciós potenciál fiziológiáját és a nátrium-kálium ATPáz enzim belsejét.
Az akciós potenciál elektrofiziológiája, ill, ionok mozgását a sejtmembránokon keresztül, két potenciál különbsége határozza meg, egy “kémiai potenciál”, amelyben az ionok lefelé mozognak a koncentrációs gradiensükön, és egy “elektromos potenciál”, amelyben az ionok és a molekulák taszítják a hasonló töltéseket, ami a transzmembrán potenciált (TMP) adja, amelyet +ve-nek mondunk, ha a +ve ionok nettó mozgása a sejten kívülre irányul, és fordítva.
Egy nem pacemaker kardiomiocita akciós potenciálja
Az akciós potenciálnak öt fázisa van, amelyek a 4. fázissal kezdődnek és végződnek. A folyamatban részt vevő pumpák közé tartozik a szarkolemma nátrium-kalciumcserélője, a kalcium-ATPáz és végül a nátrium-kálium-ATPáz.
- 4. fázis. A nyugalmi fázis: Ennek nyugalmi potenciálja -90 mV, ami a kálium befelé egyenirányító csatornákon keresztül történő állandó kifelé irányuló mozgásának eredménye. Ebben a fázisban mind a nátrium-, mind a kalciumcsatornák zárva vannak.
- 0. fázis. A depolarizációs fázis: egy pacemaker sejt tüzelése vagy egy szomszédos sejten keresztüli vezetése váltja ki a TMP -90 mV fölé emelkedését. Ezen a ponton , a “gyors nátriumcsatornák” egymás után kezdenek megnyílni, lehetővé téve a nátrium bejutását a sejtbe, emelve a TMP-t, és amint elég gyors nátriumcsatorna nyílt meg, hogy -70 mV-ot eredményezzen, egy önfenntartó befelé irányuló nátriumáram indul be, a TMP gyorsan 0 mV-ra depolarizálódik egy átmeneti időre, amelyet “túllövésnek” nevezünk, amikor is az időfüggő gyors nátriumcsatornák bezáródnak, és a “hosszan nyitó” kalciumcsatornák megnyílnak, hogy a TMP-t -40 mV-ra emeljék, és lehetővé tegyenek egy kis állandó kalcium beáramlást a koncentrációs gradiensén lefelé.
- 1. fázis. A korai repolarizációs fázis: ez az enyhén +ve TMP-vel és néhány káliumcsatorna rövid megnyílásával kezdődik, ami annak a sejt külső része felé történő áramlását eredményezi, visszavezetve a TMP-t körülbelül 0 mV-ra.
- 2. fázis. A platófázis: itt a két ellenáram elektromosan egyensúlyban van, és a TMP egyensúlyban tartását eredményezi valamivel 0 mV alatt. A “hosszan nyitó kalciumcsatornák” még mindig nyitva vannak, ami állandó kalciumáramlást eredményez a sejtbe. A késleltetett egyenirányító káliumcsatorna lehetővé teszi a kálium átjutását a sejten kívülre annak koncentrációgradiensén lefelé.
- 3. fázis. A repolarizációs fázis: Ebben a fázisban a kalciumcsatornák fokozatosan inaktiválódnak, és így a kálium tartós áramlása a sejten kívülre meghaladja a befelé irányuló kalciumáramlást, a káliumot visszavezeti a sejten belüli térbe, a nátriumot és a kalciumot pedig a sejten kívülre.
A szívpacemaker sejt akciós potenciálja
A szívpacemaker sejteknek veleszületett automatizmusuk van, ami lehetővé teszi a ritmikus ciklusokban történő depolarizációjukat. A sinoatrialis csomópont (SAN) rendelkezik a legnagyobb önindított depolarizációs ritmussal, 60-90/perc sebességgel, ezt követi az atrioventrikuláris csomópont (AVN) 40-60/perc sebességgel, majd a Purkinje-rostok és a kamrai izom 20-40/perc sebességgel.
A pacemaker sejtek membránpotenciáljai instabilak, és akciós potenciáljaiknak nincsenek egyértelműen elkülönülő fázisai. Kevesebb befelé egyenirányító káliumcsatornával rendelkeznek, és TMP-jük soha nem csökken -60 mV alá, ami kiküszöböli a gyors nátriumcsatornák szerepét, amelyek -90 mV-os TMP-t igényelnek, ami a gyors depolarizációs fázis hiányát eredményezi.
A TMP >-60 mV-on a “vicces/pacemaker” áram működésbe lép az ionok spontán áramlásával a lassú nátriumcsatornákon keresztül, depolarizálva a TMP-t <-50 mV-ra, majd vissza -60 mV-ra, amikor a kalciumcsatornák záródnak.
Áramvezetés
Minden kardiomiocita elektromosan összekapcsolódik a réskapcsolaton keresztül, beleértve a pacemaker sejtet is. Ez elősegíti az összes szomszédos sejt széleskörű depolarizációját, így a szív egyetlen funkcionális egységgé válik, amelyben a legnagyobb eredendő frekvenciával rendelkező sejt lesz a “pacemaker”.
Refractory period
A lassú kalciumcsatornáknak köszönhető hosszabb refractory period a 2. fázisban lévő hosszú plató alatt biztosítja a kamrák teljes kiürüléséhez szükséges időt a következő összehúzódás előtt. A refrakter időszak lehet abszolút (ARP), effektív (ERP) vagy relatív (RRP). ARP esetén a sejt abszolút ingerelhetetlen.
Az ERP az ARP-től a 3. fázis rövid szakaszáig tart. Egy inger ezen a ponton minimálisan depolarizálhatja a sejtet, de a depolarizáció szintje gyengébb, mint az akciós potenciál terjedése a szomszédos sejtek felé.
RP-t egy normálisnál nagyobb inger idéz elő, ami a sejt depolarizációjához és akciós potenciál keletkezéséhez vezet.
A “normális feletti periódus” egy olyan hiperexcitabilis állapot, amely során a normálisnál gyengébb inger aritmiához vezethet, ami a kardioverzió során a kamrafibrilláció elkerülése érdekében szükségessé teszi a szinkronizálást (2. ábra).
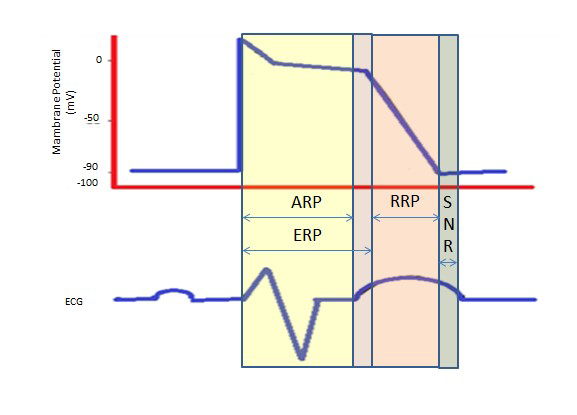
2. ábra. Refrakteriális periódusok. ARP: Abszolút refrakter periódus; ERP: Effektív refrakter periódus; RRP: Relatív refrakter periódus; SNR: Szupranormális refrakter periódus
Hyperkalaemia, osztályozás és okok
Klasszifikáció
A hyperkalaemia enyhe, ha a szintek 5,5-6,0 mmol/l között vannak, közepes 6,1-6,9 mmol/l között és súlyos 7 mmol/l szinteknél.0 mmol/L vagy annál magasabb szintnél, és minden olyan szintnél, ahol EKG elváltozások lépnek fel .
Erőforrások
A hiperkalémia akkor lép fel, amikor a kompenzációs mechanizmusok már nem képesek megbirkózni az egyensúlyhiánnyal, ezért általában multifaktoriális.
- A káliumbevitel növekedése bármilyen úton, pl., diétás szájon át történő bevitel, vagy káliumtartalmú folyadékok, például penicillin G intravénás beadása.
- A vese általi visszatartás: Mivel a kálium kiválasztása az aldoszterontól és a nefronokon belül elegendő mennyiségű nátrium és víz disztális szállításától függ, az olyan állapotok, mint a veseelégtelenség, a mellékveseelégtelenség (Addison-kór) , a hyporeninémiás hipoaldoszteronizmus IV. típusa, a vese tubuláris acidózis, különösen a diabéteszes nefropátiában szenvedő betegeknél, valamint minden olyan állapot, amely elősegíti a hipoperfúziót, mint a volumencsökkenés és a pangásos szívelégtelenség, befolyásolja a kálium bonyolult egyensúlyát a szervezetben, és hajlamosít a hiperkalémiára.
- Kisveseelégtelenség: ezt ki kell zárni hiperkalémiás betegeknél, különösen hiponatrémia és izomgyengeség jelenlétében. A primer mellékvesekéreg-elégtelenség szűrésére standard kozyntropin-stimulációs tesztet végeznek, amelyben 0,25 mg szintetikus kozyntropint adnak intravénás boluszként, majd 45 perccel vagy 1 órával később plazma kortizol mérést végeznek. A 20 mcg/dl-nél kisebb értékek mellékveseelégtelenségre utalnak.
- Káliumot visszatartó gyógyszerek: a vényköteles gyógyszerek, amelyek csökkentik a nátrium-kálium ATPáz aktivitását, mint például a béta-adrenerg receptor blokkolók, és az aldoszteron szekréciót csökkentő gyógyszerek, mint például az ACE és ARB gátlók, nem-szteroid gyulladáscsökkentők és káliumkímélő diuretikumok, szoros nyomon követést igényelnek az iatrogén hiperkalémia elkerülése érdekében, különösen a geriátriai korcsoportban, ahol az öregedési folyamat részeként fokozatosan csökken a vesefunkció.
- A kálium transzcelluláris eltolódásának zavarai: ez előfordulhat acidózisos állapotok, hiperglikémia, hiperozmolalitás, súlyos testmozgás, szöveti lebontás, hiperkalémiás periodikus paralízis és béta-adrenerg blokkolók esetén. A vér PH-értékének minden 0,1 egységnyi csökkenésére a szérum káliumszintje körülbelül 0,6 mmol/l-rel emelkedik (kevesebb, ha az acidózist szerves savak okozzák) .
- A pszeudo-hipoaldoszteronizmus egy veleszületett autoszomális recesszív betegség, amelyben a vesék rezisztensek az aldoszteron hatásával szemben.
- A pszeudo-hiperkalémiát sem szabad figyelmen kívül hagyni: mint a neve is mutatja, ez akkor fordul elő, ha normális plazmakálium mellett emelkedett a szérum káliumszint. Megjelenhet hemolizált vér, hosszan tartó szoros szorítókötés a vérvételi eljárás során, ami a kálium extracelluláris felszabadulását okozza, az ököl ismételt összeszorításával a flebotómia során, traumás vénapunkcióval, leukocitózis és trombocitózis esetén, valamint néhány nem gyakori genetikai szindrómában, mint a familiáris pszeudo-hiperkalémia és az örökletes szferocitózis. Lehet azonban egyszerűen csak egy egyszerű laboratóriumi hiba eredménye.
A hiperkalémia hatásai
Az enyhe hiperkalémia gyakran tünetmentes, laboratóriumi vizsgálatokkal véletlenül fedezik fel, olyan homályos tünetei miatt, mint a rossz közérzet, izomgyengeség és paraesztézia. A súlyos hyperkalaemia a neuromuszkuláris funkciót érinti vázizomgyengeség és bénulás formájában; ez azonban nem gyakori megjelenési forma, mivel a kardiális toxicitás uralja a képet, és ez az előzetes megjelenési forma. A kardiális toxicitás az EKG-n általában a következő lépcsőzetesen eszkalálódó módon jelenik meg, bár az etiológiától függően nem feltétlenül így van:
- 5,5 mEq/L-nél nagyobb szinteknél a káliumcsatornák vezetőképességének növekedése növeli az lkr áramot, ami gyors repolarizációhoz vezet a felszíni EKG-n csúcsos T-hullám formájában. Ezek a T-hullámok rövid, 150-250 msec közötti időtartamuk alapján megkülönböztethetők a szívinfarktus és a CVA hullámaitól.
- A 6,5 mEq/L-nél nagyobb káliumszinteknél tartós, küszöb alatti depolarizációs állapot alakul ki, ami késleltetést okoz a pitvari és kamrai depolarizációban. Az akciós potenciál 0. fázisának csökkenése hosszabb akciós potenciálhoz vezet, ami késleltetést okoz az intraventrikuláris és atrioventrikuláris vezetésben. A felszíni EKG-n ez a P-hullámok ellaposodásával és elvesztésével, valamint a QRS-komplexek kiszélesedésével jelentkezik. Az intraventrikuláris ingerületvezetés késleltetésének növekedésével a felszíni EKG-n a bal és jobb kötegági blokk jelei mutatkoznak. Ezt az alapján lehet megkülönböztetni a kötegág-betegségtől, hogy hiperkalémiában a késleltetés az egész QRS-komplexumban fennáll, nem csak a kezdeti, illetve a terminális szakaszon.
- 10 mEq/L-nél a sinoatrialis vezetés megszűnik, és a gyorsított junctionalis ritmus veszi át az irányítást. A kamrai ritmuszavarok a kiszélesedett QRS-komplexek és a T-hullámok összeolvadásával alakulnak ki, végül a klasszikus szinuszhullámos mintázatot alkotva. Amint ez bekövetkezik, a VF és az aszisztolé küszöbön áll, majd szívmegállás következik.
- Néha a változások kiszámíthatatlanok és kiszámíthatatlanok lehetnek, és az EKG a normálisból az aszisztoléba ugrik az etiológiai tényezők és befolyásoló hatásaik, pl. a káliumváltozás sebessége, a kalciumkoncentráció, a pH és a nátriumkoncentráció változékonysága miatt. Ezért a hiperkalémiát sürgősen kezelni kell, ha a káliumszint meghaladja a 6,5 mmol/l értéket, vagy ha a káliumszinttől függetlenül a hiperkalémia EKG-jelenségei jelentkeznek. Az akut hiperkalémiával kapcsolatban jelentett egyéb társulások: pszeudo MI képe az EKG felvételen, masszív ST-T szegmenssel a myocyta repolarizáció zavarai következtében, rövid PR és QT intervallum, sinus tachycardia, sinus bradycardia, idioventricularis ritmus, 1. és 2. fokú szívblokk .
Metabolikus hatások
A hiperkalémia hiperklorémiás metabolikus acidózishoz vezet, mivel a hiperkalémia elősegíti a kálium intracelluláris felvételét hidrogénionokért cserébe. Ez intracelluláris alkalózist hoz létre, ami elnyomja a vese ammóniatermelését a proximális tubulusokban, ami a vizelettel történő ammónium- és savkiválasztás csökkenéséhez és IV. típusú vese tubuláris acidózishoz vezet .
Nátrium-kálium-pumpa
A nátrium-kálium-ATPázt 1957-ben fedezte fel Skou, aki később a felfedezéséért részesült az 1997-es kémiai Nobel-díjból.
Skou volt az első, aki felfedezte a nátrium-kálium-ATPázt a szívizom sejtfelszínének szarkolemmájában. Jelenlétét később minden eukarióta egy- és többsejtű szervezetben kimutatták.
A nátrium-kálium-pumpa úgy működik, hogy az ATP hidrolízisét összekapcsolja három nátriumion sejtszintű exportjával két káliumionért cserébe, az elektrokémiai gradiensük ellenében. Ez a molekuláris célpontja a digitalisnak és a digoxinnak, amelyeket a 18. század óta használnak rókagombakivonat formájában.
A nátrium-kálium-pumpa működését egy foszfoprotein, a foszfolemman szabályozza, amelynek unfoszforilációja a pumpa gátlásához, foszforilációja pedig a pumpa aktivitásának növekedéséhez vezet. Három foszforilációs, két palmitoilációs és egy glutationilációs helyszínnel rendelkezik, ami megmagyarázza a pumpát stimulálni és gátolni képes jelek sokaságát.
Maga a nátrium-káliumpumpa egy több alegységből álló, több izoformával rendelkező enzim. Működéséhez elengedhetetlen az alfa- és béta-alegységek jelenléte (a szívben főként B1). Nemrégiben azonosítottak egy harmadik fehérje gamma alegységet a vesében, de a mai napig ismeretlen a funkciója.
A nátrium-káliumpumpa enzim katalitikus magja az alfa alegység. Körülbelül 100 kDa méretű, és tartalmazza a nátrium, a kálium, az ATP és a kardiotonikus szteroidok, például az ouabain kötőhelyeit. Csak az alfa-1 és az alfa-2 mutatnak jelentős jelenlétet a normál szívizomsejtekben, és funkcionálisan kapcsolódnak a nátrium-kalciumcserélőhöz (NCX). Az alfa 3-ról beszámoltak, hogy kísérleti szívelégtelenség modellekben az alfa 2-t helyettesíti .
A legújabb kísérletek adatai azt mutatják, hogy a pumpa mindkét alfa 1 alfa 2 alegysége részt vesz a gerjesztés-összehúzódás (E-C) kapcsolás szabályozásában. Az alfa 1-ről, amelyről megállapították, hogy egyenletesebben oszlik el a szarkolemmában, úgy gondolják, hogy inkább “házvezető” szerepet játszik, és mind a kontraktilitást, mind a nagy mennyiségű intracelluláris nátriumot szabályozza, míg az alfa 2-ről, amelynek expressziója a T-tubulusokban koncentrálódik az E-C-kapcsolás más kulcsfontosságú összetevőivel együtt, úgy gondolják, hogy elsősorban a kontraktilitásra összpontosít .
A nátrium-káliumpát szabályozó ismert tényezők közé tartoznak: ATP, intracelluláris nátrium, szubszarkolemmális gátak és homályos terek, membránpotenciál, intracelluláris jelátviteli útvonalak (adrenerg jelátviteli útvonalak, protein kináz A & C, nitrogén-oxid, foszfolimán), kis molekulák (lipidek, endogén kardiotonikus szteroidok) általi közvetlen szabályozás, egyéb társult fehérjék (caveolák és caveolinok, ankyrin).
Következtetés
A hiperkalémia klinikai kihívást jelent, és a kórházi betegek akár 10%-ánál is jelentkezhet . Végeredménye életveszélyes. Mivel a szervezet összes sejtjét végső soron a nátrium-kálium-pumpa érinti, és az iszkémiás szívizomról ismert, hogy extracellulárisan extrudálja káliumát, ami az aritmiaküszöb csökkenéséhez vezet, a kamrai aritmiák lehetőségével, amelyek súlyosbítják a hipopolarizációt és még inkább csökkentik a küszöböt, több tanulmányt kell összpontosítani a nátrium-kálium enzim manipulációjára, mivel annak ellenőrzése kedvezően megváltoztathatja a szívmegállások kimenetelét és átírhatja a jelenlegi CPR irányelveket.