Mag- és valenciaelektronok
Amint így haladunk tovább a periódusos rendszerben, egyre nagyobb és nagyobb atomok elektronkonfigurációit írva, fárasztóvá válik a kitöltött belső alhéjak konfigurációinak folyamatos másolása. A gyakorlatban a kémikusok egyszerűsítik a jelölést azzal, hogy egy zárójeles nemesgáz szimbólummal jelölik az előző sorban szereplő nemesgáz konfigurációját, mivel egy nemesgázban az összes pálya kitöltött. Például a neon 1s2 2s2 2p6 elektronkonfigurációját (Z = 10) képviseli, így a nátrium Z = 11-es elektronkonfigurációját, amely 1s2 2s2 2p6 3s1, 3s1
| Teljes elektronkonfiguráció | Nobel gáz rövidírás | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Nátrium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
A kitöltött belső pályákon lévő elektronok közelebb vannak az atommaghoz és szorosabban kötődnek hozzá, ezért ritkán vesznek részt kémiai reakciókban. Ezeket a magelektronokat magelektronoknak fogjuk nevezni. A reprezentatív elemek (a periódusos rendszer 1., 2. és 13-18. oszlopa) esetében a magelektronok mind olyan elektronok, amelyek n-értéke kisebb, mint az elektronkonfiguráció maximális n-értéke. Például a nátriumatomban a legnagyobb n-érték 3. Így a magelektronok az n < 3 atomi pályákon, azaz az 1s, 2s és 2p pályákon lévő elektronok. A nátriumnak tehát 10 magelektronja van. A magelektronok e definíciójára később az átmeneti fémek esetében még visszatérünk.
Ez azt jelenti, hogy egy atom kémiája leginkább a legkülső héjban lévő elektronoktól függ, a legnagyobb n-értékkel rendelkező elektronoktól, amelyeket valenciaelektronoknak nevezünk. Az egyszerűsített jelölés lehetővé teszi, hogy könnyebben átlássuk a valenciaelektron-konfigurációt. Ha ezt a jelölést használjuk a nátrium és a lítium elektronkonfigurációjának összehasonlítására, akkor a következőket kapjuk:
| Nátrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lítium | 1s2 2s1 | 2s1 |
Ez könnyen belátható, hogy mind a nátriumnak, mind a lítiumnak van egy s elektronja a valenciahéjukban. Ezért azt jósolnánk, hogy a nátrium és a lítium kémiája nagyon hasonló, ami valóban így is van.
Amint folytatjuk a 3. periódus nyolc elemének felépítését, a 3s és 3p pályákat egyszerre egy-egy elektronnal töltjük fel. Ez a sor az argon nemesgázzal zárul, amelynek az elektronkonfigurációja 3s2 3p6, ami egy kitöltött valenciahéjnak felel meg.
Példa 2.2.2
Rajzolj egy orbitális diagramot, és vezesd le belőle a foszfor Z = 15 elektronkonfigurációját. Mi a valenciaelektron-konfigurációja?
Adott: atomszám
Kérdés: a foszfor orbitális diagramja és valenciaelektron-konfigurációja
Stratégia:
- Keresd meg a periódusos rendszerben a foszfort megelőző legközelebbi nemesgázt. Ezután vonjuk ki az elektronjainak számát a foszfor elektronjainak számából, hogy megkapjuk a foszfor valenciaelektronjainak számát.
- A 2.1.1. ábrára hivatkozva rajzoljunk egy pályadiagramot, amely ezeket a valenciaelektronokat ábrázolja. A Hund-szabályt követve helyezzük el a valenciaelektronokat a rendelkezésre álló pályákon, kezdve azzal a pályával, amelynek a legkisebb az energiája. Írja fel az elektronkonfigurációt a pályadiagramjáról.
- A belső pályákat (azokat, amelyek megfelelnek a legközelebbi nemesgáz elektronkonfigurációjának) hagyja figyelmen kívül, és írja fel a foszfor valenciaelektron-konfigurációját.
Megoldás:
A Mivel a foszfor a periódusos rendszer harmadik sorában áll, tudjuk, hogy 10 elektronnal zárt héja van. Azzal kezdjük, hogy a foszforban lévő 15 elektronból kivonunk 10-et.
B A további öt elektront a következő szabad pályákon helyezzük el, amelyek a 2.1. ábra.1 szerint a 3s és a 3p pályák:
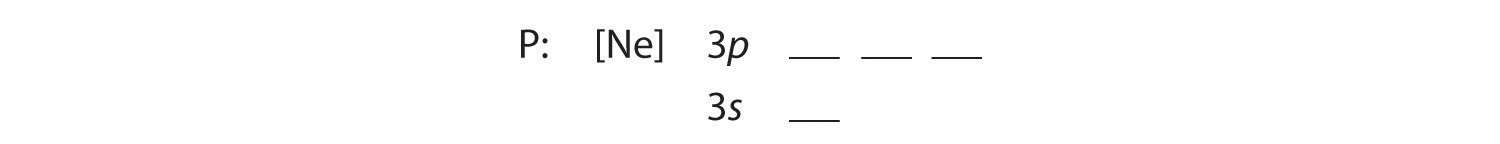
Mivel a 3s pálya energiája alacsonyabb, mint a 3p pályáké, először azt töltjük ki:
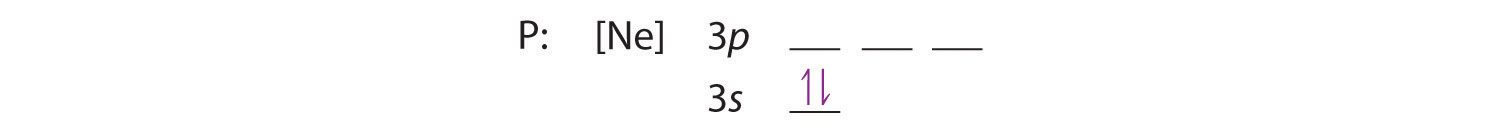
Hund szabálya szerint a maradék három elektron külön-külön, de spinekkel összehangolva foglalja el a degenerált 3p pályákat:
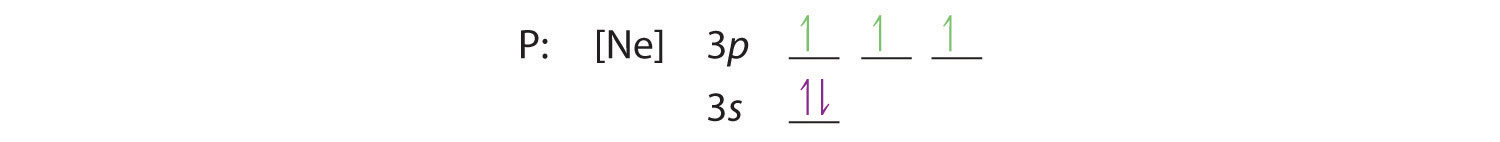
Az elektronkonfiguráció 3s2 3p3.
C A valenciaelektron-konfigurációt a belső pályák figyelmen kívül hagyásával kapjuk, ami a foszfor esetében azt jelenti, hogy figyelmen kívül hagyjuk a zárt héjat. Így a valenciaelektron-konfiguráció 3s2 3p3.
gyakorlat 2.2.2
Rajzoljunk egy orbitális diagramot, és ennek segítségével vezessük le a klór Z = 17 elektronkonfigurációját. Mi a valenciaelektron-konfigurációja?
Válasz: A klór elektronkonfigurációja a klór elektronkonfigurációja:
Valenciaelektron-konfiguráció: 3s2 3p5
Valenciaelektron-konfiguráció: 3s23p5
A pályák betöltésének általános sorrendjét a 2.2.1. ábra mutatja. Az egyes n értékeknek megfelelő alhéjakat balról jobbra egymást követő vízszintes sorokba írjuk, ahol minden sor a periódusos rendszer egy-egy sorát jelöli. A pályák kitöltési sorrendjét a jobb felsőtől a bal alsóig tartó átlós vonalak jelzik. Ennek megfelelően a 4s orbitális az árnyékolási és penetrációs hatások miatt előbb van kitöltve, mint a 3d orbitális. Következésképpen a negyedik periódust kezdő kálium elektronkonfigurációja 4s1, a kalciumé pedig 4s2. A következő 10 elem, az átmeneti fémek öt 3d pályát töltenek be, majd három 4p pálya következik. Vegyük észre, hogy e sor utolsó tagja a nemesgáz kripton (Z = 36), a Kr: 4s2 3d10 4p6, amely 4s, 3d és 4p pályákkal rendelkezik. A periódusos rendszer ötödik sora lényegében ugyanaz, mint a negyedik, azzal a különbséggel, hogy az 5s, 4d és 5p pályák sorrendben vannak kitöltve.
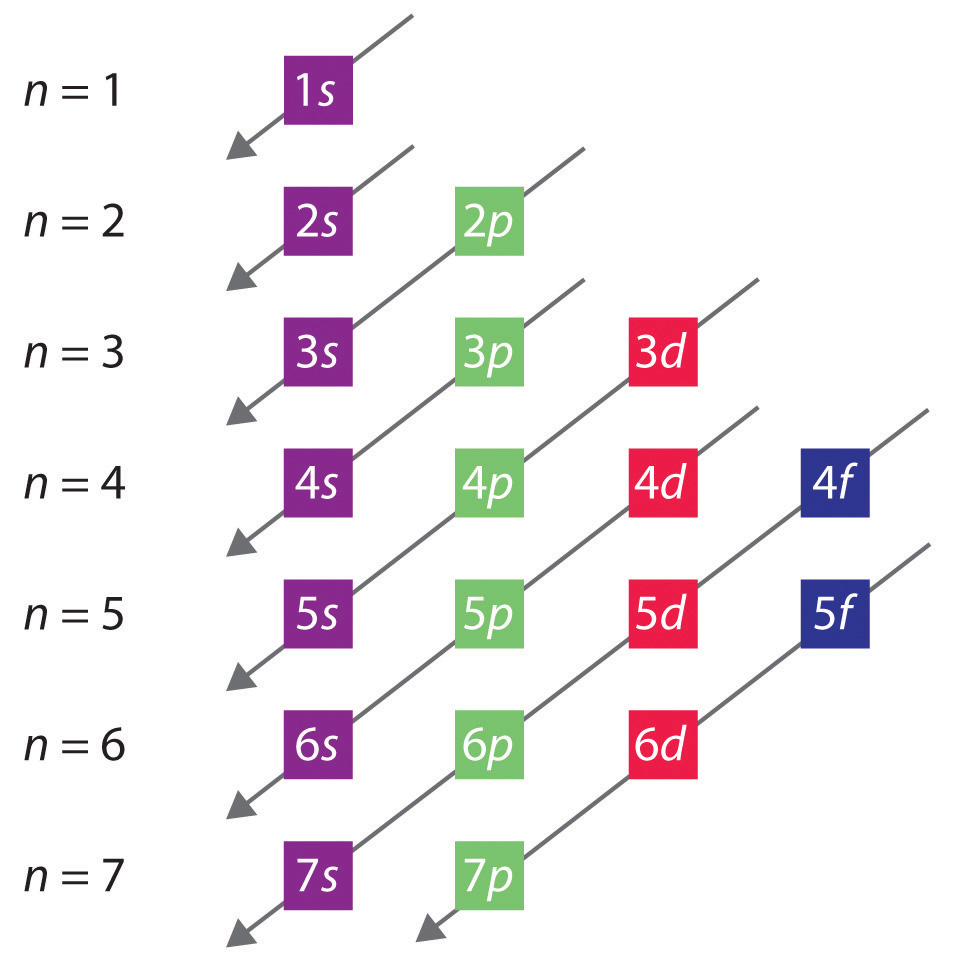
2.2.1. ábra A pályák kitöltési sorrendjének előrejelzése a többelektronos atomokban. Ha a főkvantumszám minden egyes értékéhez tartozó alhéjakat egymás után következő sorokra írjuk, akkor a betöltésük megfigyelt sorrendjét a jobb felsőtől a bal alsóig tartó átlós vonalak sora jelzi.
A periódusos rendszer hatodik sora eltér az előző kettőtől, mert a 4f pályákat, amelyek 14 elektron befogadására képesek, a 6s és az 5d pályák között töltjük ki. Azok az elemek, amelyek 4f pályákat tartalmaznak a valenciahéjukban, a lantanidák. Amikor a 6p pályák végleg kitöltődnek, elérkeztünk a következő (és utolsó ismert) nemesgázhoz, a radonhoz (Z = 86), Rn: 6s2 4f14 5d10 6p6. Az utolsó sorban az 5f pályák a 7s és a 6d pályák között vannak kitöltve, ami a 14 aktinid elemet adja. Mivel a nagy protonszám miatt az atommagjaik instabilak, az összes aktinoid radioaktív.
Példa 2.2.3
Írd fel a higany (Z = 80) elektronkonfigurációját, feltüntetve az összes belső pályát.
Adott: atomszám
Kérdés: teljes elektronkonfiguráció
Stratégia:
A 2.2.1. ábrán látható pályadiagramot és a periódusos rendszert segítségül hívva töltse ki a pályákat, amíg mind a 80 elektron el nem kerül.
Megoldás:
Az elektronokat a 2.2. ábrán látható sorrendet követve helyezze el a pályákon.1, és használjuk a periódusos rendszert útmutatóként, megkapjuk
| 1s2 | sor 1 | 2 elektronok |
| 2s22p6 | sor 2 | 8 elektron |
| 3s23p6 | sor 3 | 8 elektron |
| 4s23d104p6 | sor 4 | 18 elektron |
| 5s24d105p6 | sor 5 | 18 elektron |
| sor 1-5 | 54 elektron |
Az első öt sor kitöltése után, még mindig van 80 – 54 = 26 elektron, amit el kell helyeznünk. A 2.2.2. ábra szerint a 6s (2 elektron), 4f (14 elektron) és 5d (10 elektron) pályákat kell kitöltenünk. Az eredmény a higany elektronkonfigurációja:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
töltött 5d alhéjjal, 6s2 4f14 5d10 valencia héj konfigurációval és összesen 80 elektronnal. (Mindig ellenőrizni kell, hogy az elektronok összlétszáma megegyezik-e az atomszámmal.)
gyakorlat 2.2.3
Bár a 114-es elem nem elég stabil ahhoz, hogy a természetben előforduljon, 1999-ben egy orosz és amerikai tudósokból álló csoport először hozta létre egy atomreaktorban a 114-es elem két izotópját. Írja fel a 114-es elem teljes elektronkonfigurációját.
Válasz: Írja fel a 114-es elem teljes elektronkonfigurációját: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Az elemek elektronkonfigurációit a 2.2.3. ábra mutatja be, amely a kitöltési sorrendben sorolja fel a pályákat. Az alapállapot elektronkonfigurációi több esetben eltérnek a 2.2.1. ábra által megjósoltaktól. Ezen anomáliák némelyike a 3d orbitálisok kitöltésekor jelentkezik. Például a króm megfigyelt alapállapotbeli elektronkonfigurációja 4s1 3d5, nem pedig a megjósolt 4s2 3d4. Hasonlóképpen, a réz megfigyelt elektronkonfigurációja 4s1 3d10 az s2 3d9 helyett. A tényleges elektronkonfiguráció racionalizálható a félig töltött (ns1, np3, nd5, nf7) vagy töltött (ns2, np6, nd10, nf14) alhéjjal kapcsolatos hozzáadott stabilitással. Tekintettel a magasabb energiaszintek közötti kis különbségekre, ez a hozzáadott stabilitás elegendő ahhoz, hogy egy elektron egyik orbitálról a másikra kerüljön. A nehezebb elemekben más, összetettebb hatások is fontosak lehetnek, amelyek a 2.2.3. ábrán jelzett további anomáliákhoz vezetnek. Például a cérium elektronkonfigurációja 6s2 4f1 5d1, amit lehetetlen egyszerű módon racionalizálni. A legtöbb esetben azonban ezeknek a látszólagos anomáliáknak nincsenek fontos kémiai következményei.
Megjegyzés
A félig vagy teljesen kitöltött alhéjakhoz további stabilitás társul.