Veden ominaisuudet
Planeetastamme tekee erityisen muun muassa nestemäisen veden esiintyminen. Vesi on perustavanlaatuista kaikelle elämälle; ilman sitä jokainen elävä olento kuolisi.
Vesi peittää noin 70 % maapallon pinnasta, ja se muodostaa 65-75 % kehostamme (82 % verestämme on vettä). Vaikka vesi saattaa vaikuttaa tylsältä – sillä ei ole väriä, makua tai hajua – sillä on hämmästyttäviä ominaisuuksia, jotka tekevät siitä välttämättömän elämää ylläpitävän.
(Veden tarpeemme ja vedessä elävät merieläimet tekevät öljyvuodoista niin vahingollisia.)
Veden kemiallinen koostumus on H2O – kaksi vetyatomia ja yksi happiatomi. Veden ominaisuudet ovat erityisiä, koska sen atomit sitoutuvat toisiinsa muodostaen vesimolekyylin ja koska molekyylit ovat vuorovaikutuksessa keskenään.
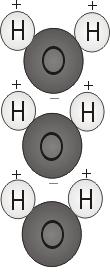
Veden polaarisuus
Kun kaksi vetyatomia sitoutuu hapen kanssa, ne kiinnittyvät molekyylin yläosaan pikemminkin kuin Mikki Hiiren korvat. Tämä molekyylirakenne antaa vesimolekyylille polariteetin eli vinon sähkövarauksen, joka vetää puoleensa muita atomeja.
Molekyylin pää, jossa on kaksi vetyatomia, on positiivisesti varautunut. Toinen pää, jossa on happi, on negatiivisesti varautunut. Aivan kuten magneetissa, jossa pohjoisnavat vetävät puoleensa etelänavat (”vastakohdat vetävät puoleensa”), vesimolekyylin positiivinen pää yhdistyy muiden molekyylien negatiiviseen päähän.
Mitä tämä tarkoittaa meille? Veden polaarisuuden ansiosta se voi liuottaa muita polaarisia aineita hyvin helposti. Kun polaarinen aine laitetaan veteen, sen molekyylien positiiviset päät vetävät puoleensa vesimolekyylien negatiivisia päitä ja päinvastoin. Vetovoiman ansiosta uuden aineen molekyylit sekoittuvat tasaisesti vesimolekyyleihin.
Vesi liuottaa enemmän aineita kuin mikään muu neste – jopa vahvin happo! Tämän vuoksi sitä kutsutaan usein ”universaaliksi liuottimeksi”. Veden liuotuskyky on erittäin tärkeä maapallon elämälle. Minne tahansa vesi meneekin, se kuljettaa mukanaan liuenneita kemikaaleja, mineraaleja ja ravinteita, joita käytetään elävien olentojen ylläpitämiseen.
Vesimolekyylit vetävät toisiaan puoleensa voimakkaasti napaisuutensa vuoksi, mikä antaa vedelle suuren pintajännityksen. Veden pinnalla olevat molekyylit ”tarttuvat yhteen” muodostaen veteen eräänlaisen ”ihon”, joka on tarpeeksi vahva kannattelemaan hyvin kevyitä esineitä. Hyönteiset, jotka kävelevät veden päällä, käyttävät tätä pintajännitystä hyväkseen.
Pintajännitys saa veden kasaantumaan pisaroiksi sen sijaan, että se levittäytyisi ohueksi kerrokseksi.
Sen ansiosta vesi pääsee myös liikkumaan kasvien juurien ja varsien, lämpömittareiden ja kehosi pienimpien verisuonten läpi. Kun yksi molekyyli liikkuu ylöspäin, se ”vetää” muita mukanaan.
Kolme ainetilaa
Vesi on yksi neljästä alkuaineesta ja ainoa luonnollinen aine, joka voi esiintyä kaikissa kolmessa ainetilassa – kiinteässä, nestemäisessä ja kaasumaisessa – Maan tavanomaisissa lämpötiloissa.
Monet muut aineet täytyy ylikuumentaa tai -jäähdyttää vaihtaakseen olomuotoaan.
Veden kaasumainen olomuoto on jatkuvasti läsnä ilmakehässämme vesihöyrynä. Nestemäistä olomuotoa esiintyy kaikkialla joissa, järvissä ja valtamerissä.
Veden kiinteä olomuoto, jää, on ainutlaatuinen. Useimmat nesteet supistuvat jäähtyessään, koska molekyylit liikkuvat hitaammin ja niillä on vähemmän energiaa vastustaa toistensa vetovoimaa. Kun ne jäätyvät kiinteiksi, ne muodostavat tiiviitä kiteitä, jotka ovat paljon tiheämpiä kuin neste alun perin oli.
Vesi ei toimi näin. Jäätyessään se laajenee: molekyylit asettuvat riviin muodostaen hyvin ”avoimen” kiderakenteen, joka on vähemmän tiheä kuin nestemäinen vesi.
Tämän vuoksi jää kelluu. Ja se on hyvä asia, että se kelluu! Jos vesi käyttäytyisi kuten useimmat muut nesteet, järvet ja joet jäätyisivät jähmeiksi ja kaikki niissä oleva elämä kuolisi.
Kolme muuta veden ominaisuutta
Vedellä on korkea ominaislämpö. Toisin sanoen, toisin kuin ilma, vesi voi absorboida paljon lämpöä muuttamatta lämpötilaa. Siksi uiminen tuntuu niin virkistävältä kuumana päivänä.
Vesi myös menettää lämpöä hitaammin kuin ilma. Tästä seuraa, että kesällä järvi- ja merivesi on yleensä kylmintä kauden alkupuolella ja lämpimintä kauden loppupuolella (sen jälkeen, kun se on imenyt auringon energiaa useiden päivien ajan).
Veden kiehumispisteeseen (212° F tai 100 °C merenpinnan tasolla) vaikuttaa korkeus merenpinnasta. Yleensä veden kiehumispiste on sitä alhaisempi, mitä korkeammalla vesi on. Esimerkiksi Denverissä, CO:ssa (5 280 ft.) vesi kiehuu 202,4° F. Mount Everestillä Nepalissa (29 012 ft.) vesi kiehuu 156° F.
Vesi-tiedeprojektit:
- Veden kiertokulku
- Vesipyörä
- Super-jäähdytetty vesi
- Vesisäiliö