Mikrobiologinen biorealmisivu Rhodospirillum rubrum-suvusta
Luokitus
Korkeamman luokan taksonit
Kunta: Bacteria
Phylum: Proteobacteria
Class: Rhodospirillales
Suku: Rhodospirillaceae
Suku: Rhodospirillum
Lajit
Rhodospirillum rubrum
Kuvaus ja merkitys
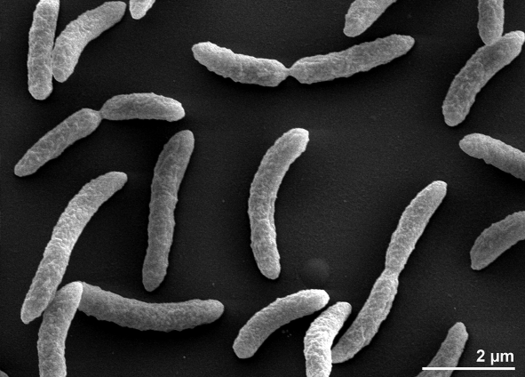
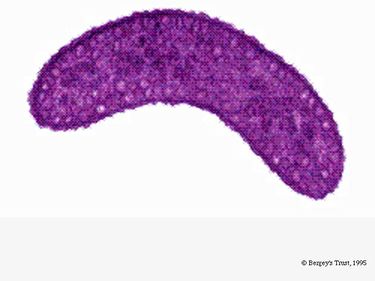
Rhodospirillum rubrum on gramnegatiivinen, mesofiilinenproteobakteeri. Sen optimaalinen kasvulämpötila on 25-30 celsiusastetta. Sillä on monikerroksinen ulkokuori, jonka soluseinässä on enimmäkseen tyydyttymättömiä, mutta jonkin verran tyydyttyneitä rasvoja. R. rubrum on spirilla, eli se on spiraalin muotoinen. Se on poolisesti lippulainen ja siten liikkuva. Sen pituus on 3-10 um ja leveys 0,8-1,0 um.
R. rubrum on fakultatiivinen anaerobi. Hapen läsnäolosta riippuen se voi käydä läpi alkoholikäymistä tai aerobista hengitystä. Se kykenee myös fotosynteesiin ja sisältää kromatofoorihiukkasissaan karotenoidia ja baterioklorofylliä. Nämä molekyylit auttavat absorboimaan valoa ja muuntamaan sen energiaksi, ja ne antavat sille myös selvän purppuranpunaisen värin anaerobisissa olosuhteissa. R. rubrum on väritön aerobisissa olosuhteissa.
Vaikka fotosynteesi on aktiivinen aerobisissa olosuhteissa, se yleensä estyy O2:n läsnä ollessa. Rikki on fotosynteesin tärkein sivutuote, ei O2. R. rubrum voi kasvaa heterotrofisesti tai autotrofisesti, kun se on fotosynteettinen. Toisin kuin monet kasvit, R. rubrum ei sisällä a-klorofylliä (absorptiospektri 430-662 nm). Se sisältää kuitenkin b-klorofylliä (absorptiospektri 660-680 nm) ja bakteeriklorofylliä (800-925 nm). Tämän ansiosta se pystyy hyödyntämään enemmän energiaa sähkömagneettisesta spektristä. R. rubrum hapettaa myös hiilimonoksidia (CO) vetykaasun ollessa reitin lopputuote, ja se voi käyttää pieninä pitoisuuksina sulfidia elektroninluovuttajana hiilidioksidin pelkistyksessä. Lisäksi se on typpeä sitova bakteeri; se käyttää nitrogenaasia muuttaakseen ilmakehän typpikaasun ammoniakiksi (Munk et al., 2011).
R. rubrumilla on useita sovelluksia bioteknologian alalla. Se on mallijärjestelmä valon muuntamiseksi kemialliseksi energiaksi ja sen typensidontatapojen osalta. Se on myös säteilynkestävyystutkimusten kohteena. Sitä voidaan käyttää monin tavoin myös kulutukseen. Proteobakteerit voivat olla eläinten ravinnon ja maatalouden lannoitteiden lähde. Toinen tärkeä rooli tutkimuksessa on vitamiinien tuottaminen. Sitä tutkitaan myös biologisen muovin tuottamiseksi polyhydroksi-viinihapon esiasteista. R. rubrum voi myös olla osallisena biologisissa vetypolttoaineissa, lähinnä sen kehittämän nitrogenaasientsyymin avulla.
Genomin rakenne
Genomin sekvensointi on valmis. Se koostuu pyöreästä kromosomista, jossa on 4 352 825 emäsparia, joista 65 % on guaniinikystosiinipareja. Lisäksi on plasmidi, jossa on 53 732 emäsparia, joista 60 % on guaniinisytosiinia. Kaikkiaan proteiineja koodaavia geenejä on 3 850 ja RNA-geenejä 83. Näistä geeneistä 6,9 % liittyy transkriptioon, 4,6 % translaatioon, ribosomien rakenteeseen ja biosynteesiin, 4,0 % replikaatioon, rekombinaatioon ja korjaukseen, 7,9 % signaalinsiirtomekanismeihin, 5,9 % soluseinän ja kalvojen biogeneesiin, 6,6 % energiantuotantoon ja -muuntamiseen, 5,0 % hiilihydraattien kuljettamiseen ja aineenvaihduntaan, 9,9 % geenien transkriptioon.9 % aminohappojen kuljetus ja aineenvaihdunta; 4,7 % koentsyymien kuljetus ja aineenvaihdunta; 3,7 % lipidien kuljetus ja aineenvaihdunta; ja 6,5 % epäorgaanisten ionien kuljetus ja aineenvaihdunta(Munk et al, 2011).
Ecology
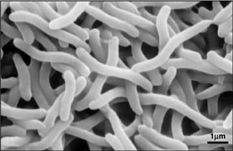
Johtuen siitä, että Rhodospirillum rubrum voi kasvaa sekä aerobisesti että anaerobisesti, se pystyy asuttamaan monenlaisia olosuhteita. R. rubrumia esiintyy monissa luonnollisissa vesiympäristöissä, kuten lammissa, järvissä, puroissa ja seisovassa vedessä (Reslewic et. al, 2005). R. rubrumia tavataan usein myös mudassa ja jätevedessä (Brock et al., 2000). Tutkimukset ovat osoittaneet, että R. rubrum voi tehdä suuria muutoksia kemialliseen koostumukseensa sopeutuakseen erilaisiin ympäristöihin (Cohen-Bazire ja Kunisawa, 1963). R. rubrum kasvaa mieluiten elinympäristöissä, joiden pH on 6,8-7,2 (Bergey ja Holt, 1994). Tutkimukset ovat myös osoittaneet, että R. rubrumin optimaalinen kasvulämpötila on 22-35 celsiusastetta (Weaver, 1971).
Solurakenne ja aineenvaihdunta
R. rubrum on monipuolinen organismi, joka pystyy hankkimaan energiaa eri mekanismeilla. Hengitys- ja fotosynteesimekanismit ovat olemassa yhdessä, ja niiden toiminta riippuu valon ja energian läsnäolosta. R. rubrum voi kasvaa pimeässä kemotrooppisessa ympäristössä, jossa on happea, tai se voi kasvaa valotrooppisessa ympäristössä, jossa ei ole happea.
Fotosynteesi R. rubrumissa alkaa vedyn luovuttamisella orgaanisesta substraatista hapettavaan substraattiin. Bakteeriklorofylli ja kartenoidit, solukalvolla olevat fotoreaktiiviset pigmentit, sitoutuvat kromatofooreihin (Schachman, Pardee ja Stanier, 1952). Kromatofoorit ovat litteitä kiekkoja, jotka sisältävät koliinifosfolipidejä, kardiolipiinia ja galaktosyylidiglyseridejä (Benson, Wintermans ja Wiser, 1959; Benson 1961). Lisäksi kromatofoorit sisältävät täydellisen elektroninkuljetusketjun, johon kuuluu erilaisia sytokromeja, flaviinia ja pyridiininukleotideja (Newton ja Newton, 1957; Hulcher ja Conti, 1960; Kamen, 1961). Solukalvo sisältää myös ATP-synteesin koneiston, mukaan lukien ATP-syntetaasin.
Hapen läsnä ollessa R. rubrum kykenee aerobiseen hengitykseen käyttäen perinteistä elektroninkuljetusketjua, jossa NAD+/NADH on ensisijainen elektronin kuljettaja (Keister ja Minton, 1969). Elektroninsiirtoproteiineihin kuuluu sytokromi C428 (Chance ja Smith, 1955). Fotosynteesi estää kuitenkin aerobisen hengityksen (Oelze ja Weaver, 1971).
R. rubrum kykenee myös anaerobiseen hengitykseen. Sen ei-hapettavia pääteelektroniakseptoreita voivat olla dimetyylisulfoksidi ja trimetyyliamiinioksidi. Näiden elektroniakseptorien läsnäolo mahdollistaa sen, että substraatit, kuten sukkinaatti, malaatti ja asetaatti, tukevat R. rubrumin kasvua. Nämä akseptorit ovat kuitenkin vain noin 33-41 prosenttia yhtä tehokkaita kuin happi energian säilymisen kannalta (Schultz ja Weaver, 1982).
Lisäksi R. rubrumilla on ainutlaatuinen kyky hapettaa hiilimonoksidia hiilimonoksididehydrogenaasin avulla. Tämä hapettumisreitti päättyy pelkistymiseen ja vetyyn sekä vetykaasun tuotantoon.
Ilman pääteelektronin akseptoria R. rubrum suorittaa sekahappokäymisen. Pyruvaattikäymisen päätuotteet ovat asetaatti, formiaatti, hiilidioksidi ja vety. Bikarbonaatti-ionin läsnä ollessa fruktoosi pystyy fermentoitumaan. Tämän reitin lopputuotteet ovat samat kuin pyruvaatin, mutta niihin lisätään sukkinaatti ja propionaatti (Schultz ja Weaver 1982).
Hiilidioksidin sidontakyvyn (Schon ja Biedermann 1972) lisäksi R. rubrumin eräs tunnistettava anabolinen ominaisuus on sen kyky sitoa typpeä. Pimeissä olosuhteissa fruktoosin läsnä ollessa R. rubrum käyttää nitrogenaasia sitoakseen typpikaasua ammoniumiksi. Se sisältää sekä Fe-Mo- että pelkkää Fe:tä sisältäviä nitrogenaaseja.
Patologia
R. rubrumin ei ole todettu tarttuvan ihmisiin tai eläimiin.
Nykytutkimus
Säteilynkestävyys
Rhodospirillum rubrum on hiljattain tarjonnut tietoa säteilynkestävyydestä. Felice Mastroleo ym. ovat teoksessaan Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010) luonnehtineet R. rubrumin säteilyn sietokykyä.
Alle altistamalla bakteereita sub-letaalisille annoksille Cobalt-60 gammasäteilyä, joka on eräs ionisoivan säteilyn laji, karakterisoitiin elimistön ionisoivalle säteilylle spesifiset R. rubrumin markkerimerkkiaineksen geenit. Näiden geenien ilmentyminen lisääntyi sitä mukaa kuin ”toipumisaika” kului tietyn gammasädehoidon jälkeen. R. rubrumin gammasäteilyn jälkeisen geeniekspression analyysi luo mahdollisuuksia mikrobiologiseen jatkotutkimukseen, joka voi tulevaisuudessa johtaa sovelletun säteilynkestävyyden edistymiseen.
Biohajoavat muovit
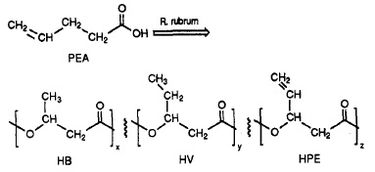
R. rubrumin on todettu tuottavan erästä biohajoavien muovien luokkaa, eli poly-beeta-hydroksialkanoaatteja (poly-beta-hydroksialkanoaatteja). Tämän tutkimuksen sovelluksilla voidaan ratkaista monia ongelmia, joita synteettiset, hajoamattomat muovit ovat aiheuttaneet ja jotka ovat vaikuttaneet haitallisesti ympäristöön. Herbert. W. Ulmer et al. tekivät Rhodospriillum rubrumilla (1993) 3HV-yksiköitä sisältävien PHA:iden tuotantoa. Ulmer käytti R. rubrumin kasvualustana 4-penteenihappoa (PEA). Kun bakteeri asetettiin ”PHA:ta tuottaviin olosuhteisiin”, syntetisoitiin PHA:ta, joka sisälsi 3 toistuvaa alayksikköä (huomautus: R = substituenttiryhmä): HB (R = metyyli), HV (R = etyyli), HPE (R = vinyyli) (ks. kuva 1).
Funktionaalisten, biohajoavien muovien synteesi bakteerien avulla voi vähentää muovitehtaiden aiheuttamaa maailmanlaajuista saastumista ja polttoainekulutusta. R. rubrumia voidaan käyttää mikrobiologisena välineenä ympäristöystävällisten biopolymeerien tuottamiseen.
Uusiutuva energia
Kasvava huoli fossiilisten polttoaineiden polttamisesta aiheutuvasta ympäristön pilaantumisesta on lisännyt Rhodospirillum rubrumin tutkimusta. Käyttämällä R. rubrumia uusiutuvissa vetypolttoaineissa käytettävän vedyn lähteenä ratkaistaan useita fossiilisten polttoaineiden kulutuksen aiheuttamia ongelmia. Vety hapettuu vedeksi palamistuotteena, toisin kuin fossiiliset polttoaineet, jotka tuottavat epäpuhtauksia, kuten hiilidioksidia, hiilidioksidia, rikkidioksidia ja typen oksideja. R. rubrum voi tuottaa vetyä käyttämällä seuraavaa ”vesi-kaasunsiirtymäreaktiota” (Najafpour et al, 2004):
CO + H2O → H2 + CO2
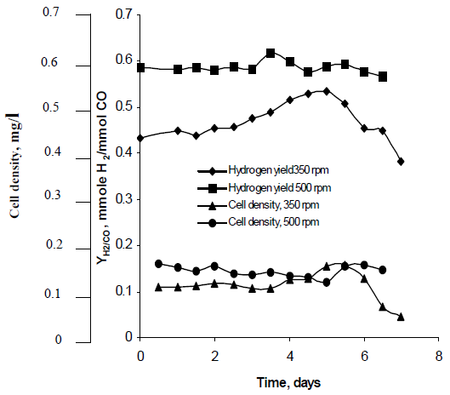
Najafpourin tutkimusmenetelmässä havainnoitiin, miten sekoitus, joka luotiin turbiinipyöräsarjoilla, jotka asetettiin nopeuksille 350 rpm sekä 500 rpm, vaikutti R. rubrumin vedyn tuotantonopeuksiin. Hänen tutkimuksessaan todettiin, että vetypolttoaineella voidaan hillitä ilmaston lämpenemistä ja tarjota ympäristöystävällinen teknologinen ratkaisu polttoaineen tuotantoon ja kulutukseen. Hänen tutkimuksensa osoitti, että ”korkeampi sekoitusnopeus tuotti enemmän vetyä sekä solutiheyttä” R. rubrumissa (ks. kuva 2).
Toisessa mikrobiologisessa tutkimuksessa, jonka suoritti Matthew Ross Melnicki, havaittiin, että R. rubrum tarjoaa potentiaalia uusiutuvalle energialle, kuten vetypolttoaineelle, vedyn synteesin kautta. Sen biologiset polut voivat tuottaa vetyä suurella nopeudella, kun sitä viljellään yhdessä Chlamydomonas reinhardtii -levälajin kanssa, jonka kanssa R. rubrum voi kasvaa harmonisesti. Melnicki ehdotti vetyä syntetisoivaa epätavanomaista yhteiskasvatusmenetelmää, joka tuotti tehostettua vetysynteesiä, jota ei ehkä saavuteta, jos yhteiskasvatus irrotetaan. C. reinhardtii suosi korkeampia valon intensiteettejä, kun taas R. ruburm oli tuottavampi alhaisemmilla valon intensiteeteillä, mikä korostaa niiden yhteiskasvatuksen etuja.
Käyttämällä syöttöerätekniikkaa R. rubrumin viljelyssä havaittiin, että istutetut viljelmät tuottivat vetyä eksponentiaalisen kasvuvaiheensa aikana, ja vedyn synteesi jatkui jatkuvasti 70 tuntia. Kun kasvu lakkasi, Melnicki lisäsi sukkinaattia, joka toimii elektroninluovuttajana aineenvaihduntareitillä, ja vedyn kehitys jatkui, vaikka bakteerit eivät enää kasvaneetkaan. On kuitenkin tärkeää huomata, että kun sukkinaattia lisättiin jatkuvasti, vedyn kehitysnopeus väheni. Kun kasvualustaa lisättiin lisää, vedyn tuotantonopeudet kasvoivat jälleen.
Melnicki totesi myös, että ”vaikka kasvua ei vaadita vedyntuotantoon, tämä työ osoittaa solujen kasvun välttämättömyyden maksimaalisten tuotantonopeuksien ylläpitämiseksi, mikä viittaa puolijatkuvan viljelystrategian teolliseen soveltuvuuteen” (Melnicki, 2009).
Cool Factor
Rhodospirillum rubrumin genomisekvenssi on vasta toinen Rhodospirillum-suvun jäsenistä, joka on julkaistu R. centenumin jälkeen (Munk et al, 2011).

Rhodospirillum rubrumin mielenkiintoinen piirre on sen kyky vaihtaa väriä eri olosuhteissa. Se on hapeton fototrofi, mutta ei tuota solunulkoista happea. Sen sijaan se tuottaa alkuainerikkiä valoa kerätessään. Tämä johtuu siitä, että R. rubrumilta puuttuu valonkorjuukompleksi 2 (Munk et al., 2011). Bakteeri käyttää bakteeriklorofylliä, minkä ansiosta se voi absorboida valon aallonpituuksia, joita kasvit eivät hyödynnä. Bakteeriklorofylli absorboi aallonpituuksia 800-925 nm.
Aerobisissa olosuhteissa R. rubrumin fotosynteettinen aktiivisuus estyy geneettisesti, ja bakteeri muuttuu värittömäksi. Anaerobisissa olosuhteissa fotosynteesi kuitenkin aktivoituu, ja bakteeri saa selvän purppuranpunaisen värin (ks. kuva 5). Tämä johtuu kalvossa olevien kromatofoorien aktiivisuudesta (Munk et al., 2011). Kromatofoorit sisältävät bakteerin bakteeriklorofyllipigmenttejä, ja niissä tapahtuu absorptiomuutoksia fotosynteesin aktivoituessa.
Benson, A. ”Chloroplast lipid metabolia.” In Symposium no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (Painossa.)
Benson, A., Wintermans, J. ja Wiser, R. ”Chloroplast lipids as carbohydrate reservoirs”. Plant Physiology. 1959. Volume 34. p. 815.
Bergey, D. ja Holt, J. Bergey’s manual of determinative bacteriology. Yhdeksäs painos. Baltimore. Lippincott Williams and Wilkins. 1994. s. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko ja J Parker. Biology of Microorganisms. 9. painos. Upper Saddle River: Prentice Hall, 2000. s. 459.
Chance, B. and Smith, L. ”Rhodospirillum rubrumin hengityspigmentit”. Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. ja Kunisawa, R. ”The Fine Structure of Rhodospirillum Rubrum .” Journal of Cell Biology. 1963. Volume 16. p. 401-419.
Hulcher, M. ja Conti, S. ”Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum.”. Biochemistry and Biophysics Research Communications. 1960. Volume 3. p. 497.
Kamen, M. ”The Haem Proteins of Photosynthetic Tissues”. In Symposium no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (In the Press.)
Keister, D. ja Minton, N. ”Energy-linked reactions in photosynthetic bacteria. 3. Lisätutkimuksia Rhodospirillum rubrumin kromatofoorien energiasidonnaisesta nikotiiniamidi-adeniinidinukleotidin pelkistymisestä”. Biochemistry. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. ”Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods”. COSPARin tieteellinen yleiskokous. 2010. s. 4.
Melnicki, M. R. ”Modes of hydrogen production in the photosynthetic bacterium, Rhodosphirillum rubrum”. University of California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. ”Complete genome sequence of Rhodospirillum rubrum type strain (S1T)”. Standards in Genomic Sciences. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. ”Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum”. African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. ja Newton, G. ”Composition of the photoactive subcellular particles from Chromatium”. Archives of Biochemistry and Biophysics. 1957. Volume 71. S. 250.
Oelze, J. ja Weaver, P. ”The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions.” (Rhodospirillum rubrumin fotosynteettisesti kasvaneiden solujen sopeutuminen aerobisiin valo-olosuhteisiin).” The Archives of Microbiology. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G. ja Schwartz, D. ”Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .” Applied and Environmental Microbiology. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., and Stanier, R. ”Studies on the macromolecular organization of microbial cells.” . The Archives of Biochemistry and Biophysics. 1952. Volume 38. p. 245-260.
Schön, G. ja Biedermann, M. ”Haihtuvien happojen synteesi fermentoimalla pyruvaattia ja fruktoosia Rhodospirillum rubrumin anaerobisissa pimeissä viljelmissä.” Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. ja Weaver, P. ”Fermentaatio ja anaerobinen hengitys Rhodospirillum rubrumin ja Rhodopseudomonas capsulate -bakteereilla.” The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C. ja Lenz, R. ”Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum”. Macromolecules. 1994. Volume 27. p. 1675-1679.
Weaver, P. ”Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum”. Proceedings of the National Academy of Sciences of the United States of America. 1971. Volume 68. S. 136-138.
Tohtori Iris Kerenin oppilaiden toimittama: Allison Almeida, Matthew Cozzolino, Trung Nguyen ja Jessica Wong.
NEUF2011
.