YHTEENVETO
Oikean kammion ulosvirtauskanavasta (RVOT) peräisin olevat ennenaikaiset kammiosupistukset esiintyvät yleensä potilailla, joilla ei ole rakenteellista sydänsairautta. Ne voivat esiintyä yksittäisinä tai jatkuvina PVC:nä tai takykardiana (jopa 80 % idiopaattisesta kammiotakykardiasta). Tärkein syymekanismi on laukeava aktiivisuus, mutta myös re-entry- tai epänormaalin automaattisuuden mekanismeja on pohdittu.
Potilailla esiintyy yleensä oireita, jotka liittyvät liikuntaan, stressiin tai nautintoaineiden käyttöön. Oireet voivat vaikuttaa elämänlaatuun, ja jatkuva VE-tyyppi voi johtaa takykardiomyopatiaan.
Betasalpaajilla tai verapamiililla on yleensä vain rajallinen teho tämäntyyppisen PVC:n hallinnassa. Radiotaajuusablaatio voi olla tehokas, mutta sitä haittaa se, että tämän PVC:n indusoitavuus on rajallinen ja arvaamaton. Perinteisistä läpivalaisuohjatuista menetelmistä voi olla vain rajoitetusti hyötyä, jos PVC:tä on vähän, koska aktivaatiokartoitus on monimutkaista ja stimulaatiokartoituksella on alhainen spatiaalinen resoluutio.
Kosketuksettomat kartoitusjärjestelmät (NCMS) ovat osoittautuneet hyödyllisiksi ektooppisten lyöntien paikantamisessa ja apuvälineeksi niiden ablaatiossa.1, 2 Tässä artikkelissa kuvaamme RVOT:n PVC:n ablaatiota Ensite Array NCMS:llä (St. Jude Medical, St. Paul, Minnesota, Yhdysvallat). Tässä järjestelmässä käytetään monielektrodikatetria (MAC), jossa on 7,5 ml:n ilmapallo ja 64 mikroelektrodia takykardian paikantamiseen. MAC tuottaa yli 3000 virtuaalista unipolaarista sähköohjelmaa samanaikaisesti yhdestä lyönnistä ja näyttää ne kolmiulotteisena kuvana kiinnostuksen kohteena olevasta kammiosta.
MENETELMÄT Potilaan ominaisuudet
Neljälle potilaalle, joilla ei ollut rakenteellista sydänsairautta mutta joilla oli jatkuva oireinen RVOT:n PVC, tehtiin ablaatio NCMS:n avulla tammikuun 2006 ja joulukuun 2009 välisenä aikana. Potilaiden keski-ikä oli 43±6 vuotta, ja 50 % heistä oli miehiä.
Kaikkien elämänlaatu oli huono erittäin oireisen ja usein esiintyvän PVC:n vuoksi (keskimäärin 30 763±4710 PVC/vrk). He kaikki olivat epäonnistuneet vähintään kahden rytmihäiriölääkkeen käytössä, joista yksi oli aina beetasalpaaja. Ablaatiota oli kokeiltu aiemmin kahdella potilaalla tavanomaisella järjestelmällä, mutta tuloksetta.
Kaikilla potilailla ekstrasystolinen aktiivisuus oli vähäistä toimenpidepäivänä. Rytmihäiriölääkkeet lopetettiin vähintään viisi puoliintumisaikaa ennen toimenpidettä, ja sedaatiota vältettiin.
Elektrofysiologinen tutkimus
Oikeaan kammioon (RV) asetettiin 4 mm:n ablaatiokatetri (Livewire TC, St. Jude Medical). Jos isoproterenolin infuusion ja kammiotahdistuksen jälkeen ei ollut mahdollista saavuttaa riittävää PVC:tä aktivaatiokartoituksen suorittamiseksi, MAC otettiin käyttöön.
MAC työnnettiin eteenpäin 0,035″:n ohjainlangalla läpivalaisun avulla, ja pallo asetettiin RVOT:iin 2-3 cm:n etäisyydelle keuhkoläpästä. Antikoagulaatio hepariinilla aloitettiin tässä vaiheessa. Tämän jälkeen RV:n anatomia rekonstruoitiin, ja erityistä huomiota kiinnitettiin RVOT:hen ja keuhkovaltimoläpän tilanteeseen (kuva 1). Etäisyys
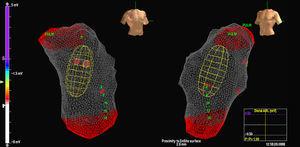
Kuva 1. Kuva oikean kammion ulosvirtauskanavassa olevasta monielektrodiryhmäkatetrista.
Sen jälkeen analysoitiin 3 ekstrasystolista lyöntiä jokaisesta potilaan esittämästä PVC-morfologiasta ja saatiin offline-tilassa isopotentiaali- ja isokronikartat. Bipolaarisiin sähköohjelmiin käytettiin 30-500 Hz:n suodattimia ja virtuaalisiin unipolaarisiin sähköohjelmiin 2 Hz:n korkeapäästösuodatinta.
Isopotentiaalikartta kuvaa dynaamisesti aktivaatiota käyttämällä suurimman jänniteamplitudin alueita ja osoittaa, miten aaltorintama kulkee. Varhaisin aktivaatiopiste määritellään pisteeksi, joka osoittaa varhaisinta aktivaatiota QRS:n alkamiseen nähden, ja siinä näkyy QS-morfologia, jossa on nopea negatiivinen poikkeama unipolaarisessa sähköohjelmassa. Isopotentiaalikartta tunnistaa myös aaltorintaman alkupisteen ennen kuin se leviää muuhun sydänlihakseen. Isokronikartta on perinteinen endokardiaalisen pinnan aktivoitumisaikakartta, ja siinä käytetään virtuaalista unipolaarista signaalia.
Ablaatiokohteena oli sekä varhaisimman aktivaation alue että aktivaatiorintaman alkupiste. Radiotaajuutta käytettiin satunnaisesti näissä kohdissa, ja lämpötilan säätö rajoitettiin 50 W:iin, lämpötila alle 55 °C:een ja kesto 60 sekuntia. Ablaatio katsottiin onnistuneeksi, jos PVC hävisi annostelun aikana eikä sitä indusoitu uudelleen.
Kaikki toimenpiteet suoritti sama elektrofysiologi, joka ohjasi NCMS:ää käyttävää insinööriä.
TULOKSET
Kolme potilasta sai yhden PVC-morfologian, kun taas yhdellä potilaalla oli kaksi morfologiaa. Kolmessa tapauksessa sijainti oli septumissa, kun taas kahdessa muussa tapauksessa se oli RVOT:n vapaassa seinämässä. Kaikissa tapauksissa isopotentiaalikartta (kuva 2) paikallisti alkuperän tarkimmin; isokronikartalla oli suhteellisen vähän arvoa (kuva 3).
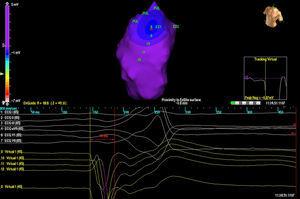
Kuva 2. Isopotentiaalikartta. Isopotentiaalikartta potilaalla, jolla oli 2 erilaista oikean kammion ulosvirtauskanavasta peräisin olevaa kammioekstrasystolia. Kutakin ulostuloa edustavat kirjaimet EX (1 ja 2). Varhaisin aktivoitumispiste on esitetty EX1:ssä ja QS:n kuva virtuaalisessa unipolarissa (alla).
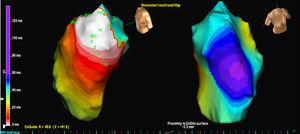
Kuva 3. EX1-ulostulon isokronikartta samoille kammioekstrasystoleille, jotka analysoitiin kuvassa 1 . Valkoinen väri osoittaa varhaisimman aktivoitumisen ja violetti väri osoittaa myöhäisimmän aktivoitumisen.
Varmensimme myös kaikissa tapauksissa, että PVC ei ollut aiheutunut mekaanisesti ja että se oli yhtenevä kliinisen PVC:n morfologian kanssa. Yhdellä potilaalla pallo oli hyvin lähellä endokardiaalista pintaa, josta PVC sai alkunsa, ja sitä jouduttiin sijoittamaan uudelleen, jotta ablaatioelektrokatetri saatiin mobilisoitua riittävästi.
Sen jälkeen, kun oli tunnistettu alkukohta, käytettiin keskimäärin kolmea radiotaajuussovellusta fokusta kohti ablaatiossa sekä varhaisimman aktivaation pisteessä että aktivaatiorintaman alkupisteessä. Keskimääräinen applikaatioaika oli 113 ± 15 sekuntia kutakin fokusta kohti. Ektooppisen aktiivisuuden lisääntymisen havaittiin edeltävän sovelluksen lopettamista.
Keskimääräinen läpivalaisuaika oli 31±11 (21-46) min ja toimenpiteen kokonaiskesto 136±38min, joskin se väheni oppimiskäyrän myötä ensimmäisen toimenpiteen 190min:stä neljännen toimenpiteen 100min:iin.
Saavutimme 100-prosenttisen akuutin onnistumisprosentin, jossa ei esiintynyt komplikaatioita eikä PVC:tä ilmaantunut uudestaan isoproterenoli-infuusiolla tai stimulaatioprotokollan toistamisella. Keskimäärin 30±16 kuukauden kuluttua potilaat pysyivät oireettomina ilman lääkehoitoa, ja Holter-seurannassa yhden vuoden seurantakäynnillä PVC:n keskimääräinen määrä oli 159±113/vrk.
KESKUSTELU
Vaikka muut kirjoittajat ovat osoittaneet NCMS:n käyttökelpoisuuden RVOT:n PVC:n ablaatoinnissa,2, 3 sen käyttö ei ole laajalle levinnyttä.4 Kokemuksessamme saavutettiin erinomaisia tuloksia heti ensimmäisistä tapauksista lähtien. RVOT-kammiotakykardian ablaatiossa raportoidaan yleensä yli 80 %:n onnistumisprosentteja5; me saavutimme kuitenkin korkeamman onnistumisprosentin, vaikka pystyimme kartoittamaan vain eristetyn PVC:n. Akuutti päätepisteemme oli PVC:n häviäminen, ja sitä rajoitti PVC:n alhainen esiintymistiheys toimenpiteen aikana. Tämän vuoksi oli tarpeen varmistaa ablaation tehokkuus seurannan aikana vähentämällä PVC:n taajuutta Holter-seurannassa.
Potilaidemme rytmihäiriöllä oli fokaalinen alkulähde, mikä on yhdenmukaista muiden kirjoittajien havaintojen kanssa.2, 6 Ablaatio rajattiin varhaisimpaan aktivaatiokohtaan, mikä saattoi osaltaan vaikuttaa korkeaan onnistumisprosenttiin.
NCMS-menetelmällä tarvittiin vain yksi lyönti, jotta PVC:n alkulähde voitiin paikantaa tarkasti. Vaikka halusimme mieluummin varmistaa sijainnin kartoittamalla muita, identtisiä PVC:tä, alkuperäkohtaa ei muutettu. Kokemuksemme mukaan onnistunut ablaatio saavutettiin pelkästään isopotentiaalikartan perusteella.
Yksi järjestelmän rajoituksista on se, että se paikantaa varhaisimman aktivaatiopisteen tutkittavan kammion endokardiumiin, vaikka piste ei sijaitsisikaan endokardiumissa vaan epikardiumissa tai toisessa, liitetyssä kammiossa. Näissä tapauksissa virtuaalinen unipolaarinen analyysi auttaa osoittamaan, että alkupiste ei ole RV:n endokardiumissa, koska siinä tapauksessa varhaisin endokardiaalinen piste esittäisi rS:n.
Lisäksi MAC voi tuottaa mekaanista PVC:tä, ja koska se sijaitsee RVOT:ssä, se voidaan sekoittaa kliiniseen PVC:hen. Eron tekemiseksi analysoimme elektrokardiografisen vastaavuuden kliinisen PVC:n kanssa ja vahvistimme, että PVC:n alkupiste ei ollut kosketuksissa palloon.
PVC voi myös saada alkunsa hyvin läheltä paikkaa, jossa MAC sijaitsee, mikä vaikeuttaa pääsyä ablaatiokatetrille. Tällaisissa tapauksissa voi olla tarpeen sijoittaa pallo uudelleen.
Sarjassamme NCMS osoittautui tehokkaaksi ja turvalliseksi keinoksi poistaa eristetty, vaikeasti indusoituva RVOT:n PVC ja auttoi vähentämään toimenpiteiden monimutkaisuutta.
Eturistiriidat
Ei ilmoitettu.
Kiitokset
Haluamme kiittää Joaquín Panduroa käsikirjoituksen kriittisestä läpikäynnistä.
Vastaanotettu 21.1.2011
Accepted 1.5.2011