J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817.
Tutkimusjulkaisu
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Säteilyonkologian osasto, Teksasin yliopiston MD Andersonin syöpäkeskus, Houston, TX.
2. Biostatistiikan osasto, Teksasin yliopiston MD Andersonin syöpäkeskus, Houston, TX.
3. Kirurgisen onkologian osasto, Teksasin yliopiston MD Andersonin syöpäkeskus, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Metaplastisten ja muiden rintasyövän alatyyppien hoidon jälkeiset tulokset. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Saatavissa osoitteesta https://www.jcancer.org/v11p1341.htm
Tarkoitus: Metaplastinen rintasyöpä (metaplastic breast cancer, BC) on harvinainen mutta aggressiivinen histologinen BC:n alatyyppi. Pyrimme tunnistamaan sen diagnoosiin liittyviä tekijöitä ja vertailemaan metaplastisen BC:n hoitoa ja hoitotuloksia muiden BC:iden ja erityisesti kolmoisnegatiivisen invasiivisen duktaalikarsinooman hoitotuloksiin ja hoitotuloksiin, kun otetaan huomioon, kuinka usein metaplastisella BC:llä on kolmoisnegatiivinen fenotyyppi.
Potilaat ja menetelmät: Tunnistimme naiset, joilla oli diagnosoitu invasiivinen BC vuosina 2010-2014 kansallisessa syöpätietokannassa, ja käytimme univariaattista analyysia vertaillaksemme potilaan ja kasvaimen perusominaisuuksia BC:n alatyypin mukaan. Kokonaiselossaoloaika (OS) arvioitiin Kaplan-Meierin menetelmällä, ja monimuuttujaisia Coxin proportional hazards -malleja käytettiin OS:n riippumattomien ennustetekijöiden tunnistamiseksi.
Tulokset: 247 355 tapauksesta 2084 (0,8 %) oli metaplastista BC:tä, 55 998 (23 %) kolmoisnegatiivista BC:tä ja 77 % muuta BC:tä. Suhteessa ei-metaplastiseen BC:hen metaplastista BC:tä sairastavilla naisilla oli suurempi todennäköisyys olla diagnoosihetkellä iäkkäämpiä (mediaani-ikä 62 vs. 59 vuotta), heillä oli ≥ 1 liitännäissairaus (22 % vs. 18 %) ja he olivat Medicare-järjestelmän piirissä (41 % vs. 33 %; P<0,001). Metaplastiset BC:t olivat yleensä tyvitumakkeita (77 %), ja suhteessa kolmoisnegatiiviseen tai muuhun BC:hen metaplastiset BC:t liittyivät korkeampaan kliiniseen T-statukseen (cT3-4, 18 % vs. 11 %, 8 %), siihen, että kliinisiä solmukkeita ei ollut mukana (cN0, 86 %, 77 %, 80 %), siihen, että lymfovaskulaarista invaasiota ei esiintynyt (72 %, 65 %, 62 %), ja siihen, että kyseessä oli korkea-asteinen kasvain (71 %, 77 %, 35 %) (P<0,001). Useimmat metaplastiset BC:t hoidettiin mastektomialla (58 %), vartijaimusolmukkeiden poistolla (65 %), rintakehän seinämän tai rintojen säteilytyksellä (74 %) ja kemoterapialla (75 %) liitännäishoitona (60 %). Mediaaniseuranta-aikana, joka oli 44,5 kuukautta, metaplastisen BC:n elossaololuvut olivat alhaisemmat kuin kolmoisnegatiivisen tai muun BC:n kaikissa kliinisissä vaiheissa viiden vuoden kuluttua (vaihe I, 85 %, 87 %, 91 %; II, 73 %, 77 %, 87 %; III, 43 %, 53 %, 75 %) ja kolmen vuoden kuluttua (vaihe IV, 15 %, 22 %, 64 %; P<0,001). Monimuuttuja-analyysissä lisääntyvä ikä, pitkälle edennyt kliininen vaihe, lymfovaskulaarinen invaasio, kainalosolmukkeiden (vs. vartijasolmukkeiden) poisto ja säteilyn tai solunsalpaajahoidon puuttuminen liittyivät huonompaan lopputulokseen metaplastisessa BC:ssä. Leikkauksen laajuus vaikutti eloonjäämiseen kolmoisnegatiivisessa ja muussa BC:ssä mutta ei metaplastisessa BC:ssä.
Johtopäätös: Metaplastisen BC:n tulokset ovat edelleen huonommat kuin muiden BC:n alatyyppien tulokset nykyaikaisista hoidoista huolimatta. Systeemisten hoitovaihtoehtojen optimoinnin, joka oli merkittävä eloonjäämisen ennustaja, tulisi olla ensisijainen tavoite metaplastisen BC:n hoidossa.
Avainsanat: metaplastinen rintasyöpä, kolmoisnegatiivinen rintasyöpä, rintasyövän tulokset, sädehoito, kemoterapia.
Esittely
Vaikka rintasyöpä on yleisin naisiin vaikuttava syöpädiagnoosi, sillä vuosittain dokumentoidaan yli 268 000 tapausta, metaplastinen rintasyöpä (BC) muodostaa alle 1-2 % kaikista rintasyöpätapauksista. Kliinisesti metaplastinen rintasyöpä ilmenee nopeasti kasvavana rintamassana, jolla on monitahoinen kaikukuvaus (ts. kiinteät ja kystiset osat) ultraäänitutkimuksessa ja tiheä massa mammografiassa. Histologisesti metaplastinen BC koostuu heterogeenisesta kasvainpopulaatiosta, joka voidaan luokitella muiden kuin rauhasperäisten tai mesenkymaalisten solutyyppien esiintymisen perusteella tai luokitella edelleen alatyyppeihin riippuen erilaisten piirteiden, kuten osteoklastisten jättiläissolujen tai karasolujen, esiintymisestä.
Esiintymishetkellä kliinisten imusolmukkeiden osallistumisaste metaplastisessa BC:ssä on tyypillisesti alhainen. Metaplastinen BC diagnosoidaan kuitenkin useammin pitkälle edenneissä kliinisissä vaiheissa, koska primaarikasvaimet ovat suurempia kuin muissa BC-taudeissa, ja siihen liittyy korkeampi solunsalpaajaresistenssi, etämetastaasit ja huonompi kokonaiselossaoloaika (OS). Metaplastisessa BC:ssä esiintyy erityisen usein kolmoisnegatiivista reseptoristatusta eli estrogeenireseptorin, progesteronireseptorin ja ihmisen epidermaalisen kasvutekijän reseptorin 2 (HER2) monistumisen puuttumista. Ilman kohdeproteiineja metaplastisen BC:n hoito on edelleen haastavaa. Metaplastisen BC:n parhaan hoidon valitsemiseksi on vain vähän prospektiivista tietoa, koska diagnoosi on harvinainen. Sen sijaan suuri osa metaplastisen BC:n nykyisistä hoitokäytännöistä on ekstrapoloitu pienten yksittäisten laitosten hoitosarjojen tai tapausraporttien perusteella. Tämän vuoksi käytimme kansallista syöpätietokantaa (National Cancer Data Base, NCDB), joka kattaa noin 70 prosenttia kaikista Yhdysvalloissa diagnosoiduista syöpätapauksista, arvioidaksemme metaplastista BC:tä sairastavien potilaiden ominaispiirteitä, hoitoa ja hoitotuloksia hoidon ja kasvaimen ominaisuuksien perusteella verrattuna potilaisiin, joilla oli kolmoisnegatiivinen BC ja kaikki muut BC:n alatyypit. Käytimme myös monimuuttuja-analyysiä metaplastista BC:tä sairastavien naisten eloonjäämisen riippumattomien ennustetekijöiden tunnistamiseksi.
Tietojen lähde ja kohortin valinta
Amerikkalaisen kirurgikollegion syöpäkomitean (Commission on Cancer of the American College of Surgeons) ja amerikkalaisen syöpäyhdistyksen (American Cancer Society) vuonna 1989 perustama yhteishanke NCDB on kerännyt onkologisia tietoja noin 1 500:lta akkreditoidulta laitokselta Yhdysvalloissa, ja se on sisältänyt kaikkiaan yli 34 miljoonaa tietoa. Käytettävissä olevat potilastiedot ovat tunnistamattomia, joten ne on vapautettu institutionaalisen arviointilautakunnan suorittamasta ihmissuojeluvalvonnasta.
Tässä tutkimuksessa käytetyt valintakriteerit on esitetty kuvassa 1. Mukaan otettiin 18-vuotiaat ja sitä vanhemmat naiset, joilla oli diagnosoitu invasiivinen rintasyöpä vuosina 2010-2014. Potilaat, joilla oli tuntematon hormonireseptorin (estrogeeni ja progesteroni) status (HR), jätettiin pois. Muita syitä poissulkemiseen olivat puuttuvat tiedot leikkauksesta, kemoterapiasta tai American Joint Committee On Cancer (AJCC) 6. tai 7. painoksen mukaisesta kliinisestä vaiheistuksesta. Tämän jälkeen potilaat jaettiin kolmeen ryhmään: 1-metaplastinen BC (histologiakoodit 8575 tai 8573), 2- kolmoisnegatiivinen BC (TNBC, johon kuuluivat vain ei-metaplastiset histologiat) ja 3- kaikki muut jäljellä olevat BC-tyypit. Termiä ”ei-metaplastinen BC” käytettiin viittaamaan kolmoisnegatiiviseen BC:hen ja muuhun BC:hen yhdessä.
CONSORT-kaavio. BC, rintasyöpä.
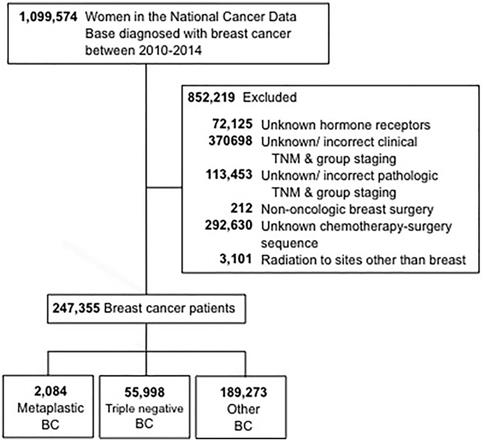 (Klikkaa kuvaa suurentaaksesi.)
(Klikkaa kuvaa suurentaaksesi.)
Muuttujat
NCDB:stä saadut ja analysoidut tiedot sisälsivät potilaan iän diagnoosin tekohetkellä, diagnoosivuoden, rodun, Charlsonin/Deyon komorbiditeetti-indeksin, sairausvakuutustilanteen, kotitalouden mediaanitulon ja hoitavan laitoksen tyypin (jaoteltu akateemiseen/tutkimukselliseen vs. muuhun kuin akateemiseen laitokseen). Kliinipatologisiin ominaisuuksiin kuuluivat AJCC:n kliininen T- ja N-luokitus (nodaalinen), yleinen AJCC:n kliininen vaiheryhmä, HR-status, HER2-reseptoristatus, kasvaimen aste ja lymfovaskulaarinen invaasio (LVSI). Molekulaariset alatyypit määriteltiin seuraavasti: HR(+)/HER2(-), HER2(+), kolmoisnegatiivinen (estrogeenireseptori(-), progesteronireseptori(-), HER2(-)) tai tuntematon. Potilaat, joilla oli metaplastinen BC ja kolmoisnegatiivinen reseptoristatus, nimettiin tn-metaplastiseksi BC:ksi, jotta heidät voitiin erottaa ei-metaplastisesta TNBC:stä. Ensisijaiseen hoitoon kuului leikkaus (joko rintaa säästävä leikkaus, mastektomia tai ei mitään), sädehoito, johon sisältyi tai ei sisältynyt alueellista solmukesäteilytystä, solunsalpaajahoito (neoadjuvantti, adjuvantti tai ei mitään) ja hormonihoito. Kainalon kirurginen hoito määriteltiin joko kainalosolmukkeiden poistoksi (ALND), kun poistettiin vähintään 10 imusolmuketta, tai vartijaimusolmukkeiden poistoksi (SLND), kun poistettiin <10 imusolmuketta.
Statistinen analyysi
Univariaattianalyysia käytettiin demografisten, kasvaimen ja kliinisten ominaisuuksien ja metaplastisen BC:n diagnoosin välisten mahdollisten yhteyksien arvioimiseksi käyttäen kategoristen muuttujien osalta khiin neliö -testejä ja jatkuvien muuttujien osalta t-testiä/ varianssianalyysiä tai niiden vastineita ei-parametrisista lähestymistavoista (Wilcoxonin rank-summatestiä tai Kruskal-Wallisin testiä/analyysiä). Elinikäinen käyttöikä määriteltiin diagnoosin tekohetkestä kuolinhetkeen. Eloonjääneiden potilaiden OS-aika sensuroitiin oikealle viimeisen yhteydenoton yhteydessä. OS-ajan jakauma arvioitiin Kaplan-Meierin menetelmällä. Log-rank-testiä käytettiin ryhmien välisen eloonjäämisajan eron testaamiseen. OS:lle tehtiin Coxin suhteelliseen vaaramalliin perustuvia eloonjäämisdatan regressioanalyysejä. Monimuuttujainen Coxin suhteellisten vaarojen malli saatiin sisällyttämällä siihen ensin alustava joukko ehdollisia ennustemuuttujia, joiden P-arvo oli < 0,05 yksimuuttuja-analyysissä. Tämän jälkeen käytettiin vaiheittaista taaksepäin eliminointia, jossa Waldin khiin neliön merkitsevyystasona käytettiin 0,05, jotta vaikutus pysyisi mallissa.
Eloonjäämisanalyysit tehtiin kunkin syöpätyypin osalta erikseen.
Laitoksen sijaintia ja tyyppiä ei otettu mukaan metaplastisen BC:n mallin valintaan, koska kumpikaan tekijä ei ollut tilastollisesti merkitsevä tälle ryhmälle yksimuuttujaisessa tarkastelussa ja koska tietoja ei ollut täysin saatavilla alle 40-vuotiaista potilaista. Selvittääksemme, vaikuttivatko systeemisen hoidon ja sädehoidon yksityiskohdat metaplastista BC:tä sairastavien potilaiden hoitotuloksiin, teimme tälle kohortille osajoukkoanalyysejä arvioidaksemme solunsalpaajahoidon sekvensoinnin ja sädehoitokohteiden laajuuden mahdollista vaikutusta käyttöikään. Kaikki testit olivat kaksimielisiä, ja tilastollinen merkitsevyys määriteltiin P-arvoksi <0,05. SAS-versio 9.4 (SAS Institute, Cary, NC) ja S-Plus-versio 8.2 (TIBCO Software Inc., Palo Alto, CA) käytettiin kaikkien analyysien laskutoimituksiin.
Kohortin ja kasvaimen ominaisuudet
Tunnistimme 247 355 naista, joilla oli diagnosoitu invasiivinen rintasyöpä vuosina 2010-2014, ja heistä 0,8 %:lla (n=2 084) oli metaplastinen rintasyöpä (BC), 23 %:lla (n=55 998) TNBC (TNBC, TNBC) ja 77 %:lla (n=189 273) muu BC. Potilaiden sosiodemografiset, kliiniset ja patologiset kasvaimen ominaisuudet sekä hoidon ominaisuudet BC-tyypin mukaan on esitetty taulukossa 1. Metaplastista BC:tä sairastavien naisten mediaani-ikä oli 63 vuotta (vaihteluväli 22-90) ja TNBC:tä ja muuta BC:tä sairastavien naisten 59 vuotta (vaihteluväli 18-90). Metaplastista BC:tä sairastavilla naisilla oli useammin liitännäissairauspistemäärä ≥ 1 (22 % vs. 18 % TNBC vs. 16 % muu BC) ja heillä oli julkinen vakuutus (50 % vs. 42 % TNBC vs. 41 % muu BC) (kaikki P<0,001). Metaplastisen BC:n tai TNBC:n diagnoosi liittyi useammin mustaihoiseen rotuun kuin muuhun BC:hen (18 % vs. 21 % vs. 11 %, P<0,001).
Syöpätyypeittäin havaittiin merkittäviä eroja taudin kliinisessä vaiheessa ja kasvaimen ominaisuuksissa. Metaplastinen BC diagnosoitiin usein pidemmälle edenneissä tautivaiheissa, sillä vain 31 %:lla metaplastista BC:tä sairastavista potilaista oli kliininen tautivaihe I verrattuna 46 %:iin TNBC:tä sairastavista ja 54 %:iin muuta BC:tä sairastavista (P<0,001). Tämä kuvio näytti korreloivan suurempien kasvainten korkeampaan määrään metaplastisen BC:n ryhmässä (cT3-4, 18 % vs. 11 % vs. 8 %), mutta kliinisten solmukkeiden esiintyminen oli vähäisintä metaplastisen BC:n ryhmässä (cN1-3, 14 % vs. 23 % vs. 20 %) (kaikki P<0,001). Toisin kuin kliinisen solmukohdan status, patologinen solmukohdan osallistuminen oli hieman vähäisempää metaplastisessa BC:ssä ja TNBC:ssä, mutta kaksinkertaista muussa BC:ssä (pN1-3, 18 % vs. 26 % vs. 40 %, vastaavasti, P<0,001). Reseptoristatuksen osalta 77 %:lla metaplastisen BC:n ryhmästä oli tn-metaplastista BC:tä, mikä on 3,4 kertaa enemmän kuin ei-metaplastisen BC:n ryhmässä (23 %), josta HR(+)/HER2(-) oli yleisin molekulaarinen alatyyppi 59 %:lla (P<0,001). Lisäksi vain 5 % metaplastisesta BC:stä oli HER2(+) verrattuna 16 %:iin ei-metaplastisesta BC:stä. Sekä metaplastisessa BC:ssä että TNBC:ssä oli lähes kaksi kertaa enemmän 3. asteen kasvaimia kuin muussa BC:ssä (71 %, 77 % ja 35 %, P<0,001), ja metaplastisessa BC:ssä oli vähemmän LVSI:tä kuin TNBC:ssä ja muussa BC:ssä (13 %, 20 % ja 24 %, P<0,001).
Potilaan ja hoidon ominaispiirteet.
| Ominaisuus | Metaplastinen BC, lkm (%) | Trippelinegatiivinen BC, lkm (%) | Muu BC, lkm. (%) | P Value | ||||
|---|---|---|---|---|---|---|---|---|
| Keski-ikä, vuotta (vaihteluväli) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | ||||
| Rotu | ||||||||
| Valkoinen | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | ||||
| Musta | 368 (17.7) | 11771 (21) | 20722 (10.9) | |||||
| Muu | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |||||
| Tuntematon | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |||||
| Komorbiditeettipisteet | ||||||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | ||||
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |||||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |||||
| Keskitulo | ||||||||
| <30 000$ | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | ||||
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |||||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |||||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |||||
| Tuntematon | 63 (3) | 1673 (3) | 6165 (3.3) | |||||
| Sairausvakuutus | ||||||||
| Yksityinen | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.4) | 18355 (32.8) | 61535 (32.5) | ||
| Muut | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |||||
| Vakuutukseton | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |||||
| Tuntematon | 31 (1.5) | 577 (1) | 2257 (1.2) | |||||
| Maakuntatyyppi | ||||||||
| Pääkaupunkiseutu | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0.152 | ||||
| Urbaani | 271 (13) | 7456 (13.3) | 24367 (12.9) | |||||
| Maaseutu | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |||||
| Tuntematon | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |||||
| Tilaustyyppi | ||||||||
| Opiskelijatyöllinen | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | ||||
| Muu kuin akateeminen | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |||||
| Tuntematon | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||||
| Tilojen sijainti | ||||||||
| Keskilänsi | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | ||||
| Koillinen | 410 (19.7) | 10411 (18.6) | 37787 (20) | |||||
| Etelä | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |||||
| Länsi | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |||||
| Tuntematon | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||||
| Kliininen taudin vaihe | ||||||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | ||||
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |||||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |||||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |||||
| Kliininen T-status | ||||||||
| cT0 | 5 (0.2) | 131 (0.2) | 341 (0.2) | <0.001 | ||||
| cT1 | 674 (32.3) | 28452 (50.8) | 113113113 (59.8) | |||||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |||||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |||||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (5.2.4) | |||||
| Kliininen N-status | ||||||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | ||||
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |||||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |||||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |||||
| Patologinen vaihe | ||||||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | ||||
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |||||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |||||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |||||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |||||
| Patologinen T-status | ||||||||
| pTis | 7 (0.3) | 432 (0.8) | 1862 (1) | <0.001 | ||||
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |||||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |||||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |||||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |||||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |||||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |||||
| Patologinen N-status | ||||||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | ||||
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |||||
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |||||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |||||
| Reseptorien ryhmittely | ||||||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | ||||
| Kolmoisnegatiivinen | 1604 (77) | 55998 (100) | 0 (0) | |||||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |||||
| Tuntematon | 49 (2.4) | 0 (0) | 6860 (3.6) | |||||
| Tuumorin aste | ||||||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | ||||
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |||||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |||||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |||||
| Tuntematon | 284 (13.6) | 303030 (5.4) | 11186 (5.9) | |||||
| LVSI | ||||||||
| Ei esiintynyt | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | ||||
| Läsnä | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |||||
| Tuntematon | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |||||
| leikkaustyyppi | ||||||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | ||||
| Mastektomia | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |||||
| Ei leikkausta | 8 (0.4) | 295 (0.5) | 1341 (0.7) | |||||
| Suolileikkaus | ||||||||
| Ei leikkausta | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | ||||
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |||||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |||||
| Tuntematon | 18 (0.9) | 855 (1.5) | 1941 (1) | |||||
| Sädehoito | ||||||||
| Kyllä | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | ||||
| Ei | 989 (47.5) | 21860 (39) | 79375 (41.9) | |||||
| Tuntematon | 8 (0.4) | 200 (0.4) | 630 (0.3) | |||||
| Säteilykohteet | ||||||||
| Ainoastaan rinta/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | ||||
| Rinta/CW + Alueelliset solmut | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |||||
| Kemoterapia | ||||||||
| Kyllä | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | ||||
| Ei | 499 (23.9) | 11195 (20) | 53062 (28) | |||||
| Tuntematon | 14 (0.7) | 482 (0.9) | 2246 (1.2) | |||||
| Kemoterapia-leikkaus-sekvenssi | ||||||||
| Adjuvantti | 1241 (59.5) | 31519 (56.3) | 116645 (61.6) | <0.001 | ||||
| Neoadjuvantti | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | |||||
| Ei mitään | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |||||
| Hormonihoito | ||||||||
| Kyllä | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | ||||
| Ei | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |||||
| Tuntematon | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |||||
| Diagnoosivuosi | ||||||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | ||||
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |||||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |||||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |||||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Lyhenteet:
Hoito rintasyövän tyypin mukaan
Useimmille potilaille (99 %) tehtiin onkologinen rintaleikkaus, mukaan lukien kainalon kirurginen arviointi (97 %). Mastektomiaa käytettiin yleisemmin metaplastisen BC:n ryhmässä (58 % vs. 47 % TNBC vs. 51 % muu BC, P<0,001), samoin kuin SLND:tä (65 % vs. 62 % TNBC vs. 58 % muu BC; P<0,001). Alueellista solmukesäteilytystä käytettiin useammin osana muun BC:n kuin metaplastisen BC:n ja TNBC:n hoitoa (26 %, 27 % ja 34 %; P<0,001).
Systeemisen hoidon osalta neoadjuvantti-sytostaattihoitoa käytettiin lähes kaksi kertaa useammin metaplastisessa BC:ssä ja TNBC:ssä kuin muussa BC:ssä (16 %, 23 % ja 9 %; P<0,001), ja noin neljäsosa kaikista naisista ei saanut minkäänlaista sytostaattihoitoa. Hormonihoitoa käytettiin vähiten TNBC-tapauksissa (2 %), mutta se oli osa hoitoparadigmaa 11 %:lla metaplastisesta BC:stä ja 55 %:lla muusta BC:stä.
Eloonjäämisanalyysi
Seuranta-ajan mediaani oli 44,5 kuukautta. Metaplastista BC:tä sairastavilla potilailla oli kliinisestä vaiheesta riippumatta huomattavasti huonompi sopeuttamaton OS (kuva 2). Metaplastista BC:tä, TNBC:tä ja muuta BC:tä sairastavien potilaiden, joilla oli taudin I-vaihe, viiden vuoden OS-arviot olivat 85 %, 87 % ja 91 %; II-vaiheen potilaiden arviot olivat 73 %, 77 % ja 87 %; ja III-vaiheen potilaiden arviot olivat 43 %, 53 % ja 75 % (P<0,001). Metastasoitunutta tautia sairastavien potilaiden kolmen vuoden elossaololuvut olivat 2-4 kertaa korkeammat TNBC- ja muiden BC-ryhmien osalta, 30 % ja 64 %, verrattuna 15 %:iin metaplastisen BC:n osalta (P<0,001). Eloonjäämistä analysoitiin myös molekulaarisen alatyypin mukaan (kuva 3). Metaplastista BC:tä sairastavien potilaiden OS:ssä ei ollut havaittavissa eroja molekulaarisen alatyypin (HR(+)/HER2(-), HER2(+) tai tn-metaplastisen BC:n) mukaan (P=0,778). Sitä vastoin ei-metaplastisen BC:n osalta kolmoisnegatiiviseen alatyyppiin liittyi huonompi OS kuin HER+- ja HR(+)/HER2(-) alatyyppeihin (P<0,001). Rotu ei myöskään näyttänyt olevan yhteydessä eloonjäämiseen metaplastista BC:tä sairastavilla potilailla (5 vuoden OS-arvot 73 % valkoisilla vs. 74 % mustilla, P=0,876), kun taas rotu oli yhteydessä eloonjäämiseen sekä TNBC- (P<0,001) että muissa BC-ryhmissä (P<0,001; kuvio 4).
Rintasyövän tyypin kokonaiseloonjäämiskäyrät kliinisen vaiheen mukaan, kun tarkastellaan metaplastista, triplanegatiivista ja muuta rintasyöpää. Lyhenteet: MBC, metaplastinen rintasyöpä.
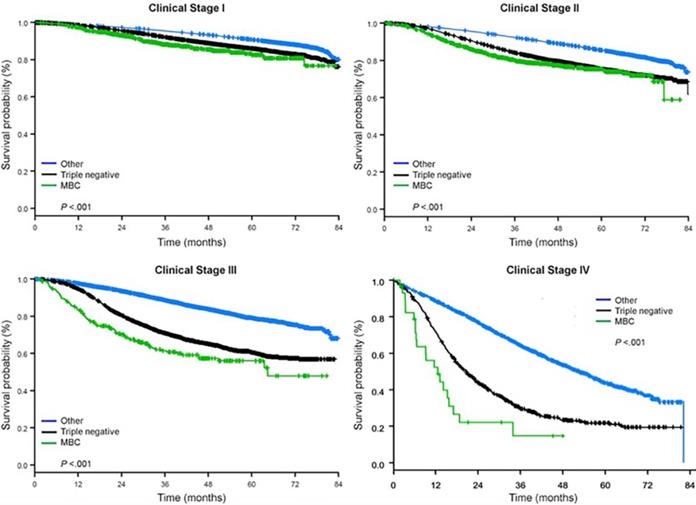 (Klikkaa kuvaa suurentaaksesi.)
(Klikkaa kuvaa suurentaaksesi.)
Kokonaiseloonjäämiskäyrät metaplastista ja ei-metaplastista rintasyöpää sairastavilla potilailla reseptoristatuksen mukaan jaoteltuna. Lyhenteet: HER2, ihmisen epidermisen kasvutekijän reseptori 2; HR, hormonireseptori; MBC, metaplastinen rintasyöpä.
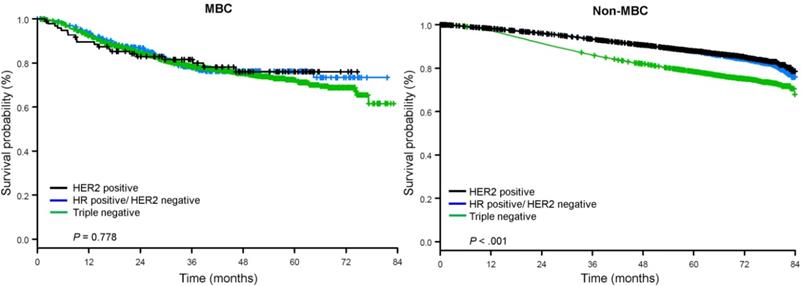 (Klikkaa kuvaa suurentaaksesi.)
(Klikkaa kuvaa suurentaaksesi.)
Kokonaiseloonjäämiskäyrät metaplastista, kolmoisnegatiivista ja muuta rintasyöpää sairastaville potilaille rodun mukaan jaoteltuna. Lyhenteet:
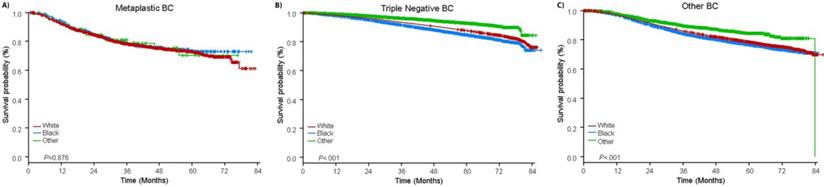 (Klikkaa kuvaa suurentaaksesi.)
(Klikkaa kuvaa suurentaaksesi.)
Multimuuttuja-analyysi tekijöistä, jotka liittyvät metaplastista rintasyöpää sairastavien potilaiden kokonaiseloonjäämiseen.
| Kokonaiseloonjäämiseen liittyvät tekijät metaplastisessa BC:ssä | ||||
|---|---|---|---|---|
| Muuttuja (viite) | Haittasuhde (95 %:n luottamusväli) | P-arvo | ||
| Age | Vuosittainen lisäys | 1.024 (1.015-1.033) | <0.0001 | |
| Lymfovaskulaarinen invaasio (ei ole) | Esiintyy | 1.307 (1.017-1.679) | 0.0364 | |
| Kliininen N-tila (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 | |
| Kliininen T-status (cT1) | cT0 | 2.226 (0.301-16.447) | <0.0001 | |
| cT2 | 1.454 (1.102-1.918) | |||
| cT3 | 3.029 (2.183-4.204) | |||
| cT4 | 3.145 (2.124-4.657) | |||
| Kliininen M-status (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 | |
| Aksillaarikirurgia (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 | |
| Ei leikkausta | 1.538 (0.884-2.675) | |||
| Säteily (Ei) | Kyllä | 0.709 (0.572-0.878) | 0.0016 | |
| Kemoterapia (Ei) | Kyllä | 0.579 (0.446-0.752) | <0.0001 | |
Lyhenteet:
Monimuuttuja-analyysissä lisääntyvä ikä, korkeampi kliininen T-luokitus, kliinisen solmukesairauden tai LVSI:n esiintyminen ja ALND-hoito korreloivat kaikki huonompaan lopputulokseen potilailla, joilla oli metaplastista BC:tä, TNBC:tä ja muuta BC:tä (lisätaulukko 1). Sekä solunsalpaajahoidon että sädehoidon lisääminen paransivat itsenäisesti käyttöikää rintasyöpätyypistä riippumatta. Muut potilaan ja kasvaimen ominaisuudet, jotka olivat yhteydessä eloonjäämiseen TNBC:ssä ja muussa BC:ssä, mukaan lukien rotu, liitännäissairaudet ja kasvaimen aste, eivät monimuuttuja-analyysissä olleet yhteydessä metaplastisen BC:n eloonjäämistuloksiin.
Koska metaplastista BC:tä sairastavilla potilailla oli verrattain huonot eloonjäämisluvut, metaplastista BC:tä sairastavista potilaista tehtiin alaryhmäanalyysejä, joiden avulla pyrittiin arvioimaan, liittyivätkö jotkin hoitomuodot parempiin tuloksiin. Kun solmukohdan status (cN0 vs. N+) oli korjattu, aggressiivisempaan kainaloleikkaukseen (ALND vs. SLND) perustuva hoito liittyi huonompiin lopputuloksiin, ja tämä ilmiö oli havaittavissa myös TNBC:n ja muun BC:n kohdalla (taulukko 2). Sädehoitoa saaneista potilaista hoito alueellisella solmukesäteilytyksellä vs. pelkkä rinta- tai rintaseinän säteilytys ei vaikuttanut merkitsevästi lopputulokseen metaplastista BC:tä sairastavilla potilailla (P=0,077 ja 0,200 kliinisen N0:n ja N+:n osalta). Neoadjuvanttinen solunsalpaajahoito liittyi huonompaan lopputulokseen kuin adjuvanttinen solunsalpaajahoito potilailla, joilla oli kliinisesti solmuke-negatiivinen metaplastinen BC (HR 1,9, 95 % CI 1,3-2,6, P<0.001), mutta ei niillä, joilla oli kliinisesti solmuke-positiivinen metaplastinen BC (P=0.43).
Keskustelu
Metaplastinen rintasyöpä on harvinainen mutta erityisen aggressiivinen rintasyövän muoto, etenkin kun sitä verrataan muihin rintakasvainten alatyyppeihin. Tämä tautikokonaisuus on ollut kirjallisuudessa suhteellisen aliedustettuna. Raysonin ja muiden tekemä laaja haku vuosien 1966-1997 julkaisuista tuotti yhteensä vain 27 tapausta. Suuret kansalliset tietokannat, kuten NCDB, ovat hyödyllisiä tutkittaessa harvinaisia syöpiä, kuten metaplastista BC:tä. Näiden tietokantojen mukaan metaplastisen BC-diagnoosin esiintyvyys Yhdysvalloissa on kuitenkin edelleen alhainen, alle 500 tapausta vuodessa. Tutkimuksessamme havaitsimme, että metaplastinen BC diagnosoitiin yleisimmin suurena kasvaimena, jolla oli epäsuotuisia riskiominaisuuksia, kuten huonosti erilaistunut kasvainluokka ja kolmoisnegatiivinen reseptoristatus. Metaplastista BC:tä sairastavilla potilailla oli huomattavasti huonompi eloonjäämisennuste riippumatta siitä, missä vaiheessa he olivat esittelyvaiheessa, verrattuna kolmoisnegatiiviseen ja muuhun BC:hen. Solunsalpaajahoidon ja sädehoidon saaminen ennustivat itsenäisesti parempaa elossaoloaikaa, mutta solunsalpaajahoidon järjestys näytti vaikuttavan lopputulokseen erityisesti metaplastista BC:tä sairastavien potilaiden kohdalla, joilla ei ollut kliinistä solmukeskeytymistä, vaikka joillakin näistä potilaista oli patologinen solmukeskeytyminen. Tuloksemme saattavat kuitenkin heijastaa mahdollisia heterogeenisuuksia taustalla olevissa biologisissa mekanismeissa, jotka ohjaavat hoitovasteita tässä erityisessä BC-potilasryhmässä, ja ne korostavat tarvetta parempaan riskistratifiointiin ja systeemihoitovaihtoehtoihin tulosten parantamiseksi.
Vaikka useimmilla metaplastisilla BC-taudeilla on kolmoisnegatiivinen fenotyyppi, metaplastisten BC-tautien käyttäytyminen näyttäisi kuitenkin olevan ainutlaatuista muihin TNBC-tauteihin verrattuna. TNBC:llä on yleensä huonompi ennuste kuin muilla BC-tyypeillä, ja käsitys siitä, että metaplastinen BC on aggressiivisempi kuin TNBC, on vahvistettu useissa pienemmissä retrospektiivisissä tutkimuksissa. Tällaiset tutkimukset ovat osoittaneet, että metaplastisen BC:n ja TNBC:n diagnoosi pitkälle edenneissä vaiheissa on samankaltainen, mikä johtuu pikemminkin cT3-4-taudin kuin solmukkeiden osallisuuden suuremmasta määrästä, ja 46 metaplastista BC-tapausta käsittäneessä yksittäisen laitoksen katsauksessa metaplastista BC:tä sairastavilla potilailla oli merkittävästi suurempi riski taudin uusiutumiseen paikallisesti (30 % vs. 15 %; P=0,004). Nämä piirteet korreloivat viime kädessä metaplastista BC:tä sairastavien potilaiden huonompaan viiden vuoden taudista vapaaseen eloonjäämiseen (30 % vs. 90 %; P<0,001) ja huonompaan elossaoloon (65 % vs. 87 %; P=0,002) TNBC:hen verrattuna. Surveillance Epidemiology and End Results -tutkimuksessa, johon osallistui 1112 potilasta, joilla oli metaplastista BC:tä, todettiin myös, että metaplastisen BC:n syöpäspesifiset eloonjäämisluvut olivat huonommat kolmen vuoden kuluttua kuin TNBC:n (78 % vs. 84 %). Tutkittaessa tn-metaplastista BC:tä Li ym. havaitsivat tn-metaplastisen BC:n huonomman taudittoman elossaolon (HR 1,48, 95 % CI 1,19-1,84, P<0,01) ja elossaoloaikojen lyhyen aikavälin (OS) (HR 1,42 ; P<0,01) verrattuna TNBC:hen. Tutkimuksemme, johon kuului yksi tähän mennessä suurimmista metaplastista BC:tä sairastavien potilaiden ryhmistä (n=2 084), vahvistaa näitä havaintoja ja korostaa, että reseptoristatus ei ole metaplastisen BC:n eloonjäämisen itsenäinen ennustaja (P=0.778), kuten ei-metaplastisen BC:n kohdalla.
Kriittinen hoitokomponentti, joka liittyi kaikkien tutkimuksessamme mukana olleiden metaplastista BC:tä sairastavien potilaiden parantuneisiin hoitotuloksiin, oli kemoterapian käyttö (HR 0,58, 95 % CI 0,45-0,75, P<0,001). Raporttimme on tietojemme mukaan ensimmäinen, jossa raportoidaan metaplastisen BC:n hoitotuloksista kemoterapian järjestyksen perusteella. Silmiinpistävää on, että osa-analyysissämme havaittiin, että erityisesti cN0-metaplastista BC:tä sairastavilla potilailla neoadjuvantti-sytostaattihoito liittyi huonompaan käyttöikään verrattuna adjuvantti-sytostaattihoitoon (HR 1,88, 95 %:n CI 1,34-2,64, P<0,001), kun taas sytostaattihoidon sekvensoinnilla ei ollut vaikutusta kliinisesti solmupositiiviseen metaplastiseen BC:hen. Yksi mahdollinen selitys tälle voi olla se, että metaplastista BC:tä sairastavilla potilaillamme oli korkeampi kliininen T-status, joka muissa raporteissa on yhdistetty matalampaan patologisen täydellisen vasteen määrään ja sitä seuraaviin huonompiin eloonjäämistuloksiin. Lisäksi kliiniset porrastusmenetelmät (eli pelkkä fyysinen tutkimus, ultraäänitutkimus) voivat aiheuttaa heterogeenisuutta kliinisessä N0-populaatiossa, koska niistä puuttuu todellinen nodaalinen tautitaakka, mikä sinänsä voi liittyä huonompiin tuloksiin. Kaiken kaikkiaan metaplastisen BC:n vasteen neoadjuvanttiseen solunsalpaajahoitoon on raportoitu olevan vain 18 %, mikä on paljon alhaisempi kuin TNBC:n tunnetut vasteasteet antrasykliini- ja taksanipohjaisille solunsalpaajahoitoohjelmille.
Tutkimuksessamme ja muissa raporteissa havaittujen huonompien eloonjäämismahdollisuuksien ja muihin rintasyövän alatyyppeihin verrattuna suhteellisen nopean etäpesäkkeiden leviämisen vuoksi metaplastisen BC:n kohdalla on selvää, että tarvitaan selvästi parempia systeemisiä hoitomuotoja. Transkriptioprofilointi on osoittanut, että tällä syövän alatyypillä on tumorigeenisiä piirteitä, jotka muistuttavat kantasoluja, PI3K/AKT/mTOR-reitin yleisiä poikkeavuuksia ja vaskulaarisen endoteelin kasvutekijän (VEGF) yliekspressiota. Nämä ominaisuudet ovat samankaltaisia kuin mesenkymaalisissa TNBC:ssä. Käynnissä on lupaavia ponnisteluja vaihtoehtoisten systeemisten hoitomuotojen löytämiseksi näille potilaille, mukaan lukien äskettäinen vaiheen I tutkimus, jossa liposomaalisen doksorubisiinin, bevasitsumabin (VEGF-A:n monoklonaalinen vasta-aine) ja everolimuusin (mTOR:n estäjä) objektiivinen vaste parani liposomaalisella doksorubisiinilla, bevasitsumabilla (monoklonaalinen vasta-aine VEGF-A:ta vastaan) ja everolimuusilla (mTOR:n estäjä) potilailla, joilla oli metaplastista TNBC:tä, jossa oli havaittavissa poikkeavuutta PI3K-radassa.
Lähihoitojen osalta mastektomiaa käytettiin tutkimuksessamme yleisemmin metaplastisessa BC:ssä, mutta se ei liittynyt parempaan eloonjäämiseen verrattuna rintaa säästävään leikkaukseen. Myöskään ALND:n sisältävästä hoidosta ei havaittu eloonjäämishyötyä verrattuna SLND:hen. Sädehoito oli kuitenkin merkittävä eloonjäämisen ennustaja, sillä metaplastista BC:tä sairastavilla potilailla, jotka saivat adjuvanttia sädehoitoa, oli 30 prosenttia pienempi todennäköisyys kuolla kuin niillä, jotka eivät saaneet säteilyä. Sädehoitoanalyysin rajoituksiin kuuluvat tuntemattomat yksityiskohdat hoidon suunnittelusta, valitusta hoitomuodosta, laadunvarmistuksesta tai siitä, käytettiinkö tekniikoita, kuten syvää inspiroivaa hengityksen pidättämistä. Vaikka paikallista uusiutumista ei voida tutkia NCDB:ssä, 113 metaplastista BC-potilasta (joista 54 % sai sädehoitoa) käsittänyt institutionaalinen sarja osoitti, että sädehoito oli ainoa tekijä, joka korreloi pienentyneen paikallisen uusiutumisen kanssa (suhteellinen riski ilman sädehoitoa 3 %).1; 95 % CI 1,13-9,88, P=0,027).
Tuloksiamme on tulkittava varovaisesti, kun otetaan huomioon suuret rajoitukset, jotka johtuvat siitä, ettei tiedetä, mitä solunsalpaajahoito-ohjelmia käytettiin, hoitojen kestosta tai vasteesta neoadjuvantti-solunsalpaajahoitoon, sillä näitä tietoja ei ole saatavilla NCDB:stä. Tunnustamme myös NCDB:hen kirjattujen kliinis-patologisten riskitekijöiden rajoitukset, joita ilman ei ehkä ole mahdollista täysin luonnehtia kliinisiä eroja, jotka aiheuttavat joitakin havaitsemiamme tuloseroja, kuten huonommat eloonjäämisluvut ALND:n yhteydessä, vaikka imusolmuketilanne kontrolloitaisiinkin. Vaikka metaplastista BC:tä sairastavien potilaiden otoskoko oli pieni suhteessa muihin kuin metaplastista BC:tä koskeviin tutkimuksiin, kyseessä on paradoksaalisesti todennäköisesti myös suurin tähän mennessä tehty tutkimus, jossa tätä kysymystä on tutkittu, kun otetaan huomioon laitossarjoissa raportoitujen metaplastista BC:tä sairastavien potilaiden vähäinen määrä. Lisätutkimuksia tarvitaan metaplastisen BC:n metastaattisen leviämisen biologisen taipumuksen ymmärtämiseksi ja havaintojemme validoimiseksi erillisissä metaplastista BC:tä sairastavien potilaiden aineistoissa.
Nykyinen hoitokäytäntömme ei selvästikään ole riittävä tälle ainutlaatuiselle syöpäpopulaatiolle, ja satunnaistettujen tietojen saaminen metaplastisesta BC:stä tulevaisuudessa edellyttää yhteistyöpyrkimyksiä pienten potilasmäärien vuoksi. NCDB:n merkittävä vahvuus on mahdollisuus tutkia harvinaiseen diagnoosiin liittyviä hoitomalleja ja tuloksia. Kohortissa on 2 084 metaplastista BC:tä sairastavaa henkilöä, joten kyseessä on yksi suurimmista nykyaikana raportoiduista metaplastista BC:tä koskevista tutkimuksista. Näiden potilaiden elossaoloaika on huono verrattuna muihin BC-tyyppeihin, ja vaikka tämä tosiasia todennäköisesti kannustaa aggressiivisen hoidon käyttöönottoon, tutkimuksemme osoittaa, että laajempaa paikallista ja alueellista hoitoa (esim. ALND tai alueellisten solmujen sädehoito) olisi harkittava huolellisesti tapauskohtaisesti. Kaiken kaikkiaan systeemisen hoidon käyttö on ratkaisevan tärkeää metaplastisen BC:n hoidossa riippumatta solmutaakasta, ja kasvaimen genomiprofilointianalyysiin perustuvien tehokkaiden kohdennettujen hoitojen kehittäminen on lupaavaa tulevaisuutta ajatellen.
Lisäaineisto
![]()
Lisätaulukko.
Kiitokset
Erikoiskiitokset Christine Woganille toimituksellisesta avusta.
Rahoitus
Tuki osittain Cancer Center Support (Biostatistics Core) Grant CA016672 from the National Cancer Institute, National Institutes of Health, to The University of Texas MD Anderson Cancer Center.
Kilpailevat intressit
Tekijät ovat ilmoittaneet, ettei kilpailevia intressejä ole.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Rintasyövän harvinaiset tyypit: kirjallisuuskatsaus. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastinen rintakarsinooma: kliiniset, mammografiset ja sonografiset löydökset sekä histopatologinen korrelaatio. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. ym. et al. Metaplastisen rintasyövän potilaiden huonompi ennuste kuin muiden kolmoisnegatiivisen rintasyövän potilaiden. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Rintojen metaplastiset karsinoomat: V. Metaplastinen karsinooma, jossa on osteoklastisia jättiläissoluja. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Rintojen metaplastiset karsinoomat. I. Matriisia tuottava karsinooma. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Rintojen metaplastiset karsinoomat. II. Spindlisolusyöpä. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastinen rintasyöpä: kliinispatologiset piirteet ja sen ennuste. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. October. 2018
10. Kansallinen syöpätietokanta.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Breast J. 2007;13(3):233-237
. Bembenek A, Schlag PM. Imusolmukkeiden dissektio rintasyövässä. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Langenbeck’s Arch Surg. 2000;385(4):236-245
. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Lähde J Am Stat Assoc. 1958;53(282):457-481
15. J Am Stat Assoc. 1958;53(282):457-481
. Mantel N. Eloonjäämisdatan arviointi ja kaksi sen tarkastelussa syntyvää uutta paremmuusjärjestystilastoa. Cancer Chemother Rep. 1966;50(3):163-170
16. Cancer Chemother Rep. 1966;50(3):163-170
. D.R. C. Regressiomallit ja elinkaaritaulukot. Coxin elinikäiset taulukot. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastinen rintasyöpä: ennuste ja vaste systeemiseen hoitoon. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. Kansallinen syöpätietokanta: tehokas aloite syövän hoidon parantamiseksi Yhdysvalloissa. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastisen rintasyövän hoito ja tulokset 2500 potilaalla: A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Kolmoisnegatiivinen rintasyöpä afroamerikkalaisilla naisilla: eriarvoisuudet vs. biologia. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostiset merkkiaineet kolmoisnegatiivisessa rintasyövässä. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Rintasyövän epidemiologia ja riskitekijät. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. Eri histologisten alatyyppien kliinispatologiset piirteet ja selviytymistulokset kolmoisnegatiivisessa rintasyövässä. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastinen rintasyöpä on aggressiivisempi kuin triplanegatiivinen rintasyöpä: A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Vaste neoadjuvanttihoitoon ja pitkäaikainen eloonjääminen potilailla, joilla on kolmoisnegatiivinen rintasyöpä. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18 -hankkeen tulokset. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Systeemisen kemoterapian tehon puute rinnan metaplastisen karsinooman hoidossa nykyaikana. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Cancer Res. 2009;69(10):4116-4124
. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Breast Cancer Res. 2010;12(5):R68
. Yu K-D, Zhu R, Zhan M. et al. Prognoosin kannalta merkityksellisten alaryhmien tunnistaminen potilailla, joilla on kemoresistentti kolmoisnegatiivinen rintasyöpä. Clin Cancer Res. 2013;19(10):2723-2733
32. Clin Cancer Res. 2013;19(10):2723-2733
. Basho RK, Yam C, Gilcrease M. ym. mTOR-pohjaisen systeemisen hoito-ohjelman vertaileva teho pitkälle edenneessä, metaplastisessa ja ei-metaplastisessa kolmoisnegatiivisessa rintasyövässä. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Techniques and Advantages for Cardiac Sparing During Breast Cancer Irradiation. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Katsaus rintasyövän hoidossa käytettäviin syvän inspiraation hengityksen pidättämistekniikoihin. J Med Radiat Sci. 2015;62(1):74-81
36. J Med Radiat Sci. 2015;62(1):74-81
. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Rinnan metaplastinen karsinooma: Ennuste ja vaste systeemiseen hoitoon metastaattisessa taudissa. Breast J. 2019;25(3):418-424
38. Breast J. 2019;25(3):418-424
. Harper NW, Hodges KB, Stewart RL. et al. Triple-negatiivisen metaplastisen rintasyövän adjuvanttihoito viikoittaisella paklitakseli- ja platinakemoterapialla: Retrospective Case Review From a Single Institution. Clin Breast Cancer. May. 2019
Tekijän yhteystiedot
.