ABOVE: modified from © ISTOCK.com, tera vector
Lähes aina jonkin rakentaminen on vaikeampaa kuin sen purkaminen. Vastaavasti geenien tyrmääminen on suurempi haaste kuin niiden tyrmääminen. Se on todellisuus, joka tutkijoiden on voitettava, jotta geenien muokkauksesta saadaan paras mahdollinen hyöty irti. Geenien kopioinnin avulla tutkijat voivat tutkia tiettyjen geenimuunnosten vaikutuksia, käyttää vihreän fluoresoivan proteiinin kaltaisia reportterigeenejä geenituotteiden seuraamiseen ajassa ja paikassa, tutkia genomin säätelyä ja lopulta korjata sairauksia aiheuttavia geenejä. ”Se on todella tehokas tapa tutkia geenin jokaista emästä”, sanoo Greg Findlay, lääketieteen tohtorikoulutettava Washingtonin yliopistossa.
CRISPR-Cas9, käyttäjäystävällisyydestään tunnettu geeninmuokkaustekniikka, voi kopioida geenejä sisään tai ulos. Geenin tyrmääminen edellyttää CRISPR-Cas9:n lisäämistä soluun käyttäen opas-RNA:ta, joka kohdistaa työkalun kiinnostavaan geeniin. Siellä Cas9 katkaisee geenin, leikkaamalla DNA:n molemmat säikeet, ja solun tavallinen DNA:n korjausmekanismi korjaa leikkauksen NHEJ-prosessilla (non-homologous end joining). NHEJ on erittäin tehokas mutta epätarkka. Prosessilla on taipumus aiheuttaa virheitä pienten lisäysten tai poistojen muodossa, jotka yleensä riittävät tyrmäämään geenin.
Geenin tyrmääminen edellyttää kuitenkin, että leikkaukset korjataan hyvin tarkasti ilman ylimääräisiä lisäyksiä tai poistoja. Tämä edellyttää toisen DNA:n korjausmekanismin, niin sanotun homologiaohjatun korjauksen (HDR), valjastamista, joka ainakin nisäkässoluissa tapahtuu vähemmän tehokkaasti, joten sen esiintymistiheys jää NHEJ:n taajuuden varjoon. Prosessia vaikeuttaa entisestään se, että jotkin geenipesäkkeet ja solutyypit ovat luonnostaan vähemmän suotuisia CRISPR-Cas9-editoinnille.
Viime vuosina tutkijat ovat kehittäneet monia uusia strategioita, joilla voidaan tehostaa sekä suurten että pienten geenien koputtamista CRISPR-Cas9:llä, ja matkan varrella he ovat ehdottaneet ja testanneet tämäntyyppisen geeninmuokkauksen uusia sovelluksia. Tässä The Scientist tutkii muutamia lupaavimpia lähestymistapoja.
Valitse se
Tutkija: Jon Chesnut, synteettisen biologian R&D:n vanhempi johtaja, Thermo Fisher Scientific
Projekti: Truetag-nimistä geenimerkintäsarjaa kehittäessään, jonka Thermo Fisher tuo markkinoille myöhemmin tänä vuonna, Chesnut käytti valikoivia markkereita tehon
parantamiseksi. Valikoiva merkkiaine – tässä tapauksessa antibioottiresistenssigeeni – kiinnitetään fluoresoivaan proteiinimerkkiin ja isketään nisäkässoluihin. Näitä soluja kasvatetaan sitten viljelyssä siihen liittyvän antibiootin kanssa. Resistenssigeeni antaa valikoivan edun sitä kantaville soluille; vain ne pystyvät kasvamaan, ja näin ollen ne, jotka kasvavat, sisältävät kiinnostavan geenitunnisteen. Vaikka geenin insertion tehokkuus olisi alhainen, tutkijat voivat käyttää antibioottivalintaa viikon ajan tai pidempäänkin, jotta he saavat lopulta suuren prosenttiosuuden soluja, joissa insertio on onnistunut.
Käyttämällä antibioottia puromysiiniä tai blastisidiinia kitin kanssa Chesnutin työryhmä onnistui nostamaan geenin insertioprosentin joissakin solupopulaatioissa kymmenestä kolmeenkymmeneen prosentista yhdeksäänkymmeneen prosenttiin tai jopa yli. Muutaman erityisen vaikean geenin insertionopeus nousi alle 1 prosentista yli 90 prosenttiin. On tärkeää testata useita antibioottiannoksia solulinjalla, jota aikoo käyttää oikean annoksen löytämiseksi, Chesnut sanoo: halutaan tappaa soluja, joissa ei ole insertioita, mutta ei soluja, joissa insertiot ovat onnistuneet.
Kokeile: Chesnut sanoo, että valikoivat merkkiaineet toimivat parhaiten, kun kiinnostava geeni ilmentyy voimakkaasti. ”Jos se ei ole, voit silti saada aikaan valinnan, mutta fluoresoivan proteiinimerkin ilmentyminen ei välttämättä riitä sen havaitsemiseen.” Myös CRISPR-Cas9:n yleiset rajoitukset pätevät. ”Genomissa on alueita, joita CRISPR ei leikkaa kovin hyvin, emmekä ole vieläkään varmoja, miksi”, hän lisää. Jotkin solutyypit eivät myöskään ota helposti vastaan vierasta DNA:ta, RNA:ta tai RNA-proteiinikomplekseja – CRISPR-Cas9:n kolmea toimitusmenetelmää.
Valintamarkkerien paremman menestyksen saamiseksi on varmistettava, että kohde-DNA:ssa on niin sanottu PAM-sekvenssi, lyhyt tunniste, joka CRISPR-Cas9:n on tunnistettava ennen kuin se leikkaa, 10 emäsparin sisällä halutusta geenin lisäyskohdasta, sanoo Chesnut. Jos leikkauskohdasta ollaan kauempana, insertion tehokkuus voi olla liian alhainen ollakseen toimiva. Ilman PAM-kohtaa voi kokeilla TALENeja tai sinkkisormi-nukleaaseja, vaikka nämä vanhemmat geeninmuokkaustekniikat ovatkin CRISPR:ää hankalampia.
Timed Inhibition
Tutkija: Jacob Corn, genomibiologi, Sveitsin liittovaltion teknillinen korkeakoulu, Zürich
Projekti: Tutkijat eivät ymmärrä, miksi NHEJ-reitti kilpailee valtavasti HDR-reitin kanssa nisäkässoluissa. ”Hiivat tekevät HDR:ää hullun lailla”, Corn sanoo. Pyrkiessään vauhdittamaan tätä DNA:n korjausprosessia ihmissoluissa ja parantamaan geenien kolhiintumisen hallintaa hän ja hänen ryhmänsä yrittävät selvittää, miten HDR:ää säädellään. He seuloivat ihmissoluja sellaisten geenien varalta, joiden knockdown johti HDR:n lisääntymiseen solussa, ja etsivät sitten näiden geenien pieniä molekyyli-inhibiittoreita. Yksi esiin tulleista geeneistä koodaa CDC7:ää, kinaasia, joka säätelee solusyklin siirtymistä S-vaiheeseen; sen inhibiittori XL413 lisäsi geenien knock-in-tehokkuuden kaksi- tai kolminkertaiseksi (BioRXiv, DOI: 10.1101/500462, 2018). Tämä johtuu siitä, että HDR tapahtuu vain joissakin solusyklin osissa, myös S-vaiheessa, Corn sanoo. Jos inhibiittoria XL413 lisätään samaan aikaan, kun CRISPR-Cas9:llä muokataan kohdegeeniä, solut kasaantuvat S-vaihetta välittömästi edeltävään vaiheeseen. Sitten poistat XL413:n, ja kaikki solut siirtyvät S-vaiheeseen ja lisäävät knock-in-tehokkuutta.

Corn on käyttänyt tätä tekniikkaa monissa kuolemattomaksi muuttuneissa ihmissolulinjoissa ja ihmisen T-soluissa. Sillä voidaan koputtaa lyhyitä DNA-jaksoja, kuten SNP:itä, sekä suuria geenejä. Ei ole mitään syytä, miksi sen ei pitäisi toimia hiirissä, hän sanoo, vaikka hän ei olekaan testannut sitä.
Kokeile: ”Ajoitus on ehdottomasti avainasemassa”, Corn sanoo. Cas9:n on leikattava DNA samaan aikaan, kun XL413 lisätään. Jos estät ensin ja sitten vapautat, kun muokkaat CRISPR-Cas9:llä, homologisen rekombinaation tehokkuus laskee kolminkertaiseksi sen sijaan, että se kasvaisi, koska solut vapautetaan solusyklin väärään vaiheeseen.
Ja kuten missä tahansa HDR-pyrkimyksessä, Corn sanoo, suorita aina nukleaasittomuuskontrollit varmistaaksesi, ettet vahingossakaan monista laboratoriossasi pyörivää kontaminoitunutta DNA:ta. Kun knock-in on otettu käyttöön, ”sekvenssi, sekvenssi, sekvenssi, sekvenssi”, hän sanoo. Pelkkä reportterijärjestelmän, kuten fluoresoivan proteiinimerkin, käyttö geenin onnistuneen lisäämisen osoittamiseksi voi kostautua. Sekvensoinnilla varmistetaan, että insertiot on tehty oikeaan kohtaan.
Playing the Long Game
Tutkija: Channabasavaiah Gurumurthy, hiiren genomitekniikan ydinlaitoksen johtaja, Nebraskan yliopiston lääketieteellinen keskus
Projekti: Muutama vuosi sitten Gurumurthy ja hänen kollegansa miettivät geenien koputtamisen vaikeutta yrittäessään tehdä niin hiiren zygootteihin ja saivat ilmestyksen.
Tutkijat olivat onnistuneet lisäämään lyhyttä, yksijuosteista DNA:ta, joten mikseivät he voisi yrittää tehdä knock-inia lisäämällä pitkää, yksijuosteista DNA:ta? Lähestymistapa, jota Gurumurthy kutsuu Easi-CRISPR:ksi (efficient additions with ssDNA inserts -CRISPR), lisääkin tehokkuutta 2,5-kertaiseksi, ja yksijuosteisen DNA:n käyttäminen pienentää off-target-insertioiden osuuden 100-kertaiseksi soluviljelmissä (Nat Protoc 13:195-215, 2018; Nature 559:405-09, 2018). ”Se on aika valtava”, hän sanoo. Gurumurthyn laboratoriossa Easi-CRISPR on tuottanut knock-in-hiirilinjan yhdeksälle kymmenestä kokeillusta geenistä. Yhteistyökumppani on myös käyttänyt sitä ihmisen T-soluissa CAR-T-solujen, syöpää vastaan taistelevien potilaskohtaisten immuunisolujen, luomiseen.
Kokeile: Easi-CRISPR ei ole läheskään idioottivarma, Gurumurthy varoittaa. Joskus tekniikka lisää vain osan geenistä. Hän lisää, että se voi myös sekoittaa homologiset varret – lyhyet sekvenssit geenin molemmin puolin, jotka asettavat sen oikeaan kohteeseensa genomissa. Ja jotkin lokukset ovat selittämättömästi vaikeampia lisätä kuin toiset.
Vähän kaupallisia myyjiä suunnittelee ja syntetisoi räätälöityä pitkää, yksijuosteista DNA:ta. Voit tehdä oman, mutta yksijuosteisen DNA:n stabiilisuus vaihtelee; vähemmän stabiilien sekvenssien saanto on pienempi, joten saatat joutua syntetisoimaan niitä enemmän, Gurumurthy sanoo.
Tutkijat, jotka eivät pysty lisäämään CRISPR:ää yksisoluisiin hiiren alkioihin, voivat maksaa ydinlaitokselle siitä, että se valmistaa hiiret, joissa on heidän DNA-järjestyksensä, Gurumurthy sanoo. Hänen kaltaisensa ydinlaitokset veloittavat 5 000-15 000 dollaria yhden tai kahden siitosparin tuottamisesta; kaupalliset laitokset veloittavat 20 000-50 000 dollaria, hän sanoo.
Knock-in By Numbers
Tutkija: Greg Findlay, MD/PhD-kandidaatti Jay Shenduren laboratoriossa Washingtonin yliopistossa
Projekti: Findlay ja hänen kollegansa pyrkivät parantamaan sitä, miten lääkärit tulkitsevat rinta- ja munasarjasyövän BRCA1-geenin mutaatioita. Kyseisessä geenissä on tuhansia variantteja, mutta tutkijat eivät tiedä, miten useimmat niistä vaikuttavat sen toimintaan. Tutkiakseen näiden varianttien vaikutusta he käyttivät kehittämäänsä knock-in -tekniikkaa, jota kutsutaan saturation genomieditoinniksi (Nature, 562:217-22, 2018).
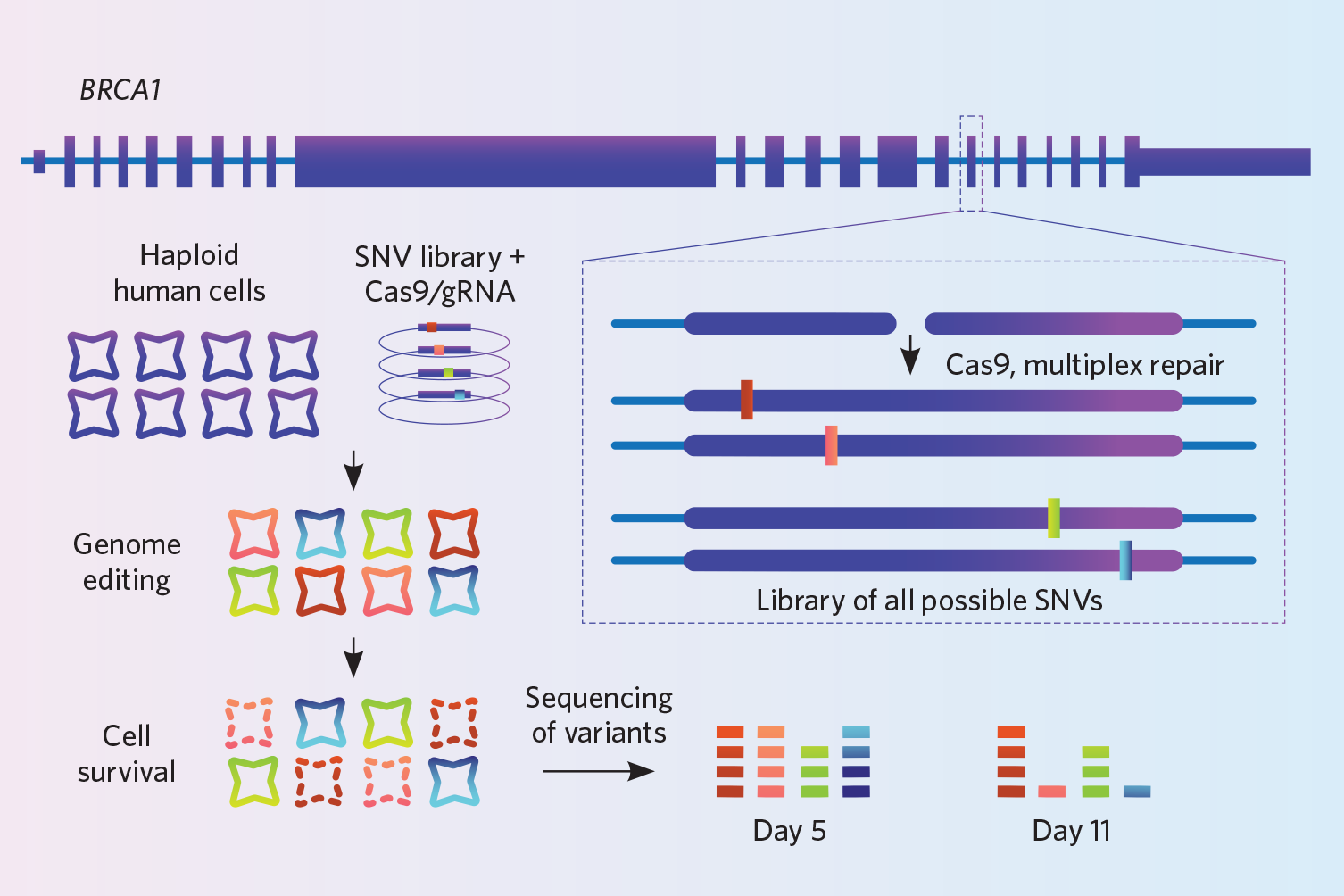
Kehittäjät käyttivät CRISPR-Cas9:ää kuolemattomaksi muuttuneessa haploidisessa ihmissolulinjassa tyrmäämään 4 000 pientä varianttia miljooniin soluihin yhtä aikaa in vitro. Genomi leikataan samasta kohdasta jokaisessa solussa, mutta jokaisen solun genomi saa eri muunnoksen. HDR:n edistämiseksi he tyrmäsivät myös ligase4-geenin, jolloin NHEJ-korjausreitti kytkeytyi pois päältä – tämä vaihe lisäsi tehokkuutta kolminkertaisesti, Findlay kertoo. Lopuksi, koska kaikkien solujen knock-init ovat erilaisia, solut sekvensoitiin syvällisesti, jolloin sama genomin alue käsiteltiin miljoonia kertoja, jotta voitiin varmistua siitä, että ne todella kolkkasivat ne 4 000 varianttia, joita he halusivat tutkia. He suorittivat sekvensoinnin kahtena ajankohtana ja päättelivät, että ne knock-insit, jotka eivät tulleet esiin sekvensoinnissa toisena ajankohtana, olivat sellaisia, jotka häiritsivät geenin toimintaa, koska niitä kantavien solujen oli täytynyt kuolla.
Kokeile: Findlayn työryhmä sai valmistettua 4 000 muunnoksen DNA-oligot mikrosirulle. Voit ostaa 6 000-250 000 oligon matriiseja, joten harkitse Findlayn mukaan saadaksesi enemmän vastinetta rahoillesi yhdistämällä useita kokeita samaan matriisiin. Heidän laboratorionsa maksaa noin 5 000 dollaria 100 000 oligosta.
Tässä strategiassa on rajoituksia: sitä on toistaiseksi käytetty vain yhden nukleotidin varianttien tyrmäämiseen, ja kaikkien muokkausten on oltava samassa geenissä. Menetelmä toimii parhaiten, kun muokataan melko kapeaa DNA-aluetta, noin 110-120 emäsparia, sillä pidemmissä DNA-oligoissa olisi liikaa virheitä, Findlay sanoo. On myös tärkeää sekvensoida hyvin syvälle, jotta voidaan varmistaa, että otetaan huomioon koko määrä variantteja, joita on tarkoitus kopioida.