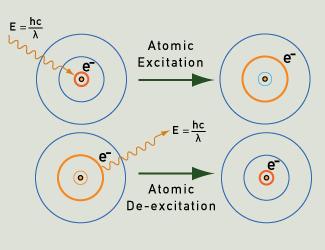
Valofotonit emittoituvat, kun elektroni putoaa takaisin perustilaansa sen jälkeen, kun se on virittynyt.
Liekkitestit
Liekkitestit ovat käyttökelpoisia, koska kaasun herääminen tuottaa alkuaineelle tunnusomaisen viivaspektrin. Vertailun vuoksi hehkutus tuottaa jatkuvan valokaistan, jonka huippu riippuu kuuman kohteen lämpötilasta.
Kun kaasun tai höyryn atomeja kiihdytetään esimerkiksi kuumentamalla tai soveltamalla sähkökenttää, niiden elektronit voivat siirtyä perustilastaan korkeammille energiatasoille. Kun ne palaavat perustilaansa kvanttitodennäköisyyksien mukaan selkeästi määriteltyjä reittejä pitkin, ne säteilevät hyvin tietyn energian fotoneja. Tämä energia vastaa tiettyjä valon aallonpituuksia ja tuottaa siten tiettyjä valon värejä. Kullakin alkuaineella on ”sormenjälki” viivasäteilyspektrinsä suhteen, kuten alla olevat esimerkit osoittavat.

Vedyn viivasäteilyspektri.

Heliumin viivasäteilyspektri.

Neonin viivaspektri.
Koska jokaisella alkuaineella on tarkasti määritelty viivaspektri, tutkijat pystyvät tunnistamaan ne niiden tuottaman liekin värin perusteella. Esimerkiksi kupari tuottaa sinisen liekin, litium ja strontium punaisen liekin, kalsium oranssin liekin, natrium keltaisen liekin ja barium vihreän liekin.

Tämä kuva havainnollistaa tiettyjen alkuaineiden palaessa syntyviä erottuvia värejä.

Happoasetyleenipolttimen liekki palaa yli 3000?C:n lämpötilassa, joka on tarpeeksi kuuma käytettäväksi vedenalaisessa hitsauksessa.
Liekki
Väri kertoo kynttilän liekin lämpötilasta. Kynttilänliekin sisäinen ydin on vaaleansininen, ja sen lämpötila on noin 1670 K (1400 °C). Se on liekin kuumin osa. Liekin sisällä väri muuttuu keltaiseksi, oranssiksi ja lopulta punaiseksi. Mitä kauemmas liekin keskipisteestä päästään, sitä alhaisempi lämpötila on. Punainen osa on noin 1070 K (800 °C).
Liekin oranssi, keltainen ja punainen väri eivät liity vain värilämpötilaan. Myös kaasujen herätteillä on suuri merkitys liekin väriin. Yksi palavan liekin tärkeimmistä ainesosista on noki, jonka koostumus on monimutkainen ja monipuolinen hiiliyhdisteistä. Näiden yhdisteiden moninaisuus luo käytännössä jatkuvan valikoiman mahdollisia kvanttitiloja, joihin elektronit voivat virittyä. Emittoituvan valon väri riippuu kunkin alkuperäiseen tilaansa palaavan elektronin emittoimasta energiasta.