Sisältö
- 1 Toiminta
- 2 Ihmisen laktaattidehydrogenaasi
- 2.1 Rakenne
- 2.2 Katalyysi
- 2.3 Kinetiikka
- 2.4 Säätely
- 3 Laktaattidehydrogenaasin 3D-rakenteet
Toiminta
L-laktaattidehydrogenaasi (L-LDH) katalysoi pyruvaatin ja NADH+:n keskinäistä muuntumista L-laktaatiksi ja NAD+:ksi.
H-laktaattidehydrogenaasi (H-LDH) katalysoi D-laktaatin ja ferrosytokromi c:n interkonversiota pyruvaatiksi ja ferrosytokromi c:ksi.
Laktaattidehydrogenaasi (LDH) on tärkeä entsyymi ihmisessä. Sitä esiintyy kehon eri alueilla, ja kullakin alueella on eri alayksiköiden ainutlaatuinen konformaatio. LDH on keskeinen entsyymi anaerobisessa hengityksessä. Anaerobinen hengitys tapahtuu ilman happea. Tämä reitti on tärkeä glykolyysille kahdella tavalla. Ensimmäinen on se, että jos pyruvaatti kasaantuisi glykolyysin ja siten ATP:n tuottaminen hidastuisi. Toiseksi anaerobinen hengitys mahdollistaa NAD+:n regeneroimisen NADH:sta. NAD+:a tarvitaan, kun glyseraldehydi-3-fosfaattidehydrogenaasi hapettaa glyseraldehydi-3-fosfaattia glykolyysissä, jolloin syntyy NADH:ta. Laktaattidehydrogenaasi vastaa NADH:n anaerobisesta muuntamisesta NAD+:ksi. in Lactate Dehydrogenase from Cryptosporidium parvum (4nd4).
Ihmisen laktaattidehydrogenaasi
Rakenne
on kvaternäärinen proteiini, joka muodostuu kahden alayksikön, M:n ja H:n (Lihas ja Sydän) yhdistymisestä neljän alayksikön rakenteeksi. Ihmiskehossa esiintyvät eri yhdistelmät ovat:
- (4H) Sydän
- (3H1M) Retikuloendoteeli
- (2H2M) Keuhkot
- (1H3M) Munuaiset
- (4M) Lihas ja Maksa
Kuvassa esitetyn kaltainen LDH:n rakenne koostuu 40 %:lla alfaheliksistä ja 23 %:lla beeta-arkista. SCOP-tiedoissa tämä laktaattidehydrogenaasin muoto luokitellaan sekamuotoiseksi beeta-alfa-beta-hiiliksi, jossa on pääasiassa yhdensuuntaisia beeta-arkkeja.
Vrt. myös
- Ihmisen laktaattidehydrogenaasi
- Jasperin laktaattidehydrogenaasin lopullinen
- Rossmann-taitos.
Katalyysi
Tutkimukset ovat osoittaneet, että LDH:n reaktiomekanismi noudattaa järjestäytynyttä järjestystä.
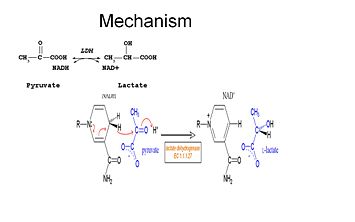
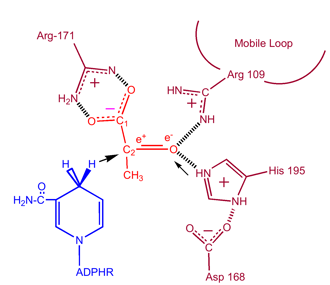
Laktaatin hapettamiseksi NADH:n on ensin sitouduttava entsyymiin ja sen jälkeen laktaatin. . Kun NADH on sitoutunut entsyymiin, laktaatti voi sen jälkeen sitoutua (kuvassa substraattioksamaatti; -CH3-ryhmä korvataan -NH2:lla oksamaatin muodostamiseksi). Laktaatti sitoutuu entsyymiin nikotiiniamidirenkaan ja useiden LDH:n jäämien väliin. Hydridi-ionin siirtyminen tapahtuu sitten nopeasti kumpaankin suuntaan, jolloin syntyy kahden tertiäärikompleksin, entsyymi-NAD+-laktaatti ja entsyymi-NADH-pyruvaatti, seos. Lopuksi pyruvaatti dissosioituu entsyymistä ja sen jälkeen NAD+.
Kinetiikka
Kineettiset tutkimukset laktaattidehydrogenaasilla oksalaatilla ja oksamaatilla (laktaatin ja pyruvaatin rakenteelliset analogit)ovat osoittaneet edellä mainitun mekanismin. Nopeutta rajoittava vaihe tässä reaktiossa on NAD+:n ja NADH:n dissosioitumisnopeus. Pyruvaatin muuntuminen laktaatiksi ja sitä seuraava NAD+:n regeneroituminen on erittäin suotuisaa.
Säätely
Koska mekanismi on tasapainomekanismi, laktaattidehydrogenaasille ei näytä olevan erityisesti suunniteltua säätelyä, vaan se on riippuvainen anaerobisen reparaation aktivoitumisesta sekä pyruvaatin ja NADH:n tai laktaatin ja NAD+:n läsnäolosta.
Laktaattidehydrogenaasin 3D-rakenteet
Laktaattidehydrogenaasin 3D-rakenteet
.
