- Table of Geometries
- OPPIMISTAVOITTEET
- KESKEISET TAVOITTEET
- Kärkikohdat
- Keskeiset termit
- VSEPR-malli
- Molekyyligeometriat
- How to Determine Molecular Geometry – YouTube: Tällä videolla kuvataan yksi menetelmä yksinkertaisten molekyylien tärkeimpien geometristen muotojen nopeaan määrittämiseen.
- Molekyylien geometriat
- OPPIMISTAVOITTEET
- KESKEISET TAVOITTEET
- Keskeiset kohdat
- Keskeiset termit
- AXE-menetelmä
- Päägeometriat (ilman yksinäisiä elektronipareja):
- Trigonaalinen tasomuotoinen
- Tetraedrinen
- Oktaedrinen
- Interaktiivinen: Elektronigeometria: Molekyylit saavat erilaisia muotoja jaettujen ja jakamattomien elektronien mallien vuoksi. Näissä esimerkeissä kaikki molekyylien muotoon vaikuttavat elektronit ovat jaettuja kovalenttisissa sidoksissa, jotka pitävät atomit yhdessä muodostaen molekyylit.
- Yksittäiset elektroniparit
- OPPIMISTAVOITTEET
- KESKEISET TAVOITTEET
- Keskeiset huomiot
- Avainsanat
- Molekyyligeometriat, joissa on yksinäisiä elektronipareja
- Koordinaatioluku ja keskusatomi
- Lone pair -elektronien torjuva vaikutus
- Interaktiivinen: Unshared Electrons and the ”Bent” Shape: Käytä 3D-mallia nähdäksesi, miten jakamattomat elektronit hylkivät jaettuja elektroneja vedyn ja hapen välisissä sidoksissa, jolloin molekyylillä on ”taivutettu” muoto.
- LISENSSIT JA OMINAISUUDET
- CC-LISENSSILLÄ OLEVA SISÄLTÖ, JAKAUTETTU EDELTÄVÄSTI
- CC LISENSSOITU SISÄLTÖ, ERITYISESTI LUOVUTETTU
Table of Geometries
VSEPR-teoria määrittää molekyyligeometriat (lineaarinen, trigonaalinen, trigonaalinen bipyramidaali, tetraedrinen ja oktaedrinen).
OPPIMISTAVOITTEET
Sovelletaan VSEPR-mallia sellaisen molekyylin geometrian määrittämiseen, joka ei sisällä yksinäisiä elektronipareja keskeisellä atomilla.
KESKEISET TAVOITTEET
Kärkikohdat
- Periaatteessa VSEPR-malli teoretisoi, että alueet, joilla on negatiivinen sähkövaraus, hylkivät toisiaan, jolloin ne (ja niiden muodostamat kemialliset sidokset) pysyvät mahdollisimman kaukana toisistaan.
- Molekyyligeometriat ottavat huomioon atomien lukumäärän ja yksinäisen elektroniparin elektronien määrän.
- Päägeometriat, joissa ei ole yksinäisen parin elektroneja, ovat: lineaarinen, trigonaalinen, tetraedrinen, trigonaalinen bipyramidi ja oktaedrinen.
Keskeiset termit
- VSEPR-teoria: kemian malli, jolla ennustetaan yksittäisten molekyylien muotoa elektroniparien sähköstaattisen hylkimisen perusteella
VSEPR-malli
Valeenssikuoren elektroniparien hylkimisen (VSEPR) malli keskittyy atomin uloimmassa (valenssi)kuoressa oleviin sitoviin ja ei-sitoviin elektronipareihin, jotka yhdistyvät kahteen tai useampaan muuhun atomiin.
Periaatteessa VSEPR-malli teoretisoi, että nämä negatiivisen sähkövarauksen alueet hylkivät toisiaan, jolloin ne (ja niiden muodostamat kemialliset sidokset) pysyvät mahdollisimman kaukana toisistaan. Siksi yksinkertaisen kolmiatomisen molekyylin ![]() sisältämät kaksi elektronipilveä ulottuvat vastakkaisiin suuntiin. 180°:n kulmaero sijoittaa kaksi sidosorbitaalia mahdollisimman kauas toisistaan; odotamme siis kahden kemiallisen sidoksen ulottuvan vastakkaisiin suuntiin, jolloin syntyy lineaarinen molekyyli.
sisältämät kaksi elektronipilveä ulottuvat vastakkaisiin suuntiin. 180°:n kulmaero sijoittaa kaksi sidosorbitaalia mahdollisimman kauas toisistaan; odotamme siis kahden kemiallisen sidoksen ulottuvan vastakkaisiin suuntiin, jolloin syntyy lineaarinen molekyyli.

 . Kaksi X-atomia (valkoisella) ovat 180°:n etäisyydellä toisistaan.
. Kaksi X-atomia (valkoisella) ovat 180°:n etäisyydellä toisistaan.Jos keskeinen atomi sisältää myös yhden tai useamman parin ei-sitoutuvia elektroneja, nämä negatiivisen varauksen lisäalueet käyttäytyvät samoin kuin sidottuihin atomeihin liittyvät alueet. Valenssikuoren eri sitoutuvia ja sitoutumattomia pareja sisältävät orbitaalit ulottuvat keskusatomista ulospäin suuntiin, jotka minimoivat niiden keskinäiset vastukset. Jos keskeisellä atomilla on osittain varattuja d-orbitaaleja, se voi pystyä vastaanottamaan viisi tai kuusi elektroniparia, jolloin muodostuu niin sanottu ”laajennettu oktetti”.
Molekyyligeometriat
Molekyylien geometriat (lineaarinen, trigonaalinen, tetraedrinen, trigonaalinen bipyramidaalinen ja oktaedrinen) määräytyvät VSEPR-teorian mukaan. VSEPR-teoriaa käyttävä geometriataulukko voi helpottaa molekyylien piirtämistä ja ymmärtämistä. Molekyyligeometriataulukko löytyy ensimmäisestä kuvasta. Toinen kuva toimii taulukon visuaalisena apuna.


How to Determine Molecular Geometry – YouTube: Tällä videolla kuvataan yksi menetelmä yksinkertaisten molekyylien tärkeimpien geometristen muotojen nopeaan määrittämiseen.
Molekyylien geometriat
VSEPR-teoria kuvaa yksinkertaisten molekyylien viisi päämuotoa: lineaarinen, trigonaalinen planaarinen, tetraedrinen, trigonaalinen bipyramidaalinen ja oktaedrinen.
OPPIMISTAVOITTEET
Sovelletaan VSEPR-mallia sellaisten molekyylien geometrian määrittämiseen, joissa keskeinen atomi sisältää yhden tai useamman yksinäisen elektroniparin.
KESKEISET TAVOITTEET
Keskeiset kohdat
- Lineaarinen: yksinkertainen kolmiatominen molekyyli tyyppiä
 ; sen kaksi sidosorbitaalia ovat 180°:n etäisyydellä toisistaan.
; sen kaksi sidosorbitaalia ovat 180°:n etäisyydellä toisistaan. - trigonaalinen planaarinen: kolmion muotoinen ja samassa tasossa oleva molekyyli, jonka sidoskulmat ovat 120°.
- Tetraedrinen: neljä sidekappaletta yhden keskusatomin ympärillä, sidekulmat 109,5°.
- Trigonaalinen kaksoispyramidi: viisi atomia keskusatomin ympärillä; kolme tasossa, sidekulmat 120°, ja kaksi molekyylin vastakkaisissa päissä.
- Oktaedrinen: kuusi atomia keskusatomin ympärillä, kaikkien sidekulmat 90°.
Keskeiset termit
- VSEPR-teoria: Valenssikuoren elektroniparikarkotuksen (Valence Shell Electron Pair Repulsion, VSEPR) mallia käytetään ennustamaan yksittäisten molekyylien muotoa elektroniparien sähköstaattisen hylkimisen laajuuden perusteella
AXE-menetelmä
Muuten molekyyligeometrioiden tarkastelu tapahtuu elektronilaskennan ns. AXE-menetelmän avulla. AXE-menetelmässä A edustaa keskusatomia, ja sillä on aina implisiittinen indeksi yksi; X edustaa keskusatomin ja sen ulkopuolisten atomien välisten sigmasidosten lukumäärää (moninkertaiset kovalenttiset sidokset – kaksoissidokset, kolmoissidokset jne. – lasketaan yhdeksi X:ksi); ja E edustaa keskusatomia ympäröivien yksinäisten elektroniparien lukumäärää. X:n ja E:n summa, jota kutsutaan steriiliseksi luvuksi, liittyy myös valenssisidosteoriassa käytettyjen hybridisoituneiden orbitaalien kokonaismäärään. VSEPR käyttää steeristä lukua ja X:n ja E:n jakaumaa molekyylien geometristen muotojen ennustamiseen.

Huomaa, että geometriat on nimetty vain atomien asentojen, ei elektronijärjestyksen mukaan.

Päägeometriat (ilman yksinäisiä elektronipareja):
Lineaarisessa mallissa atomit ovat yhteydessä toisiinsa suorassa linjassa, ja sidoskulma on yksinkertaisesti kahden vierekkäisen sidoksen välinen geometrinen kulma. Yksinkertaisen kolmiatomisen molekyylin tyypin ![]() kaksi sidosorbitaalia on 180°:n päässä toisistaan. Esimerkkejä kolmiatomisista molekyyleistä, joille VSEPR-teoria ennustaa lineaarisen muodon, ovat
kaksi sidosorbitaalia on 180°:n päässä toisistaan. Esimerkkejä kolmiatomisista molekyyleistä, joille VSEPR-teoria ennustaa lineaarisen muodon, ovat ![]() (jolla ei ole tarpeeksi elektroneja noudattaakseen oktettisääntöä) ja
(jolla ei ole tarpeeksi elektroneja noudattaakseen oktettisääntöä) ja ![]() . Kun kirjoitat hiilidioksidin elektronipistekaavaa, huomaa, että C-O-sidokset ovat kaksoissidoksia; tällä ei ole merkitystä VSEPR-teorian kannalta. Keskeinen hiiliatomi on edelleen sidoksissa kahteen muuhun atomiin. Kahta happiatomia yhdistävät elektronipilvet ovat 180°:n etäisyydellä toisistaan.
. Kun kirjoitat hiilidioksidin elektronipistekaavaa, huomaa, että C-O-sidokset ovat kaksoissidoksia; tällä ei ole merkitystä VSEPR-teorian kannalta. Keskeinen hiiliatomi on edelleen sidoksissa kahteen muuhun atomiin. Kahta happiatomia yhdistävät elektronipilvet ovat 180°:n etäisyydellä toisistaan.

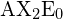 .
.Trigonaalinen tasomuotoinen
Trigonaalisen tasomuodon omaavat molekyylit ovat kolmionmuotoisia ja yhdessä tasossa eli tasaisella pinnalla. ![]() -molekyylissä, kuten
-molekyylissä, kuten ![]() , on kolme elektronitiheyden aluetta, jotka ulottuvat keskusatomista ulospäin. Näiden välinen repulsio on pienimmillään, kun minkä tahansa kahden välillä oleva kulma on 120o.
, on kolme elektronitiheyden aluetta, jotka ulottuvat keskusatomista ulospäin. Näiden välinen repulsio on pienimmillään, kun minkä tahansa kahden välillä oleva kulma on 120o.
Tetraedrinen
Tetra- tarkoittaa neljää, ja -edrinen liittyy kiinteän aineen pinta-alaan; ”tetraedrinen” tarkoittaa kirjaimellisesti ”neljä pinta-alaa”. ” Tämä muoto esiintyy silloin, kun yhdellä keskeisellä atomilla on neljä sidosta, joissa ei ole yksinäisiä elektronipareja. VSEPR-teorian mukaan elektronisidosten väliset sidoskulmat ovat 109,5o. Esimerkki tetraedrisestä molekyylistä on metaani ![]() . Neljä ekvivalenttista sidosta osoittaa neljään geometrisesti ekvivalenttiin suuntaan kolmessa ulottuvuudessa, jotka vastaavat hiiliatomiin keskitetyn tetraedrin neljää kulmaa.
. Neljä ekvivalenttista sidosta osoittaa neljään geometrisesti ekvivalenttiin suuntaan kolmessa ulottuvuudessa, jotka vastaavat hiiliatomiin keskitetyn tetraedrin neljää kulmaa.

Trigonaalinen kaksoispyramidi-muotoinen muoto muodostuu, kun molekyylissä keskusatomia ympäröi viisi atomia. Geometriassa kolme atomia on samassa tasossa sidekulmien ollessa 120°; kaksi muuta atomia ovat molekyylin vastakkaisissa päissä. Jotkin jaksollisen järjestelmän ryhmän 15 alkuaineet muodostavat tyypin ![]() yhdisteitä; esimerkkejä ovat
yhdisteitä; esimerkkejä ovat ![]() ja
ja ![]() .
.

Oktaedrinen
Octa- tarkoittaa kahdeksaa, ja -edrinen liittyy kiinteän aineen pinta-alaan, joten ”oktaedrinen” tarkoittaa kirjaimellisesti ”kahdeksan pinta-alaa”. Sidekulmat ovat kaikki 90°, ja aivan kuten neljä elektroniparia kokee minimaalisen hylkimisen suuntautuessaan kohti tetraedrin kulmia, kuusi elektroniparia pyrkii suuntautumaan kohti oktaedrin kulmia. Esimerkki oktaedrimolekyylistä (![]() ) on rikkiheksafluoridi (
) on rikkiheksafluoridi (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktiivinen: Elektronigeometria: Molekyylit saavat erilaisia muotoja jaettujen ja jakamattomien elektronien mallien vuoksi. Näissä esimerkeissä kaikki molekyylien muotoon vaikuttavat elektronit ovat jaettuja kovalenttisissa sidoksissa, jotka pitävät atomit yhdessä muodostaen molekyylit.
Yksittäiset elektroniparit
Yksittäiset elektronit ovat orbitaaleissa, jotka vievät tilaa, hylkivät muita orbitaaleja ja muuttavat molekyylin muotoa.
OPPIMISTAVOITTEET
Tunnista yksinäisten elektroniparien vaikutus molekyylien geometriaan.
KESKEISET TAVOITTEET
Keskeiset huomiot
- Valenssikuoren eri sidos- ja sitoutumattomia pareja sisältävät orbitaalit ulottuvat keskusatomista ulospäin sellaisiin suuntiin, jotka minimoivat niiden aiheuttamat vastukset.
- Ei-sitovalla orbitaalilla ei ole atomiydintä sen kauimmaisessa päässä vetämässä elektronipilveä puoleensa, joten tällaisen orbitaalin varaus keskittyy lähemmäs keskusatomia.
- Ei-sitovat orbitaalit kohdistavat enemmän vastusta muihin orbitaaleihin kuin sitovat orbitaalit.
Avainsanat
- Koordinaatioluku: Kemiassa ja kiteytymisessä keskeisen atomin naapureiden lukumäärä molekyylissä tai kiteessä
- yksinäinen pari: kahden elektronin valenssijoukko, joka on olemassa ilman sitoutumista tai jakamista muiden atomien kanssa
Molekyyligeometriat, joissa on yksinäisiä elektronipareja
Tähän mennessä olemme käsitelleet vain geometrioita, joissa ei ole yksinäisiä elektronipareja. Kuten olet todennäköisesti huomannut geometriataulukosta ja AXE-menetelmästä, yksinäisten elektroniparien lisääminen muuttaa molekyylin muotoa. Mainitsimme aiemmin, että jos keskeinen atomi sisältää myös yhden tai useamman ei-sitovan elektroniparin, nämä ylimääräiset negatiivisen varauksen alueet käyttäytyvät samoin kuin sidottuihin atomeihin liittyvät alueet. Orbitaalit, jotka sisältävät erilaisia sitoutuvia ja sitoutumattomia pareja valenssikuoressa, ulottuvat keskusatomista ulospäin suuntiin, jotka minimoivat niiden keskinäiset vastukset.

Koordinaatioluku ja keskusatomi
Koordinaatioluvulla tarkoitetaan tiettyä atomia, jota usein kutsutaan keskusatomiksi, ympäröivien elektroniparien määrää. Yksinäisiä pareja sisältävien molekyylien geometriat eroavat yksinäisiä pareja sisältämättömien molekyylien geometrioista, koska yksinäinen pari näyttää molekyylissä tyhjältä tilalta. Molemmat geometrialuokat on nimetty niiden kuvitteellisten geometristen hahmojen (useimmiten säännöllisiä kiinteitä monikulmioita) muotojen mukaan, joiden keskipisteenä olisi keskeinen atomi ja joiden jokaisessa kärjessä olisi elektronipari.
Vesimolekyylissä (![]() ) keskeinen atomi on
) keskeinen atomi on ![]() , ja Lewisin elektronipistekaava ennustaa, että siinä on kaksi sitoutumatonta elektroniparia. Happiatomi on siis tetraedrisesti koordinoitu, mikä tarkoittaa, että se sijaitsee tetraedrin keskellä. Koordinaatiopaikoista kaksi on O-H-sidoksia muodostavien jaettujen elektroniparien ja kaksi muuta ei-sitoutuvien elektroniparien käytössä. Näin ollen, vaikka happiatomi on tetraedrisesti koordinoitu,
, ja Lewisin elektronipistekaava ennustaa, että siinä on kaksi sitoutumatonta elektroniparia. Happiatomi on siis tetraedrisesti koordinoitu, mikä tarkoittaa, että se sijaitsee tetraedrin keskellä. Koordinaatiopaikoista kaksi on O-H-sidoksia muodostavien jaettujen elektroniparien ja kaksi muuta ei-sitoutuvien elektroniparien käytössä. Näin ollen, vaikka happiatomi on tetraedrisesti koordinoitu, ![]() -molekyylin sidosgeometriaa (muotoa) kuvataan taivutetuksi.
-molekyylin sidosgeometriaa (muotoa) kuvataan taivutetuksi.

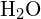 -molekyylin sidosgeometriaa (muotoa) kuvataan taivutetuksi.
-molekyylin sidosgeometriaa (muotoa) kuvataan taivutetuksi.Lone pair -elektronien torjuva vaikutus
Sitoutuvien ja ei-sitoutuvien elektroniorbitaalien välillä on tärkeä ero. Koska ei-sitovalla orbitaalilla ei ole atomiydintä sen kauimmaisessa päässä vetämässä elektronipilveä puoleensa, varaus tällaisessa orbitaalissa keskittyy lähemmäs keskeistä atomia; tämän seurauksena ei-sitovilla orbitaaleilla on enemmän hylkivää vaikutusta muihin orbitaaleihin kuin sitovilla orbitaaleilla. ![]() :ssä kaksi ei-sitovaa orbitaalia työntävät sitovia orbitaaleja lähemmäs toisiaan, jolloin H-O-H-kulma on 104,5° 109,5°:n tetraedrisen kulman sijasta.
:ssä kaksi ei-sitovaa orbitaalia työntävät sitovia orbitaaleja lähemmäs toisiaan, jolloin H-O-H-kulma on 104,5° 109,5°:n tetraedrisen kulman sijasta.
![]() :n elektronipistemäinen rakenne sijoittaa yhden parin ei-sitovia elektroneja typpiatomin valenssikuoreen. Tämä tarkoittaa, että typen ympärillä on kolme sidottua atomia ja yksi yksinäinen pari, jolloin koordinaatioluku on neljä, kuten
:n elektronipistemäinen rakenne sijoittaa yhden parin ei-sitovia elektroneja typpiatomin valenssikuoreen. Tämä tarkoittaa, että typen ympärillä on kolme sidottua atomia ja yksi yksinäinen pari, jolloin koordinaatioluku on neljä, kuten ![]() :ssä esiintyy.
:ssä esiintyy.

 :n, Lewisin piste-rakenne…: Keskeiseen typpeen kiinnittynyt yksinäinen pari luo sidoskulmat, jotka poikkeavat tetraedristä 109,5 °.
:n, Lewisin piste-rakenne…: Keskeiseen typpeen kiinnittynyt yksinäinen pari luo sidoskulmat, jotka poikkeavat tetraedristä 109,5 °.Voidaan siis ennustaa, että kolme vetyatomia sijaitsevat typpiatomin ympärille keskitetyn tetraedrin kulmissa. Yksinäisen parin orbitaali osoittaa kohti tetraedrin neljättä kulmaa, mutta koska tämä paikka on vapaa, ![]() -molekyyli itsessään ei voi olla tetraedrinen; sen sijaan se ottaa pyramidin muodon, tarkemmin sanottuna trigonaalisen pyramidin (pyramidi, jolla on kolmiomainen pohja). Vetyatomit ovat kaikki samassa tasossa, ja typpi on tason ulkopuolella. Sitoutumattomat elektronit työntävät sidosorbitaaleja hieman yhteen, jolloin H-N-H-sidekulmat ovat noin 107°.
-molekyyli itsessään ei voi olla tetraedrinen; sen sijaan se ottaa pyramidin muodon, tarkemmin sanottuna trigonaalisen pyramidin (pyramidi, jolla on kolmiomainen pohja). Vetyatomit ovat kaikki samassa tasossa, ja typpi on tason ulkopuolella. Sitoutumattomat elektronit työntävät sidosorbitaaleja hieman yhteen, jolloin H-N-H-sidekulmat ovat noin 107°.
5-koordinoiduissa molekyyleissä, jotka sisältävät yksinäisiä pareja, nämä sitoutumattomat orbitaalit (jotka ovat lähempänä keskusatomia ja siten todennäköisemmin toisten orbitaalien työntämiä) sijaitsevat mieluiten ekvatoriaalitasossa. Tällöin ne ovat 90°:n kulmassa korkeintaan kahteen aksiaalisesti suuntautuneeseen sidosorbitaaliin nähden. Voimme siis ennustaa, että ![]() -molekyylillä (molekyylillä, jossa keskusatomi A on koordinoituna neljään muuhun atomiin X ja yhteen ei-sitovaan elektronipariin), kuten
-molekyylillä (molekyylillä, jossa keskusatomi A on koordinoituna neljään muuhun atomiin X ja yhteen ei-sitovaan elektronipariin), kuten ![]() , on ”see-saw”-muoto.
, on ”see-saw”-muoto.

Korvaamalla sidotut atomit ei-sitoutuvilla elektronipareilla saadaan kolmionmuotoinen kaksoispyramidikoordinaatio vielä yksinkertaisempaan molekyylimuotoon.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
LISENSSIT JA OMINAISUUDET
CC-LISENSSILLÄ OLEVA SISÄLTÖ, JAKAUTETTU EDELTÄVÄSTI
- Korjaus ja tarkistaminen. Toimittanut: Boundless.com. Lisenssi: CC BY-SA: Attribution-ShareAlike
CC LISENSSOITU SISÄLTÖ, ERITYISESTI LUOVUTETTU
- VSEPR Teoria. Toimittanut: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory. Lisenssi: CC BY-SA: Attribution-ShareAlike
- Molekyyligeometria. Toimittanut: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/Molecular_geometry. Lisenssi: CC BY-SA: Attribution-ShareAlike
- VSEPR-teoria. Toimittanut: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR%20Theory. Lisenssi: CC BY-SA: Attribution-ShareAlike
- Molekyyligeometria. Toimittanut: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/Molecular_geometry. Lisenssi: Lisenssi: Lisenssi: Lisenssi: Lisenssi: License: Public Domain:
- VSEPR-geometriat. Provided by: Wikimedia. Sijaitsee osoitteessa: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lisenssi: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Sijaitsee osoitteessa: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lisenssi: Public Domain: Ei tunnettuja tekijänoikeuksia. Lisenssiehdot: YouTube-lisenssi
- Linear-3D-pallot. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lisenssi: CC BY: Attribution
- Molekyyligeometria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/Molecular_geometry. Lisenssi: CC BY-SA: Attribution-ShareAlike
- VSEPR-teoria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory. Lisenssi: CC BY-SA: Attribution-ShareAlike
- VSEPR-teoria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR%20Theory. Lisenssi: CC BY-SA: Attribution-ShareAlike
- Molekyyligeometria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/Molecular_geometry. Lisenssi: Public Domain:
- VSEPR-geometriat. Provided by: Wikimedia. Sijaitsee osoitteessa: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lisenssi: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Sijaitsee osoitteessa: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lisenssi: Public Domain: Ei tunnettuja tekijänoikeuksia. Lisenssiehdot: YouTube-lisenssi
- Linear-3D-pallot. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lisenssi: CC BY: Attribution
- VSEPR Teoria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lisenssi: Public Domain: No Known Copyright
- VSEPR Theory. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Lisenssi: Public Domain: No Known Copyright
- koordinointinumero. Provided by: Wiktionary. Sijaitsee osoitteessa: http://en.wiktionary.org/wiki/coordination_number. Lisenssi: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. 18. syyskuuta 2013. Provided by: OpenStax CNX. Sijaitsee osoitteessa: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Lisenssi: CC BY: Attribution
- Boundless. Provided by: Boundless Learning. Sijaitsee osoitteessa: http://www.boundless.com//chemistry/definition/lone-pair. Lisenssi: CC BY-SA: Attribution-ShareAlike
- Molekyyligeometria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/Molecular_geometry. Lisenssi: Public Domain:
- VSEPR-geometriat. Provided by: Wikimedia. Sijaitsee osoitteessa: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Lisenssi: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Sijaitsee osoitteessa: http://www.youtube.com/watch?v=pA9ML0HVOYE. Lisenssi: Public Domain: Ei tunnettuja tekijänoikeuksia. Lisenssiehdot: YouTube-lisenssi
- Linear-3D-pallot. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Lisenssi: CC BY: Attribution
- VSEPR Teoria. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. License: Public Domain: No Known Copyright
- VSEPR Theory. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. License: Public Domain: No Known Copyright
- VSEPR Theory. Provided by: Wikipedia. Sijaitsee osoitteessa: http://en.wikipedia.org/wiki/VSEPR_Theory. License: Public Domain: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Provided by: Wikimedia. Sijaitsee osoitteessa: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. License: Public Domain: No Known Copyright
kemian malli, jota käytetään ennustamaan yksittäisten molekyylien muotoa perustuen elektroni-parin sähköstaattiseen hylkimiseen
molekyylin tai ionin keskeisen atomin välittömiin naapureihin kuuluvien atomien kokonaismäärä
kaksi (pari) valenssielektronia, joita ei käytetä kovalenttisen sidoksen muodostamiseen