Tausta
Kalium on pehmeä, hopeanvalkoinen erittäin reaktiivinen kationi, joka kuuluu jaksollisen järjestelmän alkalimetallien ryhmään. Se on yleisin kationi koko ihmiskehossa ja yleisin ioni sen solunsisäisissä osastoissa.
Keskimäärin länsimainen ruokavalio sisältää 80-100 mEq kaliumia päivässä, ja normaaleissa fysiologisissa olosuhteissa 90 % kaliumista imeytyy passiivisesti, jolloin ulosteeseen erittyy vain 9,0 mmol. Elimistöön varastoituneet 3500-4000 mmol ovat epäsuhtaisia plasman kaliumpitoisuuksiin nähden, jotka pysyvät normaalisti 3,5-5,3 mmol/l välillä tiukan homeostaasimekanismin avulla, jolloin alhaisimmat tasot ovat yöllä ja varhain aamulla ja korkeimmat huipputasot iltapäivällä.
Kun kalium on imeytynyt verenkiertoon, munuaisten tehtäväksi tulee sovittaa kaliumin saanti kaliumin tuotantoon; tämä vaatii useita tunteja, minkä aikana ”sisäinen kaliumtasapaino” insuliinin ja katekoliamiinien vaikutuksen alaisena ylläpitää väliaikaista homeostaasia siirtämällä kaliumia solunsisäisten ja solunulkoisten tilojen välillä. Alfa-reseptorien stimulaatio heikentää kaliumin pääsyä soluihin, ja beetareseptorien stimulaatio edistää sitä aktivoimalla natrium-kalium-ATPaasi-pumppua.
Natrium-kalium-ATPaasi-pumppu on portinvartijaentsyymi, joka sijaitsee sarkolemmassa. Se auttaa turvaamaan 98 % solun sisälle jäävästä kaliumista (noin 144,0 mmol). Näin varmistetaan solukalvojen välisen elintärkeän potentiaalieron säilyminen, jota tarvitaan solujen, erityisesti hermosolujen ja sydänlihassolujen kaltaisten kiihtyvien solujen, asianmukaiseen toimintaan.
Kaliumin normaali fysiologia ja patofysiologia
Nopean imeytymisensä jälkeen kalium auttaa orkestroimaan elimistön omia tasoja insuliinin ja aldosteronin vapautumisen kautta. Muita elimistön luontaisia ärsykkeitä, joiden on myös todettu säätelevän kaliumin elimistötasoja, ovat beeta-2-adrenergiset reseptorit, veren emäksinen PH-arvo ja solujen anabolismi.
Insuliinin ja aldosteronin vapautuminen: Nautittu kalium pääsee nopeasti verenkiertoon. Saavuttuaan portaalikiertoon se stimuloi haimaa vapauttamaan insuliinia. Samanaikaisesti juxtaglomerulaarisoluihin saapuva kiertävä kalium johtaa reniinin vapautumiseen. Maksassa reniini muuttuu angiotensiini I:ksi. Angiotensiini I kulkeutuu keuhkoihin, jossa se muuttuu angiotensiini II:ksi. Angiotensiini II täydentää sitten matkansa takaisin munuaisiin kiertävän veren kautta stimuloidakseen zona glomerulosaa erittämään aldosteronia.
Sisäinen kaliumtasapaino: Postprandiaalisesti vapautuva insuliini vaikuttaa ensisijaisesti luurankolihaksiin aktivoimalla kaksi reittiä, AKT-riippuvaisen reitin, joka on vastuussa glukoosin kuljettajan GLUT4:n lisäyksestä, ja APK-reitin, joka aktivoi solun natrium-kalium-ATPaasin siirtämään kaliumia solunsisäiseen tilaan. Toisin kuin AKT-riippuvainen reitti, APK-reittiä ei heikennä metabolinen oireyhtymä eikä krooninen munuaissairaus (kuva 1).
Erittyminen: Munuaisten glomerulien suodattama kalium imeytyy passiivisesti takaisin proksimaalisessa tubuluksessa ja Henlen silmukassa suhteessa toimitettuun natrium- ja vesimäärään. Normaalisti vain noin 10 % suodatetusta kuormituksesta pääsee distaaliseen nefroniin.
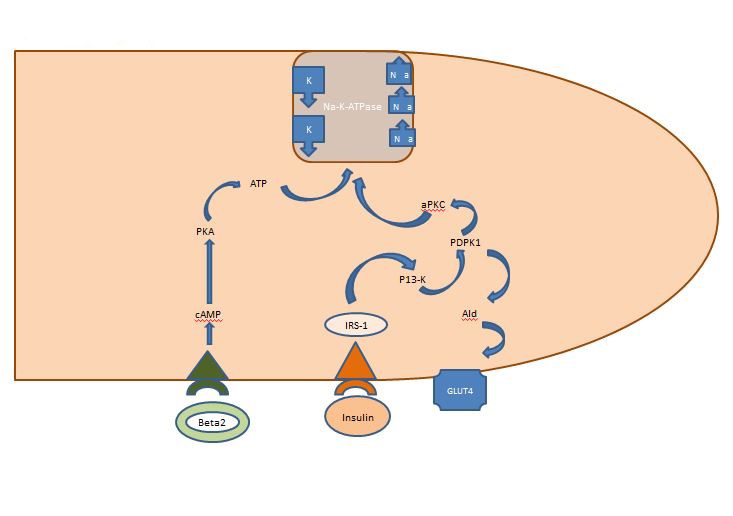
Kuva 1. Insuliinin vaikutus luurankolihassoluun. Postprandiaalisesti vapautuva insuliini aktivoi luurankolihaksissa kaksi reittiä, AKT-riippuvaisen reitin, joka on vastuussa glukoosin kuljettajan GLUT4:n lisäyksestä, ja APK-reitin, joka aktivoi solun natrium-kalium-ATPaasia kaliumin siirtämiseksi solunsisäiseen tilaan.
Distaalisen kierukkatubuluksen alkupäässä ylimääräisen kaliumin erittyminen alkaa, ja se lisääntyy progressiivisesti edetessään yhä pidemmälle kohti distaalista nefronia ja keräyskanavaa. Tätä välittää alfa-interkaloituneiden solujen vetykalium-ATPaasin ylössäätely .
Korkeiden kaliumpitoisuuksien esiintyminen munuaisten peritubulaarisissa soluissa aktivoi RAAS-järjestelmän vapauttamaan aldosteronia, joka aktivoi natrium-kalium-ATPaasia basolateraalisella kalvolla, mikä johtaa solunsisäisen natriumin vähenemiseen, mikä johtaa lisääntyneeseen kaliuminoton sähköiseen kuljetukseen hyperpolarisoimalla kalvojännitettä ja mahdollistamalla sen erittymisen virtsaan .
Hyperkalemiassa paksusuolen kautta erittyvän kaliumin kiintiö voi kasvaa jopa 30 %, esim, munuaisten vajaatoiminnassa, jolloin aktivoitunut natrium-kalium-ATPaasi-pumppu ottaa kaliumin aktiivisesti paksusuolen enterosyyttien basolateraalisella kalvolla, jotta se erittyisi toiselta puolelta paksusuolen luumeniin solujen apikaalisten suurten kalsiumriippuvaisten kaliumkanavien kautta.
Yllä olevasta käy siis ilmi, että kaliumplasman kaliumpitoisuuden homeostaasin mekanismi määräytyy pääasiassa kolmen samanaikaisen tapahtuman – kaliumin saannin, kaliumin solunsisäisten/solunulkoisten siirtymien ja kaliumin virtsaan erittymisen – vuorovaikutuksen perusteella, jotka kaikki viime kädessä tukeutuvat natrium-kaliumpumppuun.
Hyperkalemiasta aiheutuvan välittömän vaaran mekanismin ja sen hallinnan ymmärtämiseksi on ymmärrettävä toimintapotentiaalin fysiologiaa ja natrium-kalium-ATPaasi-entsyymin sisuskaluja.
Toimintapotentiaalin elektrofysiologia, ts, ionien liikkuminen solukalvojen läpi, määräytyy kahden potentiaalin eron perusteella, ”kemiallisen potentiaalin”, jossa ionit liikkuvat pitoisuusgradienttiaan alaspäin, ja ”sähköisen potentiaalin”, jossa ionit ja molekyylit hylkivät samankaltaisia varauksia, jolloin saadaan transmembraanipotentiaali (transmembrane potential, TMP), jonka sanotaan olevan +ve silloin, kun +ve-ionien nettomääräinen liikkuminen suuntautuu solun ulkopuolelle ja päinvastoin.
Tahdistamattoman kardiomyosyytin toimintapotentiaali
Toimintapotentiaalissa on viisi vaihetta, jotka alkavat ja päättyvät vaiheeseen 4. Tähän prosessiin osallistuvat pumput ovat sarkolemman natrium-kalsium-natriuminvaihtaja, kalsium-ATPaasi ja lopulta natrium-kalium-ATPaasi.
- Vaihe 4. Lepovaihe: Tässä vaiheessa lepopotentiaali on -90 mV, mikä johtuu kaliumin jatkuvasta ulospäin suuntautuvasta liikkeestä sisäänpäin tasaavien kanavien kautta. Tämän vaiheen aikana sekä natrium- että kalsiumkanavat ovat kiinni.
- Vaihe 0. Depolarisaatiovaihe: tahdistinsolun laukeaminen tai sen johtuminen naapurisolun kautta käynnistää TMP:n nousun yli -90 mV:n. Tässä vaiheessa , ”nopeat natriumkanavat” alkavat avautua yksi kerrallaan, jolloin natrium pääsee soluun, TMP nousee, ja kun tarpeeksi nopeat natriumkanavat ovat avautuneet, jotta saadaan -70 mV, käynnistyy itseään ylläpitävä sisäänpäin suuntautuva natriumvirta, TMP depolarisoituu nopeasti 0 mV:iin ohimeneväksi hetkeksi, joka tunnetaan nimellä ”overshoot”, jolloin ajasta riippuvaiset nopeat natriumkanavat sulkeutuvat ja ”pitkään avautuvat” kalsiumkanavat avautuvat nostaakseen TMP:n -40 mV:iin ja salliakseen pienen tasaisen kalsiumvirran pitoisuusgradienttia pitkin.
- Vaihe 1. Varhainen repolarisaatiovaihe: Tämä alkaa lievästi +ve TMP:llä ja joidenkin kaliumkanavien lyhytaikaisella avautumisella, jonka seurauksena kalium virtaa solun ulkopuolelle, jolloin TMP palautuu takaisin noin 0 mV:iin.
- Vaihe 2. Tasovaihe: Tässä kaksi vastavirtaa ovat sähköisesti tasapainossa ja johtavat TMP:n pysymiseen tasapainossa hieman alle 0 mV:n. ”Pitkään aukeavat kalsiumkanavat” ovat edelleen auki, mikä johtaa jatkuvaan kalsiumvirtaan soluun. Viivästyneen tasasuuntaajan kaliumkanava mahdollistaa kaliumin kulun solun ulkopuolelle sen konsentraatiogradienttia pitkin.
- Vaihe 3. Repolarisaatiovaihe: Tässä vaiheessa kalsiumkanavat inaktivoituvat vähitellen, jolloin kaliumin jatkuva virtaus solun ulkopuolelle ylittää sisäänpäin suuntautuvan kalsiumvirtauksen, jolloin kalium palaa solunsisäiseen tilaan ja natrium ja kalsium solun ulkopuolelle.
Sydämen tahdistinsolun toimintapotentiaali
Sydämen tahdistinsoluilla on synnynnäinen automatiikka, joka sallii niiden depolarisoitumisen rytmikkäissä sykleissä. Sinoatriosolmukkeella (SAN) on korkein itsestään käynnistyvä depolarisaatiorytmi 60-90/min, seuraavaksi korkein on eteis-kammiosolmuke (AVN) 40-60/min ja sitten Purkinje-kuidut ja kammiolisäke 20-40/min.
Tahdistinsolujen kalvopotentiaalit ovat epästabiileja, eikä niiden toimintapotentiaaleilla ole selkeitä vaiheita. Niissä on vähemmän sisäänpäin oikaisevia kaliumkanavia ja niiden TMP ei koskaan laske alle -60 mV:n, mikä poistaa nopeiden natriumkanavien roolin, jotka vaativat -90 mV:n TMP:n, mikä johtaa nopean depolarisaatiovaiheen puuttumiseen.
TMP:n ollessa >-60 mV ”hassu/tahdistin”-virta käynnistyy spontaanilla ionivirtauksella hitaiden natriumkanavien kautta, mikä depolarisoi TMP:n <-50 mV:iin ja palaa sitten takaisin -60 mV:iin kalsiumkanavien sulkeutuessa.
Virran johtuminen
Kaikki kardiomyosyytit ovat sähköisesti kytkeytyneitä rakokytkennän (gap junctionin) välityksellä, mukaan luettuna myös tahdistinsolu. Tämä helpottaa kaikkien viereisten solujen laajaa depolarisaatiota, jolloin sydämestä tulee yksi toiminnallinen yksikkö, jossa solusta, jolla on korkein perinnöllinen syketaajuus, tulee ”tahdistin”.
Taukojakso
Hitaiden kalsiumkanavien aiheuttama pidempi taukojakso vaiheen 2 pitkän tasangon aikana antaa tarvittavan ajan kammioiden täydelliseen tyhjenemiseen ennen seuraavaa supistusta. Tulenkestoajat voivat olla absoluuttisia (ARP), tehokkaita (ERP) tai suhteellisia (RRP). ARP:ssä solu on absoluuttisesti heräämätön.
ERP kestää ARP:stä vaiheen 3 lyhyeen segmenttiin saakka. Ärsyke tässä vaiheessa voi minimaalisesti depolarisoida solun, mutta depolarisaation taso on heikompi kuin toimintapotentiaalin eteneminen naapurisoluihin.
RP:n saa aikaan normaalia suurempi ärsyke, joka johtaa solun depolarisaatioon ja toimintapotentiaalin syntymiseen.
Normaalin ylittävä jakso on yliherkistyvä tila, jonka aikana normaalia heikompi ärsyke voi johtaa rytmihäiriöön, mikä edellyttää synkronointia kardioversion aikana kammiovärinän välttämiseksi (kuva 2).
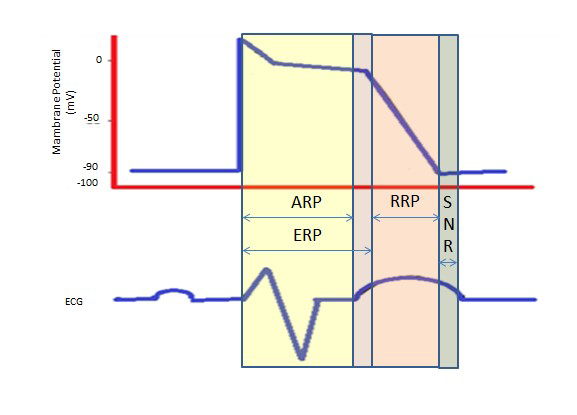
Kuva 2. Kammiovärinä. Refraktoriset jaksot. ARP: Absoluuttinen refraktorinen jakso; ERP: Effective Refractory Period; RRP: Relative Refractory Period; SNR: Supranormal Refractory Period
Hyperkalemia, luokittelu ja syyt
Luokittelu
Hyperkalemia luokitellaan lieväksi, kun pitoisuudet ovat välillä 5,5-6,0 mmol/l, keskivaikeaksi, kun pitoisuudet ovat välillä 6,1-6,9 mmol/l ja vaikeaksi, kun pitoisuudet ovat välillä 7.0 mmol/L tai suuremmilla tasoilla ja kaikilla tasoilla, joilla esiintyy EKG-muutoksia.
Syyt
Hyperkalemia syntyy, kun kompensaatiomekanismit eivät enää kykene selviytymään epätasapainosta, minkä vuoksi se on yleensä monitekijäinen.
- Kaliumin saannin lisääntyminen mitä tahansa reittiä kautta, esim, ravinnon kautta suun kautta tai kaliumia sisältävien nesteiden, kuten penisilliini G:n, laskimonsisäinen anto.
- Pidätys munuaisten toimesta: Koska kaliumin erittyminen riippuu aldosteronista ja riittävän distaalisen natrium- ja vesimäärän toimittamisesta nefronien sisällä, tilat, kuten munuaisten vajaatoiminta, lisämunuaisen vajaatoiminta (Addisonin tauti) , hyporenineeminen hypoaldosteronismi tyyppi IV, munuaisten tubulaarinen asidoosi, erityisesti diabeettista nefropatiaa sairastavilla potilailla, sekä kaikki tilat, jotka edistävät hypoperfuusiota, kuten tilavuuden väheneminen ja kongestiivinen sydämen vajaatoiminta, vaikuttavat kaliumin monimutkaiseen tasapainoon elimistössä ja altistavat hyperkalemialle.
- Munuaisten vajaatoiminta: tämä on suljettava pois hyperkalemiapotilailla, erityisesti jos esiintyy hyponatremiaa ja lihasheikkoutta. Primaarisen lisämunuaisen vajaatoiminnan seulomiseksi tehdään vakiomuotoinen kosyntropiinistimulaatiokoe, jossa annetaan 0,25 mg synteettistä kosyntropiinia laskimonsisäisenä boluksena, minkä jälkeen plasman kortisoli mitataan 45 minuuttia tai 1 tunti myöhemmin. Alle 20 mcg/dl:n arvot viittaavat lisämunuaisen vajaatoimintaan.
- Kaliumia pidättävät lääkkeet: Reseptilääkkeet, jotka vähentävät natrium-kalium-ATPaasi-aktiivisuutta, kuten beeta-adrenergisten reseptorien salpaajat, ja lääkkeet, jotka vähentävät aldosteronin eritystä, kuten ACE:n ja ARB:n estäjät, ei-steroidiset tulehduskipulääkkeet ja kaliumia säästävät diureetit, vaativat tarkkaa seurantaa, jotta vältyttäisiin iatrogeeniselta hyperkalemialta, erityisesti geriatrisessa ikäryhmässä, jonka munuaistoiminta vähitellen heikentyy ikääntymiskehityksen myötä.
- Häiriöt kaliumin transsellulaarisessa siirtymässä: tätä voi esiintyä asidoosin, hyperglykemian, hyperosmolaliteetin, raskaan liikunnan, kudoksen hajoamisen, hyperkalemisen jaksottaisen halvauksen ja beeta-adrenergisten salpaajien yhteydessä. Jokaista veren PH-arvon 0,1 yksikön laskua kohden seerumin kaliumpitoisuus nousee noin 0,6 mmol/l (vähemmän, jos asidoosi johtuu orgaanisista hapoista) .
- Pseudo-hypoaldosteronismi on synnynnäinen autosomaalinen resessiivinen sairaus, jossa munuaiset ovat vastustuskykyisiä aldosteronin vaikutuksille.
- Pseudo-hyperkalemiaa ei saa myöskään jättää huomiotta: kuten nimikin kertoo, se ilmenee, kun seerumin kaliumpitoisuus on koholla, vaikka plasman kaliumpitoisuus on normaali. Sitä voi esiintyä hemolysoituneessa veressä, pitkittyneessä tiukassa kiristyssiteessä verinäytteenoton aikana, jolloin kaliumia vapautuu solunulkoisesti, toistuvassa nyrkin puristuksessa flebotomian aikana, traumaattisessa laskimopunktiossa, leukosytoosin ja trombosytoosin yhteydessä sekä joissakin harvinaisissa geneettisissä oireyhtymissä, kuten familiaalisessa pseudo-hyperkalemiassa ja perinnöllisessä sferosytoosissa. Se voi kuitenkin olla yksinkertaisesti vain yksinkertaisen laboratoriovirheen tulos.
Hyperkalemian vaikutukset
Lievä hyperkalemia on usein oireeton, ja se havaitaan vahingossa laboratoriokokeilla sen epämääräisten oireiden, kuten huonovointisuuden, lihasheikkouden ja parestesian vuoksi. Vaikea hyperkalemia vaikuttaa neuromuskulaariseen toimintaan luurankolihasten heikkoutena ja halvaantumisena; tämä ei kuitenkaan ole yleinen esitys, koska sydäntoksisuus hallitsee kuvaa ja on alustava esitys. Sydäntoksisuus näkyy EKG:ssä yleensä seuraavalla asteittain eskaloituvalla tavalla, vaikkei se välttämättä olekaan näin etiologiasta riippuen:
- Tasoilla, jotka ovat suurempia kuin 5,5 mEq/L, kaliumkanavien johtokyvyn kasvu lisää lkr-virtaa, mikä johtaa nopeaan repolarisaatioon huippu-T-aallon muodossa pinta-EKG:ssä. Nämä T-aallot voidaan erottaa sydäninfarktin ja aivoverenkiertohäiriön aiheuttamista aalloista niiden lyhyen keston perusteella, joka on 150-250 sekuntia.
- Kun kaliumpitoisuudet ovat yli 6,5 mEq/L, syntyy jatkuva subthreshold-depolarisaatiotila, joka aiheuttaa eteis- ja kammiodepolarisaation viivästymisen. Toimintapotentiaalin 0-vaiheen pieneneminen johtaa pidempään toimintapotentiaaliin, mikä aiheuttaa viiveen kammionsisäisessä ja eteis-kammioperäisessä johtumisessa. Pinta-EKG:ssä tämä näkyy P-aaltojen litistymisenä ja häviämisenä sekä QRS-kompleksien levenemisenä. Kun intraventrikulaarisen johtumisen viive lisääntyy, pinta-EKG:ssä alkaa näkyä merkkejä vasemman ja oikean kammihaaran estosta. Tämä voidaan erottaa kimppuhaaran taudista sen perusteella, että hyperkalemiassa viive jatkuu koko QRS-kompleksin ajan, eikä vain sen alku- tai loppuosissa.
- Kun arvo on 10 mEq/L, sinoatriumjohtumista ei enää tapahdu, ja kiihtynyt junktionaalinen rytmi ottaa vallan. Kammioperäiset rytmihäiriöt kehittyvät laajenevien QRS-kompleksien sulautuessa T-aaltoihin ja muodostaen lopulta klassisen siniaaltokuvion. Kun tämä tapahtuu, VF ja asystole ovat uhkaavia ja sydänpysähdys seuraa.
- Joskus muutokset voivat olla ailahtelevia ja arvaamattomia ja EKG hyppää normaalista asystoleen johtuen etiologisten tekijöiden ja niiden vaikuttavien vaikutusten vaihtelusta, esimerkiksi kaliumin muutosnopeudesta, kalsiumpitoisuudesta, pH:sta ja natriumpitoisuudesta. Näin ollen hyperkalemiaa on hoidettava kiireellisesti aina, kun kaliumpitoisuus nousee yli 6,5 mmol/l, tai jos EKG:ssä ilmenee hyperkalemian merkkejä kaliumpitoisuudesta riippumatta. Muita raportoituja akuuttiin hyperkalemiaan liittyviä yhteyksiä ovat: pseudo MI:n kuva EKG-tallenteessa, jossa on massiivinen ST-T-segmentti sydänlihassolujen repolarisaation häiriöiden seurauksena, lyhyet PR- ja QT-intervallit, sinustakykardia, sinusbradykardia, idioventrikulaarinen rytmi, 1. ja 2. asteen sydämen blokki .
Metaboliset vaikutukset
Hyperkalemia johtaa hyperklimakemialliseen metaboliseen asidoosiin, koska hyperkalemia edistää kaliumin solunsisäistä ottoa vetyionien tilalle. Tämä luo solunsisäisen alkaloosin, joka estää munuaisten ammoniakkituotantoa proksimaalisissa tubuluksissa, mikä johtaa virtsan ammonium- ja happoerityksen vähenemiseen ja tyypin IV munuaistubulusasidoosiin .
Natrium-kaliumpumppu
Natrium-kalium-ATPaasin löysi vuonna 1957 Skou, joka sai myöhemmin osuuden vuoden 1997 kemian Nobel-palkinnosta löydöstään.
Skou löysi ensimmäisenä natrium-kalium-ATPaasin sydänlihaksen solupinnan sarkolemmasta. Myöhemmin sen esiintyminen havaittiin jokaisessa eukaryoottisessa yksi- ja monisoluisessa organismissa.
Natrium-kaliumpumppu toimii yhdistämällä ATP:n hydrolyysin kolmen natriumionin soluvientiin kahta kaliumionia vastaan niiden sähkökemiallisia gradientteja vastaan. Se on digitaliksen ja digoksiinin molekyylikohde, joita on käytetty jo 1700-luvulta lähtien ketunhattuuutteina.
Natriumkaliumpumpun toimintaa säätelee fosfoproteiinifosfolemman, jonka fosforyloimattomuus johtaa pumpun estymiseen ja fosforylointi pumpun aktiivisuuden lisääntymiseen. Sillä on kolme fosforylaatiokohtaa, kaksi palmitoylaatiokohtaa ja yksi glutathionylaatiokohta, mikä selittää niiden signaalien moninaisuuden, jotka kykenevät stimuloimaan ja inhiboimaan pumppua.
Natriumkaliumpumppu itsessään on entsyymi, joka koostuu useista alayksiköistä, joilla on useita isoformeja. Alfa- ja beeta-alayksiköiden (pääasiassa B1 sydämessä) läsnäolo on välttämätöntä sen toiminnalle. Viime aikoina munuaisissa on tunnistettu kolmas proteiinin gamma-alayksikkö, mutta toistaiseksi sen funktio on tuntematon.
Alfa-alayksikkö on natriumkaliumpumppuentsyymin katalyyttinen ydin. Se on noin 100 kDa:n kokoinen ja sisältää natriumin, kaliumin, ATP:n ja kardiotonisten steroidien, kuten ouabainin, sitoutumiskohdat. Ainoastaan alfa 1 ja alfa 2 esiintyvät merkittävästi normaaleissa sydänlihassoluissa, ja ne ovat toiminnallisesti yhteydessä natrium-kalsiuminvaihtimeen (NCX). Alfa 3:n on raportoitu korvaavan alfa 2:n kokeellisissa sydämen vajaatoimintamalleissa.
Viimeaikaisista kokeista saadut tiedot puoltavat pumpun molempien alfa 1 alfa 2 -alayksiköiden osallisuutta heräte-kontraktiokytkennän (E-C) säätelyssä. Alfa 1:n, jonka havaittiin olevan tasaisemmin jakautuneena koko sarkolemmassa, ajatellaan olevan enemmän ”taloudenhoitotehtävissä” säätelemässä sekä supistuvuutta että solunsisäisen natriumin määrää, kun taas alfa 2:n, jonka ilmentyminen on keskittynyt T-tubuluksiin yhdessä muiden E-C-kytkennän avainkomponenttien kanssa, ajatellaan keskittyvän pääasiassa supistuvuuteen .
Tunnettuja tekijöitä, jotka voivat kontrolloida natriumkaliumpumppua, ovat muun muassa: ATP, solunsisäinen natrium, sub-sarcolemmaaliset esteet ja sumeat tilat, kalvopotentiaali, solunsisäiset signaalireitit (adrenergiset signaalireitit, proteiinikinaasi A & C, typpioksidi, fosfolemmaani), pienten molekyylien suora säätely (lipidit, endogeeniset kardiotoniset steroidit), muut assosioituneet proteiinit (kaveolae- ja kaveoliinit sekä ankyriini).
Johtopäätös
Hyperkalemia on kliininen haaste, ja sitä voi esiintyä jopa 10 %:lla sairaalapotilaista . Sen lopputulos on hengenvaarallinen. Koska natrium-kaliumpumppu vaikuttaa viime kädessä kaikkiin kehon soluihin, ja iskeemisten sydänlihasten tiedetään purkautuvan kaliumia solunulkoisesti, mikä johtaa rytmihäiriökynnyksen alenemiseen, jolloin on mahdollista, että kammioperäiset rytmihäiriöt pahentavat hypopolarisaatiota ja alentavat kynnystä entisestään, on keskityttävä useampiin tutkimuksiin, jotka kohdistuvat natrium-kalium-entsyymin manipulointiin, koska sen hallinta voisi muuttaa suotuisasti sydänpysähdyksien lopputulosta ja uudelleenkirjoittaa nykyiset elvytysohjeet.