Atomit voivat saada tai menettää elektroneja muodostaakseen ioneja ionisaatioksi kutsutussa prosessissa (näin muodostuvia yhdisteitä kutsutaan ionisiksi yhdisteiksi). Kun ioniset yhdisteet liukenevat veteen, niiden ionit irtoavat toisistaan prosessissa, jota kutsutaan dissosiaatioksi. Yksi veden ja monien muiden kovalenttisten yhdisteiden mielenkiintoinen ominaisuus on, että myös ne voivat dissosioitua ioneiksi. Toisin kuin ioniset yhdisteet, kuten natriumkloridi, niitä ei ionisoida ennen kuin ne dissosioituvat, vaan ne suorittavat ionisaation ja dissosioitumisen samanaikaisesti.
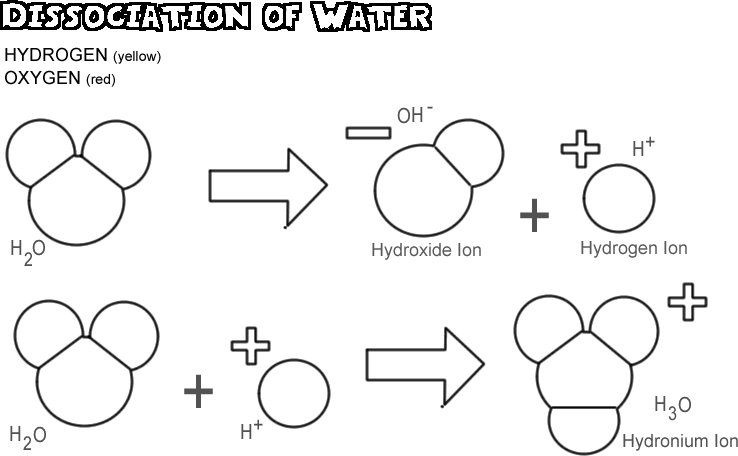
Veden dissosiaatio
Veden dissosioituessa yksi vetyydin jättää elektroninsa happiatomin kanssa ja muuttuu vetyioniksi, kun taas happi- ja muut vetyatomit muuttuvat hydroksidi-ioniksi. Koska vetyionilla ei ole elektronia, joka neutraloisi sen protonin positiivisen varauksen, sillä on täysi yksikkö positiivista varausta, ja sen symboli on H+. Hydroksidi-ionilla säilyy jäljelle jäänyt elektroni, joten sillä on täysi yksikkö negatiivista varausta, ja sen symboli on OH-. Vetyioni (protoni) ei vaella kauan itsekseen, ennen kuin se kiinnittyy toisen ionisoimattoman vesimolekyylin happiatomiin muodostaen hydroniumionin (H3O +)
Missä tahansa vesinäytteessä hyvin harvat molekyylit dissosioituvat kerrallaan: itse asiassa vain noin yksi 550 miljoonasta. Muutos on kuitenkin jatkuvaa; kun yksi vetyioni kiinnittyy uudelleen hydroksidi-ioniin muodostaen vesimolekyylin, toinen vesimolekyyli dissosioituu korvaten vetyionin ja hydroksidi-ionin liuoksessa.
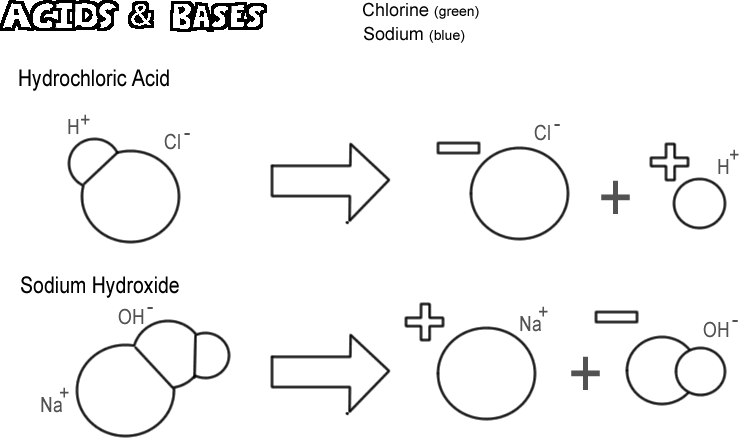
Kloorivetyhappo
Tietyt molekyylit, sekä ioniset että kovalenttiset, dissosioituvat siten, että ne vapauttavat vetyionin vapauttaen hydroksidi-ionin. Näitä aineita kutsutaan hapoiksi. Koska vetyioni on useimmissa tapauksissa oikeastaan vain yksi protoni, kemistin määritelmän mukaan happo on ”protoninluovuttaja”. Jos hyvin monta protonia (vetyionia) ”luovutetaan”, vaikutus voi olla hyvin voimakas, kuten ihon polttaminen tai metallin liuottaminen. Kuvassa oleva happo on suolahappo. Puhdas suolahappo on kaasu, mutta se liukenee helposti veteen muodostaen vetyionin ja kloridi-ionin liuoksen. Koska se liukenee lähes kokonaan veteen, sitä kutsutaan vahvaksi hapoksi. Happoja, jotka eivät dissosioidu kokonaan, kutsutaan heikoiksi hapoiksi.
Natriumhydroksidi
Hapon vastakohta on emäs, jota kutsutaan myös emäkseksi. Tyypillinen vahva emäs on natriumhydroksidi, joka on lipeän pääkomponentti. Natriumhydroksidi dissosioituu muodostaen natriumionin ja hydroksidi-ionin. Emäs määritellään ”protonien hyväksyjäksi”. Yleisimmät emäkset tuottavat dissosioidessaan hydroksidi-ionin, ja juuri hydroksidi-ioni ottaa protonin vastaan. Vahva emäs voi aiheuttaa ihollesi paljon pahemman palovamman kuin happo.
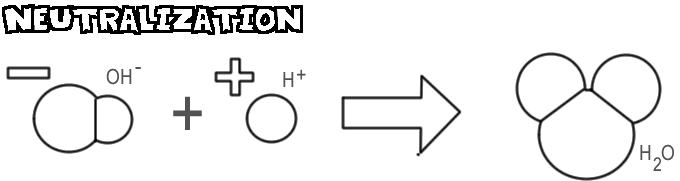
Neutraloituminen
Kun emäs ja happo sekoittuvat, emäksen hydroksidi-ioni yhdistyy hapon vetyionin kanssa muodostaen vettä. Tätä prosessia kutsutaan neutraloinniksi.
Kysymykset:
1. Mitä tapahtuu, kun atomi saa tai menettää elektronin?