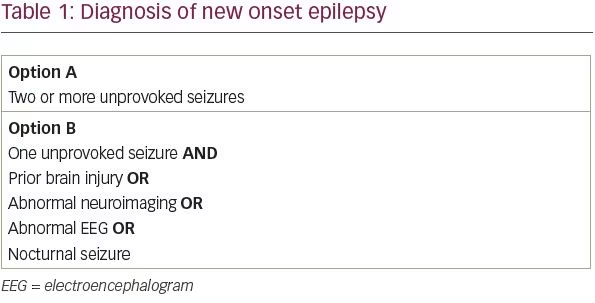
International League Against Epilepsy (ILAE) tarkisti epilepsian määritelmäänsä vuonna 2014 maksimoidakseen epilepsiapotilaiden varhaisen tunnistamisen ja hoidon.1 ILAE:n epilepsian käsitteellinen määritelmä, joka muotoiltiin ensimmäisen kerran vuonna 2005, on ”aivojen häiriö, jolle on ominaista pysyvä taipumus tuottaa epileptisiä kohtauksia”. Käytännössä tämä määritelmä vastasi potilaita, joilla oli kaksi tai useampia provosoimattomia kohtauksia yli 24 tunnin välein. Tiedämme kuitenkin, että kaikki potilaat, joilla on yksi provosoimaton kohtaus, eivät saa yhtä todennäköisesti toista kohtausta. Uuden ILAE:n määritelmän mukaan potilaat, joilla on yksittäinen provosoimaton kohtaus ja joiden toistuvan kohtauksen todennäköisyys on yli 60 %, täyttävät nyt epilepsiadiagnoosin kriteerit.
Systemaattisessa katsauksessa tutkimuksista, joissa arvioitiin yksittäisen provosoimattoman kohtauksen jälkeisen kohtauksen uusiutumisriskiä, 21-45 %:lla potilaista esiintyi toinen provosoimaton kohtaus kahden ensimmäisen vuoden aikana.2 Käytännön näkökulmasta on tunnistettu neljä riskitekijää, jotka noin kaksinkertaistavat potilaan riskin kohtauksen uusiutumiseen: aiempi aivovamma, epänormaali neurokuvantamislöydös, joka vastaa epäiltyä kohtauskeskittymää, fokaaliset tai yleistyneet epileptiformiset purkaukset sähköenkefalogrammissa (EEG:ssä) tai yöllinen kohtaus3.-6 Siten potilailla, joilla on yksittäinen provosoimaton kohtaus ja vähintään yksi näistä neljästä riskitekijästä, on todennäköisesti yli 60 %:n todennäköisyys kohtauksen uusiutumiseen, ja heillä voidaan diagnosoida epilepsia (taulukko 1).
Vaikka eräässä varhaisessa suuressa tutkimuksessa esitettiinkin, että epänormaali neurologinen tutkimus liittyi suurentuneeseen riskiin kohtauksen uusiutumiseen, saman ryhmän seurantatutkimuksessa ei todettu riskin lisääntyneen.3,7 Samassa seurantatutkimuksessa todettiin, että epilepsiaa sairastavan sisaruksen olemassaolo lisää epilepsian uusiutumisriskiä idiopaattista epilepsiaa sairastavilla potilailla, mutta näilläkin potilailla uusiutumisriski on vain 46 % viiden vuoden kuluttua. Näin ollen neurologiset tutkimustulokset ja epilepsian sukuhistoria on otettava huomioon arvioitaessa potilasta, jolla on ensimmäinen kohtaus, mutta nämä ominaisuudet eivät yksin riitä epilepsiadiagnoosin tekemiseen.
Epilepsialääkehoidon huomioon ottaminen uudessa epilepsiassa
Useimmissa varhaisissa tutkimuksissa, jotka koskivat kohtausten uusiutumista ensimmäisen provosoimattoman kohtauksen jälkeen, oli mukana sekä epilepsialääkkeillä hoidettuja että hoitamattomia potilaita, minkä vuoksi on vaikea arvioida todellista toistuvien kohtausten riskiä. FIRST-tutkimuksessa todettiin, että 51 %:lla potilaista, jotka eivät aloittaneet AED-hoitoa ensimmäisen kohtauksen jälkeen, ilmeni uusi kohtaus kahden vuoden kuluessa, kun taas vain 25 %:lla niistä potilaista, jotka aloittivat AED-hoidon, ilmeni uusi kohtaus samassa ajassa.8 Myöhemmät tutkimukset ovat kuitenkin osoittaneet, että vaikka AED-hoito pienentääkin kohtauksen uusiutumisriskiä ensimmäisten kahden vuoden kuluessa ensimmäisestä kohtauksesta, sillä ei ole vaikutusta pitkäaikaisen kohtausremissiotaipumuksen tai elämänlaadun esiintymistodennäköisyyteen.9,10,10. Koska varhainen AED-hoito ei taatusti muuta potilaan kokonaistulosta eikä AED-lääkkeet ole täysin hyvänlaatuisia lääkkeitä, kaikki potilaat, joilla diagnosoidaan epilepsia, eivät päätä aloittaa hoitoa heti.
Kaikki päätökset AED-hoidosta olisi tehtävä yhteistyössä potilaan kanssa sen jälkeen, kun on keskusteltu perusteellisesti riskeistä ja hyödyistä, ja punnittu kouristuskohtausten haittojen riskiä AED-lääkkeiden mahdollisia haittavaikutuksia vastaan. Kohtaustyyppi, johon liittyy suurempi vahingon tai kuoleman riski, kuten toonis-klooniset kohtaukset tai status epilepticus, voi olla yksi tekijä, joka vaikuttaa potilaan ja lääkärin päätökseen siitä, aloitetaanko AED-hoito.11-13
Epilepsiatyypin määrittäminen
Potilaan epilepsiatyypin – fokaalisen tai yleistyneen epilepsiatyypin – määrittäminen alkuperäisen diagnoosin yhteydessä on tärkeää, koska se auttaa ennustamaan ennustetta ja ohjaamaan sopivan AED-lääkkeen valintaa. Tämä määritys tehdään yleensä kohtausten semiologian sekä magneettikuvauksen (MRI) ja EEG-löydösten perusteella. Lateralisoituneet motoriset tai sensoriset oireet, silmien pakotettu poikkeaminen tai pään kääntyminen, automatismit, kielelliset häiriöt ja kokemukselliset ilmiöt viittaavat fokaaliseen puhkeamiseen, kun taas bilateraalinen myoklooninen nykiminen tai alun perin bilateraalinen tooninen aktiviteetti viittaavat generalisoituneeseen puhkeamiseen.
Pelkkä semiologia voi kuitenkin olla harhaanjohtava: fokaalisista kohtauksista voi puuttua lateralisoivia piirteitä puhkeamishetkellä, ja yli puolella generalisoitunutta epilepsiaa sairastavista potilailta on myös fokaalisia kohtausoireita.14 Lisäksi kolme neljäsosaa fokaalista epilepsiaa sairastavista potilaista on amnestisia ainakin joidenkin kohtausten osalta, ja 30 % on amnestisia kaikkien kohtausten osalta.15 Lisäksi jopa 60 %:lla potilaista ei ole kohtauksia edeltävää auraa.16 Nämä tekijät tekevät epilepsian diagnosoinnista ja karakterisoinnista haastavaa monilla potilailla.
Useimmille potilaille, joilla on ensikohtaus, olisi tehtävä magneettikuvaus, jollei vasta-aiheita ole. Magneettikuvauksella on suurempi saanto kuin tietokonetomografialla (TT) fokaalisten epileptogeenisten leesioiden havaitsemisessa.17-19 Fokaalisen leesion olemassaolo voi vahvistaa fokaalisen alkamisen, jos leesion sijainti vastaa potilaan semiologiaa. Potilailla, joilla on selkeä sähkökliininen primaarinen yleistynyt epilepsiaoireyhtymä, kuten juveniili myokloninen epilepsia, neurokuvantamista ei välttämättä tarvita.
Jos tehdään magneettikuvaus, suositeltuihin sekvensseihin kuuluu 3D-T1-sekvenssi, jossa on 1 mm:n isotrooppisia viipaleita (esim, magnetisaatiovalmis nopea gradienttikaiku ), aksiaaliset ja koronaaliset T2- ja FLAIR-sekvenssit, joissa on ≤3 mm:n viipaleita, ja aksiaalinen T2*-sekvenssi hemosideriinin ja kalkkeutumisen havaitsemiseksi (esim. suskeptibiliteettipainotteinen kuvantaminen tai gradienttikaiku ).20 Kontrastiaineita ei tarvita kaikilta potilailta, mutta sitä olisi harkittava yli 50-vuotiailta potilailta, koska tässä ikäryhmässä on suurempi todennäköisyys saada etäpesäkkeitä sisältäviä tai primaarisia aivokasvaimia. Mahdollisuuksien mukaan suositaan 3 Teslan magneettikuvausta 1,5 Teslan magneettikuvauksen sijaan, koska se on herkempi epileptogeenisille vaurioille.21,22 Viime aikoina 7 Teslan magneettikuvauslaitteet ovat lisänneet herkkyyttä entisestään, mutta niitä on yleensä saatavissa vain tutkimusprotokollien kautta.23
EEG on toinen olennainen modaliteetti, jonka avulla voidaan diagnosoida ja luonnehtia vasta alkanutta epilepsiaa. Yksittäinen rutiini-EEG voi olla riittämätön epileptiopoikkeavuuksien havaitsemiseksi; äskettäin tehdyssä 15 tutkimuksen meta-analyysissä todettiin, että rutiini-EEG:n herkkyys oli 17 %.24 Saannon lisäämiseksi lääkäreiden olisi harkittava pidennetyn 60-minuuttisen EEG:n, univajeesta riippuvaisen EEG:n tai jopa kolmen sarjamuotoisen rutiini-EEG:n suorittamista.25-27 Ambulatoriset EEG-tallenteet lisäävät myös epileptiformisten poikkeavuuksien havaitsemisen todennäköisyyttä; pidennetyn tallennuksen hyödyt vähenevät 48 tunnin jälkeen, sillä 95 prosenttia poikkeavuuksista havaitaan tässä ajassa.28 . Sairaalahoidossa tehtävää video-EEG-tutkimusta voidaan harkita tietyissä tilanteissa, kuten epileptisten kohtausten erottamiseksi psykogeenisistä ei-epileptisistä kohtauksista.29
Epilepsialääkkeen valinta – fokaalinen epilepsia
SANAD-tutkimus – uuden fokaalisen epilepsian ensilinjan lääkehoito
Uuden fokaalisen epilepsian AED-hoidon tavoitteena uudessa epilepsiatapauksessa on saada kohtaukset hallintaan yhdellä ainoalla ainoalla AED-lääkkeellä siten, että samalla vähennetään mahdollisimman vähän sivuvaikutuksia. Vaikka fokaalisen epilepsian hoitoon on saatavilla monia lääkkeitä, niiden tehoa ja siedettävyyttä vertailevia kontrolloituja tutkimuksia on vähän. Vuonna 2007 julkaistu SANAD-tutkimus oli uraauurtava tutkimus, johon osallistui 1 721 potilasta, joilla oli fokaalinen epilepsia ja jotka satunnaistettiin karbamatsepiini-, gabapentiini-, lamotrigiini-, okskarbatsepiini- tai topiramaattihoitoon.30 Ensisijainen päätetapahtuma oli aika, joka kului hoidon epäonnistumiseen, joka määriteltiin siten, että lääkkeen annostelu lopetettiin kontrolloimattomien epilepsiakohtausten tai haittavaikutusten vuoksi. Lamotrigiini oli merkitsevästi parempi kuin karbamatsepiini, gabapentiini ja topiramaatti ja ei merkitsevästi parempi kuin okskarbatsepiini. Karbamatsepiini oli kuitenkin merkitsevästi parempi kuin gabapentiini ja ei-merkitsevästi parempi kuin lamotrigiini, topiramaatti ja okskarbatsepiini, kun tarkastellaan aikaa 12 kuukauden remissioon.30
SANAD-tutkimuksen tulokset viittaavat siihen, että lamotrigiini on paras fokaalisen epilepsian ensilinjan hoito sen tehon ja siedettävyyden yhdistelmän vuoksi, ja karbamatsepiini on kohtuullinen vaihtoehto potilailla, jotka pystyvät sietämään sitä.
Uudet epilepsialääkkeet fokaalisen epilepsian ensilinjan hoitoon
Sanad-tutkimuksen julkaisemisen jälkeen markkinoille on tullut useita uusia fokaalisen epilepsian lääkkeitä. Vaikka kaikkia näitä lääkkeitä tutkittiin alun perin liitännäishoitoina, monia niistä käytetään nykyään monoterapiana, ja joitakin, erityisesti levetirasetaamia, käytetään nykyään yleisesti ensilinjan hoitona. Näiden uudempien lääkkeiden suurena etuna on se, että annoksia voidaan nostaa nopeasti potilailla, joilla on usein kohtauksia, ilman Stevens-Johnsonin oireyhtymän riskiä, joka on lamotrigiinin ja vähäisemmässä määrin karbamatsepiinin tunnettu haittavaikutus.
Neista uusista AED-lääkkeistä neljää – levetirasetaamia, zonisamidia, lakosamidia ja eslikarbatsepiiniä – on vertailtu satunnaistetuissa, kontrolloiduissa tutkimuksissa vanhoihin vaihtoehtoisiin terapiamuotoisiin lääkkeisiin, kuten taulukossa 2 esitetään.31-41 Tutkimukset tunnistettiin käyttämällä PubMedin kliinisten tutkimusten suodatinta ja hakusanoja ”monotherapy” ja ””, ja ne otettiin mukaan, jos niissä tutkittiin aikuispotilaita, joilla oli fokaalinen epilepsia ja joissa verrattiin uudempaa AED-lääkettä johonkin tavallisista AED-lääkkeistä (jotka sisältyivät SANAD-tutkimukseen).
Neljästä uudesta AED-lääkkeestä levetirasetaami on parhaiten tutkittu ja yleisimmin määrätty; siitä on tullut suurelta osin oletusarvoinen ensilinjan AED-lääke uudessa epilepsiassa sen helpon titrauksen ja suotuisan sivuvaikutusprofiilin vuoksi. Levetirasetaami on nyt yleisimmin määrätty ensilinjan AED-valmiste iäkkäille aikuisille, ja sen osuus lääkemääräyksistä on 45,5 prosenttia.42 Tutkimukset ovat osoittaneet, että levetirasetaamilla on samanlainen teho verrattuna vanhempiin AED-lääkkeisiin, joskin se oli yhden tutkimuksen alaryhmäanalyysissä huonompi kuin karbamatsepiini (taulukko 2).
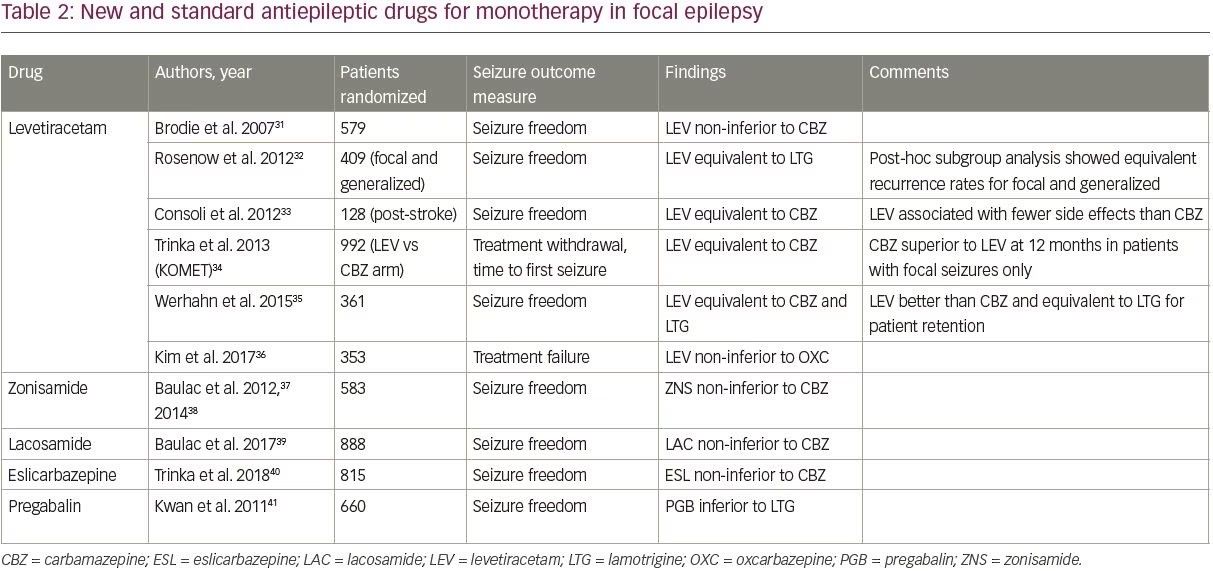
Tärkeää on, että vain kahdessa tutkimuksessa verrattiin levetirasetaamia lamotrigiiniin; molemmissa tutkimuksissa todettiin, että molemmilla lääkkeillä oli samankaltainen teho.32,35 Parhaillaan on käynnissä SANAD II -tutkimuksen fokaalista epilepsiaa käsittelevä haara, josta tulee suurin tutkimus, jossa verrataan levetirasetaamin ja lamotrigiinin pitkäaikaista tehoa ja siedettävyyttä (ISRCTN30294119).
Levetirasetaamin lisäksi laadukkaita tietoja, joissa arvioidaan uusia aktiivihappoehkäisytehtaalilääkkeitä monoterapiana, on vähän. Zonisamidin, lakosamidin ja eslikarbatsepiinin on kussakin yksittäisessä tutkimuksessa osoitettu olevan karbamatsepiinia parempia (taulukko 2); zonisamidia tutkitaan myös SANAD II -tutkimuksen fokusoidussa haarassa. Näitä kolmea ainetta voidaan harkita ensisijaisiksi hoitovaihtoehdoiksi potilaan liitännäissairauksista ja vasta-aiheista riippuen. Pregabaliinia on myös tutkittu lamotrigiiniin verrattuna, ja se oli huonompi,41 eikä sitä näin ollen suositella
ensimmäisen linjan hoidoksi.
Brivarasetaami oli hyvin siedetty kahdessa satunnaistetussa tutkimuksessa, jotka koskivat siirtymistä polyterapiasta monoterapiaan, mutta niiden potilaiden määrä, jotka olivat jääneet käyttämään brivarasetaamia näiden tutkimusten päättyessä, oli liian vähäinen, jotta olisi voitu määritellä sen teho monoterapiana;43 sitä ei myöskään ole tutkittu suorassa vertailussa vanhempiin AED-lääkkeisiin. Näin ollen ei ole riittävästi näyttöä, jotta brivarasetaamin monoterapiaa voitaisiin tällä hetkellä suositella ensilinjan hoitona.
Klobatsaami, perampaneeli ja kenobamaatti ovat uusia AED-lääkkeitä, joita voidaan käyttää monoterapiana. Cenobamaatti, joka tehostaa nopeiden ja hitaiden natriumkanavien inaktivaatiota ja jota annostellaan kerran päivässä, osoitti äskettäin tehonsa fokaalista epilepsiaa sairastavien potilaiden lisälääkkeenä, mutta sitä ei ole vielä tutkittu monoterapiana.47.
Yhteenveto fokaalisen epilepsian ensilinjan hoidosta
Levetirasetaami on suoriutunut yhtä hyvin tai hieman huonommin kuin vanhemmat AED-lääkkeet head-to-head-tutkimuksissa,31-36 ja se on kohtuullinen ensilinjan hoito potilailla, joilla ei ole aiemmin ollut psykiatrisia ongelmia, erityisesti jos kohtauksia on usein tai potilailla on vaikeuksia lamotrigiinin titrausaikataulun kanssa. Potilaille, joilla on psykiatrisia liitännäissairauksia, suosittelemme lamotrigiinia ensilinjan hoidoksi. Vireillä oleva SANAD II -tutkimus antaa lopullisemman vastauksen siihen, kumpi näistä kahdesta AED-lääkkeestä on parempi sekä tehon että siedettävyyden suhteen. Potilaan liitännäissairauksista ja sivuvaikutusten sietokyvystä riippuen useat vanhemmat AED-lääkkeet (karbamatsepiini, okskarbatsepiini, topiramaatti) ja uudemmat AED-lääkkeet (tsonisamidi, lakosamidi, eslikarbatsepiini) voivat olla järkeviä vaihtoehtoja. Brivarasetaami, klobatsaami, perampaneeli ja kenobamaatti voivat olla käyttökelpoisia vaihtoehtoja tulevaisuudessa, mutta tällä hetkellä näyttöä ei ole riittävästi. Gabapentiinia ja pregabaliinia ei tulisi käyttää ensilinjan hoitoina.
Epilepsialääkkeen valinta-generalisoitunut tai luokittelematon epilepsia
SANAD-tutkimus – ensilinjan hoito hiljattain alkaneessa generalisoituneessa epilepsiassa
Vuonna 2007 tehtyyn SANAD-tutkimukseen sisältyi toinen haara, jossa tutkittiin potilaita, joilla esiintyi generalisoitunutta epilepsiaa tai epilepsiaoireita, joiden luokittelua ei voitu tehdä lopullisesti hoidon aloittamishetkellä.48 Valproaatti oli kokonaisanalyysissä merkitsevästi parempi kuin topiramaatti hoidon epäonnistumiseen kuluvan ajan suhteen ja merkitsevästi parempi kuin sekä topiramaatti että lamotrigiini potilailla, joilla oli varmistettu diagnoosi yleistyneestä epilepsiasta. Kun tarkastellaan aikaa 12 kuukauden remissioon, valproaatti oli merkitsevästi parempi kuin lamotrigiini molemmissa ryhmissä, mutta ei eronnut merkitsevästi topiramaatista kummassakaan ryhmässä. Näin ollen valproaatilla näytti olevan paras tehon ja siedettävyyden yhdistelmä kolmesta tutkitusta lääkkeestä.
Valproaatin menestyksestä SANAD-ohjelmassa huolimatta sen käyttö tutkimusasetelman ulkopuolella on ongelmallista sen haittavaikutusten vuoksi. Hedelmällisessä iässä oleville naisille valproaatti on vasta-aiheinen teratogeenisuuden vuoksi, sillä se lisää merkittävästi synnynnäisten epämuodostumien ja pitkäaikaisten neurokognitiivisten häiriöiden riskiä.49-52 Vuodesta 2018 alkaen Euroopan unioni on kieltänyt valproaatin käytön hedelmällisessä iässä oleville naisille, elleivät he ole mukana raskaudenehkäisyohjelmassa.53 Valproaatilla on myös useita muita ei-toivottuja haittavaikutuksia, kuten painonnousu, hiustenlähtö, munasarjojen polykystinen oireyhtymä ja maksan enkefalopatia.54-57 Vaihtoehtoisia ensilinjan hoitoja tarvitaan erityisesti hedelmällisessä iässä oleville naisille.
Uudet vaihtoehdot valproaatille yleistyneen epilepsian hoidossa
Levetiratsetaami on kattavimmin tutkittu uusi vaihtoehtoinen terapeuttinen lääke (AED-tablettihoito, AED-tablettihoito, AED-tablettihoito, AED), jolla hoidetaan yleistynyttä epilepsiaa. Kahdessa edellä kuvatuista monoterapiatutkimuksista oli mukana myös potilaita, joilla oli yleistynyt epilepsia.32,34 KOMET-tutkimuksessa levetirasetaami vastasi valproaattia sekä hoidon lopettamisnopeuden että ensimmäiseen kohtaukseen kuluvan ajan suhteen.34 Levetirasetaamin on myös osoitettu vastaavan lamotrigiinia kohtausvapauden suhteen heterogeenisessa otoksessa; post hoc -alaryhmäanalyysi osoitti, että tämä pätee sekä fokaalisen että yleistyneen epilepsian osalta.32
Juuri äskettäin Marson ja kollegat esittelivät SANAD II -tutkimuksen yleistynyttä epilepsiaa koskevan osion tulokset.58 Valproaatti oli parempi kuin levetirasetaami hoidon epäonnistumiseen kuluvan ajan, ensimmäiseen kohtaukseen kuluvan ajan ja 24 kuukauden remissioon kuluvan ajan suhteen. Mielenkiintoista on, että ero hoidon epäonnistumiseen kuluneessa ajassa johtui pikemminkin riittämättömästä kohtausten hallinnasta kuin haittavaikutuksista, mikä viittaa siihen, että valproaatti ei ollut huonommin siedetty kuin levetirasetaami tässä otoksessa.
Kuten edellä todettiin, sekä klobatsaamilla että perampaneelilla oli hyvä teho ja siedettävyys retrospektiivisissä havainnointitutkimuksissa, joihin osallistui generalisoitunutta epilepsiaa sairastavia potilaita, mutta kumpaakaan lääkettä ei ole verrattava mihinkään vanhempiin lääkeaineisiin satunnaistetuissa lääketutkimuksissa44,45. Tietojemme mukaan mitään muista uusista AED-lääkkeistä ei ole tutkittu monoterapiana yleistynyttä epilepsiaa sairastavilla potilailla.
Yhteenveto yleistyneen ja luokittelemattoman epilepsian ensilinjan hoidosta
Vaikka SANAD II -tutkimuksen tulokset viittaavat siihen, että valproaatti on edelleenkin tehokkain yleistyneeseen tai luokittelemattomaan epilepsiaan tarkoitettu AED-lääke, emme suosittele valproaattia ensilinjan lääkehoidoksi sen haittojen vuoksi. Lamotrigiini on hyvä valinta, jos kohtaustiheys on riittävän alhainen, jotta annosta voidaan nostaa hitaasti. Jos tarvitaan nopeaa aloitusta, voidaan käyttää levetirasetaamia. Jos kohtaukset ovat refraktorisia näille kahdelle aineelle, voidaan käyttää valproaattia sen jälkeen, kun riskeistä ja hyödyistä on keskusteltu huolellisesti.
Neuvonta potilaille, joilla on hiljattain alkanut epilepsia
Potilailla, joilla on uusi epilepsiadiagnoosi, on tyypillisesti paljon kysymyksiä taudista ja sen vaikutuksesta heidän elämäänsä. Yleisimmät kysymykset koskevat epilepsian pitkän aikavälin ennustetta, sitä, pitäisikö AED-hoito aloittaa, ja sitä, onko AED-hoito elinikäistä. Kuten edellä todettiin, potilaille on kerrottava, että välitön AED-hoito vähentää kohtausten uusiutumisen riskiä, mutta ei muuta epilepsian kokonaisennustetta, ja päätös AED-hoidon aloittamisesta on tehtävä yksilöllisesti. Potilaille on kerrottava, että noin puolet potilaista saa kohtaukset hallintaan ensimmäisellä AED-lääkkeellä, kun taas toiset 20 prosenttia reagoi toiseen tai kolmanteen lääkkeeseen.59 Lisäksi potilaiden on oltava tietoisia siitä, että AED-hoidon lopettamisyritykset on aloitettava vasta, kun kohtausvapaus on kestänyt vähintään kaksi vuotta, ja että lähes puolella potilaista kohtaukset uusiutuvat AED-lääkityksen lopettamisen jälkeen.60
Kohtausten hallinnan lisäksi yleisimmät käytännölliset kysymykset liittyvät ajamiseen. Mikä tahansa kohtaus, johon liittyy heikentynyt tietoisuus – poissaolokohtaus, toonis-klooninen kohtaus tai fokaalinen tietämätön kohtaus – voi aiheuttaa merkittävää haittaa, jos se ilmenee potilaan ajaessa autoa. Useimmissa osavaltioissa edellytetään, että potilaan on oltava jonkin aikaa kohtausvapaa, ennen kuin hän voi jatkaa ajamista. Lääkäreiden tulisi varmistaa, että potilaat tuntevat oman osavaltionsa lait. Joissakin osavaltioissa lääkäreitä vaaditaan ilmoittamaan epilepsia- tai kohtauspotilaistaan moottoriajoneuvo-osastolle, kun taas toisissa ei.61 On tärkeää huomata, että osavaltioissa, joissa ei ole ilmoitusvelvollisuutta, lääkäreillä ei välttämättä ole oikeussuojaa, kun he paljastavat epilepsiadiagnoosin ilman potilaan suostumusta. Näissä tapauksissa lääkäreiden on punnittava potilaan ajamisen jatkamiseen liittyviä riskejä (erityisesti jos kyseessä on ammattikuljettaja) ja potilaan luottamuksellisuuden rikkomisesta aiheutuvia oikeudellisia seuraamuksia. Kaikki ajamisesta käydyt keskustelut on dokumentoitava potilaan sairauskertomukseen.
Hedelmällisessä iässä olevia naisia on lisäksi neuvottava epilepsian ja AED-lääkkeiden vaikutuksista raskauteen. Potilaiden tulisi olla tietoisia siitä, että kohtauksilla, erityisesti yleistyneillä toonis-kloonisilla kohtauksilla, ja joillakin AED-lääkkeillä voi olla haitallisia vaikutuksia kehittyvään sikiöön. Naisilla, jotka eivät suunnittele raskautta, suositellaan pitkävaikutteista ehkäisyä kohdunsisäisellä ehkäisylaitteella tai depot-injektiolla, koska ne minimoivat käyttövirheiden mahdollisuuden. Potilaiden on myös tiedettävä, että hoito entsyymiä indusoivilla AED-lääkkeillä voi heikentää hormonaalisen ehkäisyn tehoa.62 Kaikkien raskautta suunnittelevien epilepsiaa sairastavien naisten on ilmoitettava asiasta neurologilleen etukäteen; jos raskaus on suunnittelematon, neurologille on ilmoitettava asiasta mahdollisimman pian. Lisäksi kaikkien hedelmällisessä iässä olevien epilepsiaa sairastavien naisten tulisi käyttää foolihappoa riippumatta siitä, onko raskaus suunnitteilla vai ei, sillä se vähentää hermostoputken vikojen riskiä, jotka kehittyvät varhain ensimmäisen raskauskolmanneksen aikana, usein ennen kuin raskaudesta tiedetään.63
Vaikein aihe, josta on vaikea keskustella äskettäin diagnoosin saaneiden potilaiden kanssa, on äkillinen odottamaton kuolemantapaus epilepsiassa (sudden unexpected death in epilepsy, SUDEP). SUDEP:n riskitekijöitä ovat muun muassa suuri kohtaustiheys, varhainen alkamisikä, sairauden pitkä kesto, yleistyneet toonis-klooniset kohtaukset, yölliset kohtaukset, yksin asuminen, miessukupuoli, alkoholiriippuvuus ja päihteiden väärinkäyttö.64-66 Useimmat neurologit ovat sitä mieltä, että kaikille epilepsiapotilaille olisi kerrottava SUDEP:stä, kun taas joidenkin mielestä SUDEP:hen liittyvää neuvontaa tarvitaan vain niille potilaille, jotka ovat suuressa vaarassa.67 Suosittelemme, että SUDEP:stä keskustellaan kaikkien potilaiden kanssa, joilla on uusi epilepsia, osana alkukeskustelua lääkityksen noudattamisen tärkeydestä, ja että korkean riskin potilaille annetaan useammin ja laajemmin neuvontaa.