Tutkimusohjelmassa parannettiin prosessointitekniikkaa alumiinioksidin uuttamiseksi muusta kuin bauksiitista. Tämän ohjelman onnistuminen oli tuottanut teknologian, jota tarvitaan korkealaatuisen alumiinioksidin riittävään tuotantoon kotimaisista lähteistä, mikä vastasi kansantaloudellisia ja strategisia tarpeita alumiinin tuotantoon liittyen. Suolahappoprosessi alumiinioksidin talteenottamiseksi heikkolaatuisista malmeista on yksi tutkimusohjelmassa tutkittavista prosesseista.
Tämän prosessin eräässä vaiheessa hyödynnetään kloridi-ionikonsentraation vaikutusta alumiiniionin liukoisuuteen liuokseen. 25° C:ssa AlCl3:n liukoisuus puhtaaseen veteen on noin 31 painoprosenttia, ja se pienenee suolahappokonsentraation (HCl) kasvaessa ja on 0,1 painoprosenttia, kun HCl-konsentraatio nostetaan 37 prosenttiin. Tästä käyttäytymisestä on tehty lukuisia tutkimuksia, prosesseja ja patentteja. Näin ollen on mahdollista liuottaa ei-bauksiittista malmia HCl:llä, dekantoida ja suodattaa liuos ja lisätä kaasumaista HCl:tä AlCl3-6H2O:n saostamiseksi. Jäljelle jäävää happoliuosta voidaan sitten käyttää lisämalmin liuotukseen ja saostettu AlCl3-6H2O voidaan kalsinoida, jolloin saadaan Al2O3 . Peters, Johnson ja Kirby käsittelevät ja arvioivat laajasti tätä prosessia. Tämän prosessin täydelliseen analysointiin, tulkintaan ja parantamiseen tarvittavia termodynaamisia tietoja, kuten ionien aktiivisuuksia ja liukoisuuksia, on vähän, ja olemassa olevat liukoisuustiedot rajoittuvat kapealle lämpötila-alueelle. Tämän vuoksi tämän tutkimuksen tavoitteena oli (1) määrittää AlCl3:n liukoisuus lämpötila-alueella 25°-85° C HCl-konsentraation ollessa 0,0-37.2 pct; (2) laskea AlCl3:n ja H2O:n aktiivisuudet eri elektrolyyttejä sisältävissä liuoksissa sekä AlCl3-6H2O:n liukenemisen tasapainovakio; ja (3) ehdottaa tutkimusalueita hyödyllisten tietojen tuottamiseksi.
- Laitteisto
- Kokeellinen menettely
- Analyysi
- Tulokset
- Vertailu muihin tietoihin
- Termodynaaminen käsittely
- Liukoisuustuote ja aktiivisuus AlCl3-6H2O-H2O-systeemissä
- Aktiivisuuksien arviointi AlCl3-6H2O-H2O-systeemissä
- Liukoisuustuote ja aktiviteetit AlCl3-6H2O-HCl-H2O-systeemissä
- Aktiivisuuksien arviointi AlCl3-6H2O-HCl-H2O-systeemissä
- AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O-järjestelmä
- Tutkimukseen suositeltavat alueet
- Alumiinikloridi suolahappoliuoksissa
Laitteisto
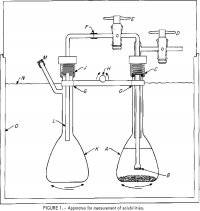
Liukoisuuksien mittauksissa käytetty laitteisto on esitetty kuvassa 1. 100 ml:n pullo, A, sisältää elektrolyyttiliuoksen ja jonkin verran ylimääräistä suolaa. Hapsullinen lasisuodatin, B, joka on fuusioitu 6 mm:n Pyrex-putkeen, on liitetty ulompaan putkeen, joka on kiinnitetty kahteen teflon-sulkuhanaan, D ja E. Yläkokoonpano on kiinnitetty A:han C:n kohdalla kierteitetyllä nailonpuristusliittimellä, jossa on neopreeninen 0-rengas. 6 mm:n OD-polyeteeniputki F-L johtaa näytteen B:stä suodatetusta liuoksesta toiseen kolviin K, kun A paineistetaan sulkuhanan D kautta ja E avataan. J:n kohdalla oleva liitos on samanlainen kuin C:n kohdalla oleva liitos. Pullot on kiinnitetty tankoon G, joka on kiinnitetty keinumekanismiin, jossa H toimii keinuakselina, jonka avulla pulloja A ja K ravistetaan vuorotellen ylös ja alas. Katettu termostaatti, 0, säädetään ±0,2 °C:n tarkkuudella. Tarkempi lämpötilan säätö on tarpeeton, koska liukoisuus on hyvin heikko lämpötilan funktio.
Kokeellinen menettely
Liukoisuuksien mittaukset 25 °C:ssa, 45 °C:ssa, 65 °C:ssa ja 85 °C:ssa tehtiin faasitasapaino-olosuhteissa analyyttisillä reagenssilaatuisilla materiaaleilla. Sopivat määrät AlCl3-6H2O:ta, 37-prosenttista HCl-liuosta ja tislattua vettä laitettiin kolviin A niin, että muodostui noin 90 ml liuosta, jossa oli pieni määrä ylimääräisiä suolakiteitä (jäljempänä ”suolalla” tarkoitetaan alumiinikloridiheksahydraattia). Materiaalien määrät arvioitiin olemassa olevien liukoisuustietojen perusteella kolmoissysteemistä AlCl3-6H2O-HCl-H2O. Kun liuos oli muodostunut pullossa A ja laite oli koottu, se upotettiin veteen tasolle N ja termostaatti asetettiin haluttuun lämpötilaan. Pulloja sekoitettiin jatkuvasti mekaanisesti 2-3 päivän ajan. Ajoittain käytettiin myös voimakasta manuaalista sekoittamista
tasapainon varmistamiseksi, erityisesti jos suola saattoi muodostaa HCl:n kanssa monimutkaisen kiinteän suolan. Tasapainojakson päätyttyä pullojen annettiin olla liikkumattomina pystyasennossa 1 tunnin ajan kiinteiden hiukkasten laskeutumisen varmistamiseksi. Tämän jälkeen sulkuhanat D ja E avattiin, jotta noin puolet liuoksesta voitiin siirtää näytteenottopulloon K. Näytteenottopulloon K siirretyn liuoksen määrä määräytyi yleensä sen mukaan, kuinka paljon liuosta B oli A:ssa olevan nesteen alapuolella B. Liuoksen paino K:ssa määritettiin punnitsemalla pullo ennen kokoamista, liuoksen ottamisen jälkeen ja purkamisen jälkeen. Kolviin ruiskutettiin tunnettu määrä tislattua vettä L:n kautta näytteen laimentamiseksi ja kaasufaasissa olevan höyryn liuottamiseksi. HCl:n osapaine puhtaassa vedessä on yli 1 torr 25 °C:n lämpötilassa yli 8 m:n moolipitoisuuksissa (m numeron jälkeen lauseessa tarkoittaa moolipitoisuutta), joten alle 8 m:n pitoisuuksissa on epätodennäköistä, että näytteenoton aikana tapahtuisi HCl:n hävikkiä. Tästä syystä osa 25° C:ssa tehdyistä ajoista, jotka sisälsivät alle 4 m HCl:ää, tehtiin yhdellä tulpallisella pullolla, ja tasapainottamisen jälkeen osa liuoksesta dekantoitiin huolellisesti ja suodatettiin näytteenottoa varten.
Analyysi
Liuokset analysoitiin asianmukaisten laimennosten jälkeen kloridi-ionien ja alumiiniionien kokonaispitoisuuksien osalta. Kloridi-ionien kokonaispitoisuus määritettiin potentiometrisellä titrauksella Ag+:lla. Al+++ -pitoisuus määritettiin ensin kompleksoimalla ylimääräisellä etyleenidiamiinitetraetikkahapolla (EDTA) ja sitten titraamalla ylimääräinen EDTA takaisin Cu++:lla pH:ssa 3,8.
AlCl3-pitoisuus laskettiin Al+++ -analyysistä. Kun lasketun AlCl3-määrän sisältämä kloridi-ioni vähennettiin kloridi-ionien kokonaispitoisuudesta, voitiin laskea HCl-konsentraatio kyllästetyissä liuoksissa.
Tätä laskentamenetelmää käytettiin kaikissa analyyseissä lukuun ottamatta analyysejä, joissa HCl-konsentraation tiedettiin olevan nolla, eli kun AlCl3 oli ainoa elektrolyytti puhtaassa vedessä. Näissä analyyseissä AlCl3-konsentraatio laskettiin yksinkertaisesti kloridi-ionianalyysistä, joka oli tarkempi näistä kahdesta analyysistä, vaikka näille näytteille suoritettiin silti sekä Al+++- että Cl-analyysit.
Kokonais-Cl-analyysin ja Al+++-analyysin perusteella lasketun Cl-analyysin ero kokeissa, joihin ei ollut lisätty HCl:aa, oli ±0,2 painoprosenttia Cl-. Tämä osoittaa, että Al++ -analyysissä oli keskimäärin +0,05 wt-%:n virhe, koska Cl-analyysin tiedettiin olevan huomattavasti tarkempi kuin Al+++ -analyysin. HCl:ää sisältävissä liuoksissa ±0,05 prosentin virhe Al+++-pitoisuudessa näkyi ±0,20 pkt:n virheenä HCl-pitoisuudessa; tämä johtui siitä, että vaikka Cl:n kokonaispitoisuus oli hyvin tarkka, lisätyn HCl:n aiheuttama Cl-osuus ja siten HCl:n molaliteetti laskettiin erotuksena, kuten aiemmin mainittiin.
Tulokset
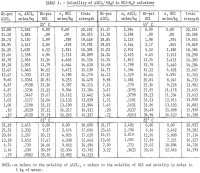
Tulokset on esitetty taulukossa 1, ja ne on esitetty kuvassa 2. Tulokset on esitetty taulukossa 1. HCl:n maksimikonsentraatio taulukossa 1 esitetyissä tiedoissa 85 °C:n lämpötilassa on noin 30 painoprosenttia. Mittaukset lopetettiin tällä pitoisuudella, koska systeemissä oli liian suuria tasapainopaineita suuremmilla pitoisuuksilla. On myös huomattava, että 65° ja 85° C:n lämpötiloissa tehtiin vähemmän määrityksiä kuin 25° ja 45° C:n lämpötiloissa. Näissä kahdessa alhaisemmassa lämpötilassa tehtiin toistoja, jotta saataisiin viitteitä tulosten tyydyttävästä toistettavuudesta. Kuvasta 2 käy ilmi, että alumiinisuolan liukoisuus vähenee jyrkästi HCl-pitoisuuden kasvaessa. Näin ollen ei-bauksiittisten malmien liuottaminen HCl-liuoksella ja puhtaan suolan saostaminen ulos alumiinin uuttamiseksi lisäämällä HCl:ää on toteuttamiskelpoinen prosessi; tällaisesta prosessista on tehty useita patentteja. Tulokset osoittavat, että liukoisuus ei suuresti muutu lämpötilan myötä, ja lämpötilan noustessa 60° C (25° – 85° C) pelkän puhtaan suolan liukoisuus veteen kasvaa vain 2,2 prosenttia suhteessa liukoisuuteen 25° C:ssa.
Vertailu muihin tietoihin
Puhtaan suolan liukoisuuden veteen 25° C:n lämpötilassa todettiin sopivan tarkalleen yhteen Palitzchin sekä Ehret’n ja Frere’n tietojen kanssa. Malquorin antamat tulokset ovat noin 10 prosenttia korkeammat. Tanakan saama liukoisuus on noin 3,3 prosenttiyksikköä suurempi kuin tässä tutkimuksessa 45° C:ssa ja 65° C:ssa.
Seidel ja Fisher ovat tutkineet HCl:n vaikutusta suolojen liukoisuuteen vedessä 0° C:ssa ja Malquori 25° C:ssa. Edellisten tutkijoiden tulokset 0° C:ssa vastaavat hyvin tarkasti taulukon 1 tietoja ekstrapoloituna 0° C:een, kun taas jälkimmäisen tutkijan tulokset 25° C:ssa hajoavat jonkin verran ja eroavat toisistaan karkeasti 3 pet:n verran matalilla HCl-pitoisuuksilla; yksimielisyys on kuitenkin 1 pct:n tarkkuudella välillä 5-30 painoprosenttia HCl:ää.
Termodynaaminen käsittely
Liukoisuustuote ja aktiivisuus AlCl3-6H2O-H2O-systeemissä
Mason on mitannut AlCl3:n ionisen aktiivisuuskertoimen Y12 vedessä 1,8 m:iin asti, ja uudelleenlasketut arvot antavat Robinson ja Stokes. Koska aktiivisuuskertoimen 1,8 m:stä 3,3835 m:n kyllästysarvoon odotetaan kasvavan yli viisinkertaiseksi, käytetään kyllästysarvoa laskennassa menetelmällä, joka on kuvattu yksityiskohtaisesti aiemmassa raportissa (1 m = 1 mooli 1 kg:ssa liuotinta). Menetelmästä ja sen soveltuvasta uudesta sovelluksesta esitetään tässä raportissa lyhyt yhteenveto. AlCl3:n keskimääräinen ioninen aktiivisuus, jota nimitetään a12:ksi, ilmaistaan seuraavalla potenssisarjalla molaliteetin m suhteen:

Vastaava yhtälö veden aktiivisuudelle aw, saadaan soveltamalla Gibbs-Duhemin suhdetta; tulokseksi saadaan
![]()
Huomautetaan, että m:n eksponentit, joilla on samat kertoimet kuin C:llä, D:llä, jne, ovat yhtälössä 2 1 suuremmat kuin yhtälössä 1, ja m:n kerroin yhtälössä 2 on peräisin Gokcenin käsittelemästä Debye-Huckelin teoriasta.
Suolan liukenemisreaktio on
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
joissa (s) tarkoittaa kiinteää ja (l) nestettä.
Vastaava tasapainovakio on
![]()
joissa nimittäjä, kiinteän aineen aktiivisuus, otetaan ykkösenä, koska sen koostumus pysyy muuttumattomana, kun liuokseen lisätään muita elektrolyyttejä. Korvaamme a12:n 1n Kp:llä suoraan yhtälöstä 1 ja aw:n yhtälöstä 2 sen jälkeen, kun yhtälö 2 on kerrottu luvulla 0,108093, jotta 1n aw:n kerroin olisi 6. Koska Kp on koostumuksesta riippumaton, on ilmeistä, että
![]()
Yhtälöistä 1 ja 2 tehtyjen tarvittavien korvausten ja sitten keskiarvon m = 3 korvaamisen jälkeen.3835 kahdesta ensimmäisestä ajosta taulukossa 1, saadaan yksi yhtälö yhtälön 1 kuuden tuntemattoman kertoimen ratkaisemiseksi, ja loput viisi yhtälöä saadaan korvaamalla kukin AlCl3 :n ionisen aktiivisuuskertoimen y12 taulukossa 2 esitetyistä viidestä kokeellisesta keskiarvon kokeellisesta arvosta yhtälöön
![]()
ja korvaamalla sitten kukin tulos yhtälöön 1. Näin saadut kuusi samanaikaista yhtälöä ratkaistaan sitten tietokoneella. Tulokset ovat seuraavat:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
ja H = +11,6880.
Substituoimalla nämä arvot yhtälöihin 1, 2 ja 4 saadaan Y12:n, aw:n ja Kp:n arvot. Tulokset on lueteltu taulukossa 3 otsikon ”Bureau results:” alla. On huomattava, että veden aktiivisuus voidaan nyt laskea yhtälöstä 2 ja veden höyrynpaine liuoksen päällä, P, yhtälöstä
aw = P/P°,……………………………….(7)
jossa P° on puhtaan veden höyrynpaine samassa lämpötilassa. Huomaa, että veden höyrynpaine kylläisen liuoksen päällä on hieman yli puolet puhtaan veden höyrynpaineesta, koska aw = 0,509. Edellä esitetyt tulokset muodostavat ensimmäiset suolan liukoisuuteen perustuvat aktiivisuustiedot.
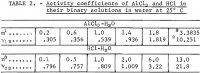
Huom.- Tässä taulukossa m tarkoittaa AlCl3:n molaliteettia, n tarkoittaa HCl:n molaliteettia ja molaliteetti on moolia 1 kg:ssa vettä.
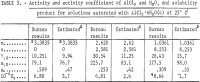
Huom.-Tässä taulukossa m viittaa AlCl3:n molaliteettiin, n viittaa HCl:n molaliteettiin ja molaliteetti on mooleja 1 kg:ssa vettä.
Aktiivisuuksien arviointi AlCl3-6H2O-H2O-systeemissä
Kahdella olemassa olevalla luotettavalla arviointimenetelmällä saadaan aktiivisuudet AlCl3-6H2O-H2O-systeemissä nykyisten suorien kokeellisten tietojen lisäksi m = 1,8:ssa. Ensimmäisellä Kusikin ja Meissnerin kuvaamalla menetelmällä saadaan arvioksi γ12 = 9,94 3,3835 m:n lämpötilassa. Tämä arvioitu arvo on hyvin yhdenmukainen tässä tutkimuksessa saadun arvon 10,251 kanssa. Vastaava veden aktiivisuuden (aw) arvioitu arvo on 0,47, joka on myös läheisessä sopusoinnussa tässä tutkimuksessa todetun arvon 0,509 kanssa. Näiden arvojen perusteella laskettu tasapainovakio Kp ei ole kaukana 6,8 x 10 5:stä, kun otetaan huomioon, että Kp:n saamiseksi kerrotaan a12:n neljäs potenssi ja aw:n kuudes potenssi.
Toisella Bromleyn estimointimenetelmällä saadaan γ12:n arvoksi 10,42, mikä on lähempänä edellisellä menetelmällä saatua arvoa. Nykyiset kirjoittajat ovat saaneet veden aktiivisuuskertoimen integroimalla Gibbs-Duhemin yhtälön, jossa on käytetty Bromleyn menetelmällä estimoituja a12-arvoja. Tulos on aw = 0,540. Molempien menetelmien keskiarvo on 0,505, mikä vastaa hyvin FBI:n arvoa 0,509. Bromleyn menetelmä ei kuitenkaan sisällä Kusik-Meissnerin menetelmään sisältyvää kätevää menetelmää aw:n määrittämiseksi.
Edistatoitujen arvojen ja liukoisuustiedoista saatujen arvojen välinen vastaavuus ei ole aina niin hyvä kuin tässä on esitetty jokaiselle elektrolyytille ja jokaiselle koostumukselle. Esimerkiksi jopa AlCl3:lle 1 m:n lämpötilassa nämä kaksi γ12-estimaattia eroavat toisistaan vain 13 prosenttia.
Liukoisuustuote ja aktiviteetit AlCl3-6H2O-HCl-H2O-systeemissä
HCl:n konsentraation kasvamisen vaikutus suolan liukoisuuteen johtuu suurelta osin kloridi-ionien konsentraation kasvusta. Tasapainovakio tässä tapauksessa yksittäisten ionien aktiivisuuksilla a1 ja a2 on
![]()
jossa γ12 = γ1γ2 määrittelemällä γ12 yksittäisten ionien aktiivisuuksista γ1 (Al+++:n osalta) ja γ2 (Cl-:n osalta), ja n on HCl:n molaliteetti. Kp:n arvo on sama kuin yhtälössä 4, mutta yhtälön 8 oikea puoli on erilainen kuin yhtälössä 4. Voidaan huomata, että n:n kasvaessa m:n, Al+++ -pitoisuuden, on pienennyttävä edellyttäen, että γ12 ja aw eivät pienene suuresti; näin ollen suola saostuu ulos, mikä tunnetaan nimellä salting out -ilmiö.
Ternääriliuoksen aktiivisuuksien laskeminen vaatii yhtälön, joka on samankaltainen kuin yhtälö 1 HCl:lle. Koska HCl:n tiedot tunnetaan tarkasti laajalla konsentraatioalueella, on mahdollista ottaa yhtälö, jossa on niin monta muuttujaa kuin halutaan. Seuraava yhtälö antaa tarkan esityksen HCl:n aktiivisuuskerrointa γ32 koskevista tiedoista, joissa alaindeksi 3 tarkoittaa H+:a ja 2 Cl-:a:
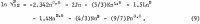
Taulukon 2 kolmannella ja neljännellä rivillä on lueteltu Haasen, Naasin ja Thutnm:n tähän tarkoitukseen valitsemat tiedot. Näistä tiedoista lasketut kertoimien arvot ovat seuraavat:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
ja P = +0,02634.
AlCl3:n ja H2O:n aktiivisuuden yhtälöt sisältävät nämä kertoimet sekä ristitulojen (m h/2)(n k/2) kertoimet, missä h ja k ovat kokonaislukuja, ja nämä yhtälöt ovat seuraavat:
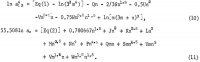
Viisi lisäkerrointa näissä yhtälöissä määritetään lisäämällä yhtälö 10 ja 6 1n aw yhtälöstä 11, jotta saadaan 1n Kp, ja käyttämällä seuraavia taulukosta 1 valittuja liukoisuustietoja:
m: 2.
m.620, 2,016, 1,333, 0,953 ja 0,535.
n: 2,581, 4,460, 6,780, 8,397 ja 10,063.
Tuloksena saadut laskelmat antavat yhtälöiden 10 ja 11 kertoimille seuraavat arvot:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
ja W = +4,60246.
Taulukossa 3 on lueteltu edellisistä yhtälöistä lasketut tulokset γ12:lle, a12:lle, aw:lle ja Kp:lle. Yhtälöstä 9 saadut γ12:n arvot ovat sopusoinnussa Harnedin ja Garyn antamien arvojen kanssa HCl:n ja AlCl3:n hyvin pienillä pitoisuuksilla.
HCl(g):n osapaine P32 liuoksessa voidaan laskea seuraavasta yhtälöstä (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
jossa Kp(HCl) on H+ + Cl- = HCl(g) -yhtälön tasapainovakio 25° C:ssa ja a32 on HCl:n keskimääräinen ioninen aktiivisuus liuoksessa. Tätä varten on tarpeen kirjoittaa yhtälön 10 kaltainen yhtälö a32:lle käyttämällä yhtälön 11 parametreja, kuten muualla on esitetty yksityiskohtaisesti.
Lämpötilan vaikutus suolan liukoisuuteen on pieni, kuten taulukosta 1 ilmenee. Vaikutuksen ionisiin aktiivisuuksiin odotetaan siksi olevan pieni, koska kaikki yhtälön 11 parametrit olisi voitu saada liukoisuustiedoista, jos kokeellinen virhe olisi ollut alumiinianalyysin osalta pienempi kuin ±0,01 wt-%. Yleisesti ottaen lämpötila-alueella noin 80 °C:een asti jokainen parametri on lämpötilan lineaarinen funktio, ja tämä riippuvuus voidaan määrittää, jos yhtälö 11 tunnettaisiin toisessa lämpötilassa, joka on vähintään 50 °C korkeampi kuin 25 °C.
Aktiivisuuksien arviointi AlCl3-6H2O-HCl-H2O-systeemissä
Taulukossa 3 on lueteltu aktiviteettien, aktiivisuuskertoimen ja liukoisuustuotteen arvot, jotka on arvioitu tässä selvityksessä Kusik- ja Meissner-yritysten kehittämän menetelmän mukaan. AlCl3:n aktiivisuuskerroin γ12 on noin kaksi kertaa suurempi kuin HCl:ää sisältävien valittujen liuosten arvioitu arvo. Veden aktiivisuus aw vastaa kuitenkin hyvin estimoituja arvoja lukuun ottamatta arvoa m = 2,620. On selvää, että laskelmat olisivat olleet huomattavasti luotettavampia, jos veden höyrynpaine aw olisi mitattu, koska aw tulee Kp:hen aw:na, joten pienet virheet aw:ssa aiheuttavat suuria virheitä γ12:ssa ja Kp:ssä. Tätä varten suositellaan rajoitettua määrää höyrynpainemittauksia, joilla testataan nykyisten laskelmien ja arviointimenetelmien tarkkuutta.
Taulukossa 3 lueteltujen termodynaamisten ominaisuuksien lämpötilariippuvuus voidaan arvioida Kusikin ja Meissnerin kuvaamalla tavalla. Arvio antaa kuitenkin todennäköisesti suuremman lämpötilariippuvuuden kuin mitä liukoisuuden heikko lämpötilariippuvuus osoittaa. Lämpötilan vaikutusta ei ole voitu yrittää laskea Bureau’n menetelmällä, koska 1) a12 AlCl3:n pienillä pitoisuuksilla ei tunneta eri lämpötiloissa, 2) AlCl3:n liukoisuutta ei ole voitu määrittää lähellekään 0,01 prosentin tarkkuudella Al+++:ssa ja 3) HCl:n konsentraatioiden vaihteluväli 65 °C:ssa ja 85 °C:ssa on liian pieni, jotta olisi voitu poimia riittävä määrä toisistaan suuresti poikkeavia liukoisuustietoja, joiden avulla voitaisiin määritellä täsmällisesti yhtälöiden 10 ja 11 parametrit.
AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O-järjestelmä
Alustavat tiedot AlCl3:n, FeCl3:n, KCl:n ja NaCl:n liukoisuuksista vesiliuoksissa, jotka sisältävät 24-31 painoprosenttia HCl:tä 25 °C:n lämpötilassa, saatiin, jotta voitiin arvioida muista kuin bauksiittimalmeista uutettavan AlCl3-6H2O:n kontaminaatiota. Tätä tarkoitusta varten valmistettiin 2 litraa liuosta, joka sisälsi tunnettuja määriä suoloja, 90 ml tätä liuosta annosteltiin kolviin kutakin ajoa varten, ja sen jälkeen annosteltiin tunnettu määrä kaasumaista HCl:ää, jotta saatiin 24-31 painoprosenttia liuennutta HCl:ää. Tällä HCl-liuosalueella saostui värittömiä anisotrooppisia AlCl3-6H2O-kiteitä, kirkkaita anisotrooppisia FeCl3-2KCl-H2O-kiteitä ja kuutiomaisia isotrooppisia läpinäkyviä KCl- ja NaCl-kiteitä, jotka tunnistettiin mikroskooppisesti. Menettely ja analyysit alumiiniionien ja kloridiionien pitoisuuksien osalta olivat samat kuin aiemmin tässä raportissa esitellyssä AlCl3-6H2O-HCl-H2O-järjestelmässä. Lisäksi ferri-ionikonsentraatio määritettiin tavanomaisella K2Cr2O7-titrauksella, natriumionikonsentraatio määritettiin atomiabsorptiomenetelmällä ja kaliumionikonsentraatio määritettiin vähentämällä natriumionikonsentraatio kaliumionien ja natriumionien yhteenlaskettujen konsentraatioiden määritelmästä, kun ne oli erotettu toisistaan ioninvaihdolla. Tulokset on lueteltu taulukossa 4 ja esitetty kuvassa 3. Vastaavat Milesin tulokset on myös piirretty kuvaan 3, mikä osoittaa, että vastaavuus on erinomainen. Linke on koonnut julkaistuja tietoja vastaavista yksinkertaisemmista järjestelmistä, jotka sisältävät vähemmän komponentteja.
Haihduttamalla tai HCl-kaasulla sparraamalla tapahtuvissa kiteytysprosesseissa, joissa tuotetaan puhdasta alumiinikloridiheksahydraattia, muiden metallikloridien aiheuttamasta kontaminaatiosta tulee ongelma epäpuhtauksien kasvaessa liuotusliuoksissa. Kuvassa 3 esitetään pitoisuustasot, joilla epäpuhtaudet, kuten NaCl, KCl ja FeCl2-2KCl-H2O, myös kiteytyvät liuoksesta erillisinä faaseina, mikä aiheuttaa AlCl3-6H2O-kiteiden kontaminaatiota. Esimerkiksi alle 2,4 painoprosenttia FeCl3:n ja 1,6 painoprosenttia KCl:n läsnäollessa 25 °C:ssa HCl:n konsentraation on oltava alle 28 painoprosenttia, jotta vältettäisiin AlCl3-6H2O:n kontaminaatio kaksoissuolalla FeCl3-2KCl-H2O. Kuva 3 on hyödyllinen myös saostuneen fraktioidun uudelleenkiteytyksen uudelleen liuottamisessa alumiinisuolan puhdistamiseksi. Lisäksi jotkin siirtymäalkuaineiden suolat, kuten FeCl3, voidaan minimoida osittaisella elektrolyysillä, jotta riittävä määrä rautaa saadaan levytettyä pois ennen happamoitumista HCl:llä.
Systeemin termodynaaminen käsittely, jossa kloridi-ionikonsentraatiossa on tavanomainen ±0,05 wt-%:n virhe, ei ole toteuttamiskelpoinen, varsinkaan, kun ei ole höyrynpainetietoja H2O:n (g) ja HCl:n (g) osalta. Karkeat arviot aktiivisuudesta voidaan kuitenkin tehdä Kusik-Meissnerin menetelmällä. On oletettavaa, että tällaiset arviot voivat antaa vain karkeat arvot aktiviteeteista hydratoiduille ja kompleksisille suoloille sekä vedelle.

Tutkimukseen suositeltavat alueet
Aktiivisuusmittaukset ovat käyttökelpoisia tulkittaessa erilaisten malmien haluttujen ainesosien liuotuksen, saostuksen ja puhdistuksen termodynamiikkaa ja kinetiikkaa. On kaksi syytä siihen, että aktiivisuudet voidaan määrittää tarkasti veden höyrynpaineen mittauksista: (1) Höyrynpaine voidaan mitata suurella tarkkuudella paine-eromittareilla, jotta saadaan aw yhtälön 7 avulla ja sen jälkeen voidaan laskea parametrien arvot yhtälössä 11 niin, että kaikki siihen liittyvät ominaisuudet voidaan laskea, kuten aiemmin on käsitelty yksityiskohtaisesti (2) Liukoisuustuote ja aktiivisuudet voidaan molemmat määrittää tarkasti moniarvoisille suoloille, jotka sisältävät suuria määriä vesimolekyylejä hydratoituneissa kiteissään. Toinen syy johtuu siitä, että veden aktiivisuuden eksponentti yhtälössä 4 on yhtä suuri kuin hydratoidun kiteen vesimoolit.
Alumiinikloridi suolahappoliuoksissa
Toinen mielenkiintoinen koetyyppi tässä käsitellylle ternääriselle systeemille on HCl:n (g) osapaineen mittaaminen erilaisissa liuoksissa, jotka sisältävät riittävän suuria määriä liuennutta HCl:ää. Kokeellinen menettely tähän tarkoitukseen on kuvattu toisaalla. Ryhmän IIA, IIIA ja siirtymämetallien suolat ovat erinomaisia ehdokkaita tämäntyyppisiin tutkimuksiin, koska elektrolyytit, joiden valenssi on suurempi kuin 1:1, muodostavat yleensä hydratoituneita suoloja.
Alumiinikloridiheksahydraatin, AlCl3-6H2O, liukoisuus ja aktiivisuus vesiliuoksessa määritettiin osana Yhdysvaltain sisäasiainministeriön kaivostoimiston (Bureau of Mines, U.S. Department of the Interior, U.S. Department of the Interior, U.S. Department of the Interior, Bureau of Mines, U.S. Department of the Interior, U.S. Department of the Interior, Bureau of Mining, Bureau of Mining, Bureau of Mining, U.S. Department of the Interior, tutkimuksia, joiden tarkoituksena on parantaa mineraalienkäsittelytekniikkaa, jonka avulla voidaan ottaa talteen alunaa vähäinen laatuisista kotimaisten luonnonvarojen varoista. AlCl3:n liukoisuuden puhtaaseen veteen todettiin olevan 31,09 ja 31,77 painoprosenttia 25° C:ssa ja 85° C:ssa, ja se laski jyrkästi 10 ja 0,1 painoprosenttiin, kun liuokseen lisättiin 20,3 ja 37 painoprosenttia suolahappoa (HCl). AlCl3:n ja H2O:n heksahydraatin liukoisuuden tasapainovakio, aktiivisuudet ja aktiivisuuskertoimet laskettiin ja niitä verrattiin käytettävissä olevien arviointimenetelmien tuloksiin. Tulokset osoittautuivat hyödyllisiksi muussa kuin bauksiittisten malmien liuotuksessa alumiinioksidin uuttamiseksi muuttamalla komponenttisuolojen liukoisuuksia HCl:n lisäyksen yhteydessä.
Määritettiin myös AlCl3:n, FeCl3:n, KCl:n ja NaCl:n samanaikaiset liukoisuudet HCl-H2O-liuoksiin, ja niiden vaikutuksia sekoitussuolaliuoksista kiteytetyn AlCl3-6H2O:n puhtauteen käsiteltiin lyhyesti.