Ydin- ja valenssielektronit
Kun jatkamme tällä tavoin jaksollisen järjestelmän läpi kirjoittaen yhä suurempien atomien elektronikonfiguraatioita, tulee työläs kopioida jatkuvasti täytettyjen sisempien alikuorien konfiguraatioita. Käytännössä kemistit yksinkertaistavat merkintätapaa käyttämällä suluissa olevaa jalokaasusymbolia kuvaamaan edellisen rivin jalokaasun konfiguraatiota, koska jalokaasun kaikki orbitaalit ovat täynnä. Esimerkiksi edustaa neonin 1s2 2s2 2p6 elektronikonfiguraatiota (Z = 10), joten natriumin elektronikonfiguraatio, jossa Z = 11, on 1s2 2s2 2p6 3s1, kirjoitetaan 3s1
| Täydellinen elektronikonfiguraatio | Nobel-kaasun lyhenne | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Natrium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Täytyneillä sisemmillä orbitaaleilla olevat elektronit ovat lähempänä ydintä ja tiukemmin sidottuja siihen, ja siksi ne osallistuvat harvoin kemiallisiin reaktioihin. Kutsumme näitä ydinelektroneiksi. Edustavien alkuaineiden (jaksollisen järjestelmän sarakkeet 1, 2 ja 13-18) ydinelektronit ovat kaikki elektroneja, joiden n-arvo on pienempi kuin elektronikonfiguraation suurin n-arvo. Esimerkiksi natriumatomissa suurin n-arvo on 3. Näin ollen ydinelektronit ovat atomiorbitaaleissa, joiden n < 3, eli 1s-, 2s- ja 2p-orbitaaleissa olevia elektroneja. Natriumilla on siis 10 ydinelektronia. Palataan tähän ydinelektronien määritelmään myöhemmin uudelleen siirtymämetallien kohdalla.
Tämä tarkoittaa, että atomin kemia riippuu enimmäkseen sen uloimman kuoren elektroneista, niistä, joilla on suurin n-arvo ja joita kutsutaan valenssielektroneiksi. Yksinkertaistetun merkintätavan avulla valenssielektronien konfiguraatio on helpompi hahmottaa. Käytämme tätä merkintätapaa natriumin ja litiumin elektronikonfiguraatioiden vertailemiseksi:
| Natrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
On helposti havaittavissa, että sekä natriumilla että litiumilla on yksi s-elektroni valenssikuoressaan. Näin ollen voisimme ennustaa, että natriumilla ja litiumilla on hyvin samankaltainen kemia, mikä todellakin pitää paikkansa.
Kun jatkamme jakson 3 kahdeksan alkuaineen rakentamista, 3s- ja 3p-orbitaalit täyttyvät, yksi elektroni kerrallaan. Rivin päättää jalokaasu argon, jonka elektronikonfiguraatio on 3s2 3p6, mikä vastaa täytettyä valenssikuorta.
Esimerkki 2.2.2
Piirrä orbitaalikaavio ja johda sen avulla fosforin elektronikonfiguraatio, Z = 15. Mikä on sen valenssielektronikonfiguraatio?
Annetaan: Atomiluku
Kysytään: Orbitaalidiagrammi ja valenssielektronikonfiguraatio fosforille
Strategia:
- Etsitään fosforia lähimpänä oleva jalokaasu, joka edeltää fosforia jaksollisessa järjestelmässä. Vähennä sitten sen elektronien määrä fosforin elektronien määrästä saadaksesi fosforin valenssielektronien määrän.
- Viitaten kuvaan 2.1.1 piirrä orbitaalidiagrammi, joka esittää nämä valenssiorbitaalit. Sijoita valenssielektronit Hundin säännön mukaisesti käytettävissä oleviin orbitaaleihin aloittaen siitä orbitaalista, jonka energia on pienin. Kirjoita elektronikonfiguraatio orbitaalidiagrammistasi.
- Älä jätä huomiotta sisemmät orbitaalit (ne, jotka vastaavat lähimmän jalokaasun elektronikonfiguraatiota) ja kirjoita fosforin valenssielektronikonfiguraatio.
Ratkaisu:
A Koska fosfori on jaksollisen järjestelmän kolmannella rivillä, tiedämme, että sillä on suljettu kuori, jossa on 10 elektronia. Aloitamme vähentämällä 10 elektronia fosforin 15:stä.
B Viisi ylimääräistä elektronia sijoitetaan seuraaviin käytettävissä oleviin orbitaaleihin, jotka Kuva 2.1. Fosforin orbitaalit.1 kertoo meille olevan 3s- ja 3p-orbitaalit:
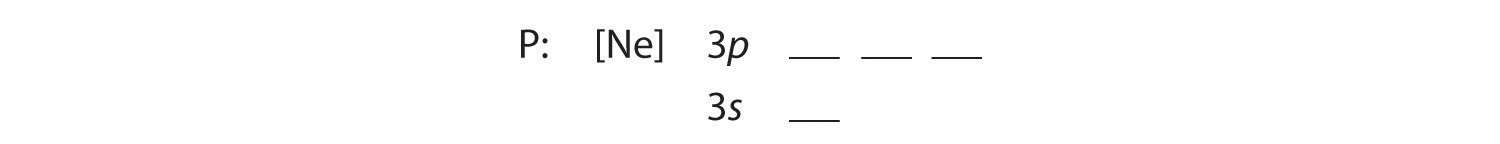
Koska 3s-orbitaali on energialtaan pienempi kuin 3p-orbitaalit, täytämme sen ensin:
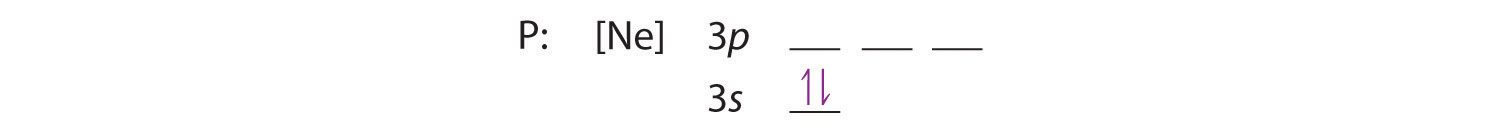
Hundin säännön mukaan jäljelle jäävät kolme elektronia valtaavat degeneroituneet 3p-orbitaalit erikseen, mutta niiden spinit ovat kohdakkain:
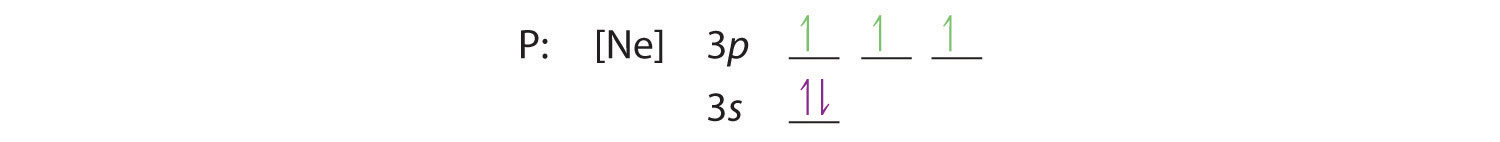
Elektronikonfiguraatio on 3s2 3p3.
C Saamme valenssielektronikonfiguraation jättämällä sisäiset orbitaalit huomiotta, mikä fosforin kohdalla tarkoittaa, että jätämme suljetun kuoren huomiotta. Näin saadaan valenssielektronikonfiguraatioksi 3s2 3p3.
Harjoitus 2.2.2
Piirrä orbitaalidiagrammi ja johda sen avulla kloorin elektronikonfiguraatio, Z = 17. Mikä on sen valenssielektronikonfiguraatio?
Vastaus: Kloorin elektronikonfiguraatio:
Valenssielektronikonfiguraatio: 3s23p5
Yleinen järjestys, jossa orbitaalit täyttyvät, on esitetty kuvassa 2.2.1. Kutakin n:n arvoa vastaavat alikuoret on kirjoitettu vasemmalta oikealle peräkkäisille vaakariveille, joissa kukin rivi edustaa jaksollisen järjestelmän riviä. Orbitaalien täyttöjärjestys on merkitty diagonaaliviivoilla, jotka kulkevat oikealta ylhäältä vasemmalle. Näin ollen 4s:n orbitaali täytetään ennen 3d:n orbitaalia suojaus- ja tunkeutumisvaikutusten vuoksi. Näin ollen neljännen jakson aloittavan kaliumin elektronikonfiguraatio on 4s1 ja kalsiumin 4s2. Seuraavat 10 alkua, siirtymämetallit, täyttävät viisi 3d-orbitaalia, joita seuraavat kolme 4p-orbitaalia. Huomaa, että tämän rivin viimeinen jäsen on jalokaasu krypton (Z = 36), Kr: 4s2 3d10 4p6, jolla on täytetyt 4s-, 3d- ja 4p-orbitaalit. Jaksollisen järjestelmän viides rivi on periaatteessa sama kuin neljäs, paitsi että 5s-, 4d- ja 5p-orbitaalit täytetään peräkkäin.
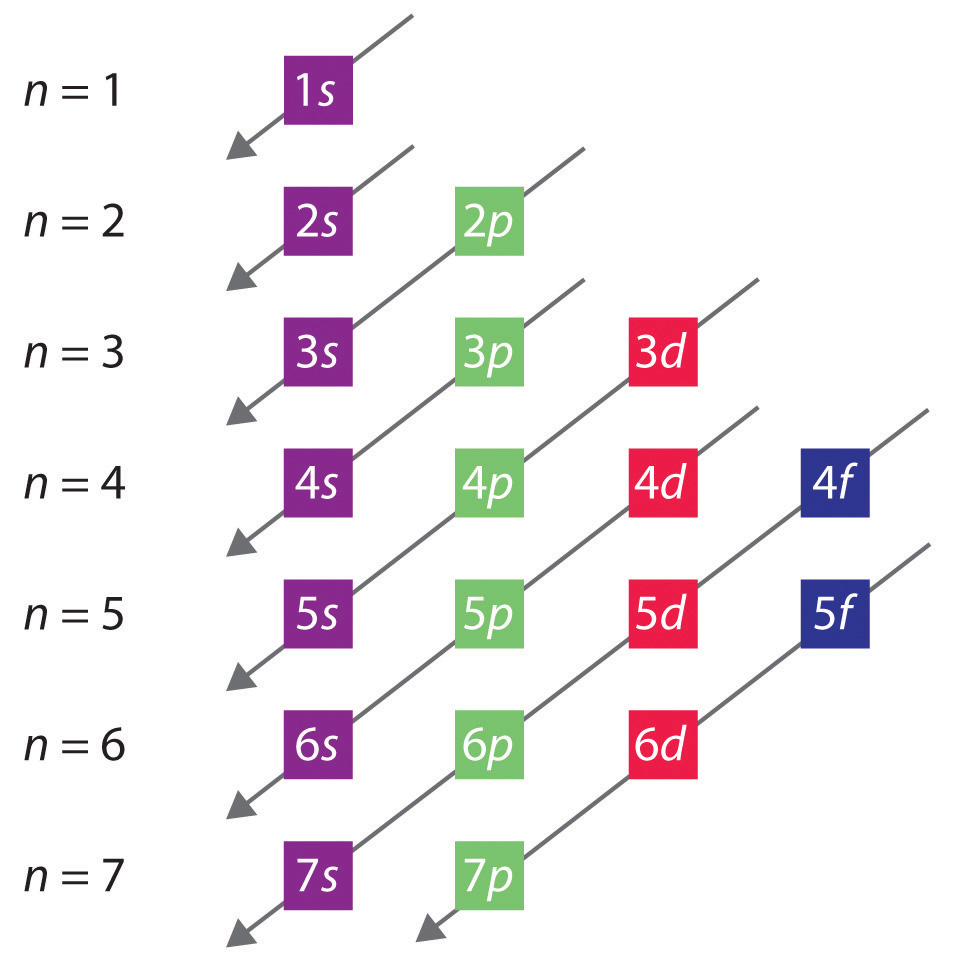
Kuva 2.2.1 Orbitaalien täyttymisjärjestyksen ennustaminen monielektronisissa atomeissa. Jos kirjoitat peräkkäisille riveille kunkin pääkvanttiluvun arvon alakuoret, havaittu järjestys, jossa ne täyttyvät, osoitetaan oikealta ylhäältä vasemmalle alhaalle kulkevalla diagonaalisarjalla.
Jaksollisen järjestelmän kuudes rivi poikkeaa kahdesta edellisestä, koska 4f-orbitaalit, joihin voi mahtua 14 elektronia, täyttyvät 6s- ja 5d-orbitaalien välissä. Alkuaineet, joiden valenssikuoressa on 4f-orbitaaleja, ovat lantanideja. Kun 6p-orbitaalit on lopulta täytetty, olemme saavuttaneet seuraavan (ja viimeisen tunnetun) jalokaasun, radonin (Z = 86), Rn: 6s2 4f14 5d10 6p6. Viimeisellä rivillä 5f-orbitaalit täyttyvät 7s:n ja 6d-orbitaalien välissä, jolloin saadaan 14 aktinidielementtiä. Koska protonien suuri määrä tekee niiden ytimistä epävakaita, kaikki aktinidit ovat radioaktiivisia.
Esimerkki 2.2.3
Kirjoita elohopean (Z = 80) elektronikonfiguraatio, jossa näkyvät kaikki sisäiset orbitaalit.
Annettu: Atomiluku
Kysytty: Täydellinen elektronikonfiguraatio
Strategia:
Käyttäen apuna kuvan 2.2.1 mukaista orbitaalikaaviota ja jaksollista järjestelmää täytä orbitaalit, kunnes kaikki 80 elektronia on sijoitettu.
Ratkaisu:
Sijoittamalla elektronit orbitaaleihin kuvassa 2.2 esitetyn järjestyksen mukaisesti.1 ja käyttäen apuna jaksollista järjestelmää, saadaan
| 1s2 | rivi 1 | 2 elektronia |
| 2s22p6 | rivi 2 | 8 elektronia |
| 3s23p6 | rivi 3 | 8 elektronia |
| 4s23d104p6 | rivi 4 | 18 elektronia |
| 5s24d105p6 | rivi 5 | 18 elektronia |
| rivit 1-5 | 54 elektronia |
Viiden ensimmäisen rivin täyttämisen jälkeen, jäljellä on vielä 80 – 54 = 26 elektronia. Kuvan 2.2.2 mukaan meidän on täytettävä 6s (2 elektronia), 4f (14 elektronia) ja 5d (10 elektronia) -orbitaalit. Tuloksena on elohopean elektronikonfiguraatio:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
täysi 5d-alakuori, 6s2 4f14 5d10 valenssikuoren konfiguraatio ja yhteensä 80 elektronia. (Kannattaa aina tarkistaa, että elektronien kokonaismäärä on yhtä suuri kuin atomiluku.)
Harjoitus 2.2.3
Vaikka alkuaine 114 ei ole tarpeeksi stabiili esiintyäkseen luonnossa, venäläisten ja amerikkalaisten tiedemiesten ryhmä loi kaksi alkuaineen 114 isotooppia ensimmäistä kertaa ydinreaktorissa vuonna 1999. Kirjoita alkuaineen 114 täydellinen elektronikonfiguraatio.
Vastaus: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Alkuaineiden elektronikonfiguraatiot on esitetty kuvassa 2.2.3, jossa on lueteltu orbitaalit niiden täyttymisjärjestyksessä. Useissa tapauksissa perustilan elektronikonfiguraatiot poikkeavat kuvan 2.2.1 ennustamista. Jotkin näistä poikkeavuuksista ilmenevät 3d-orbitaalien täyttyessä. Esimerkiksi kromin havaittu perustilan elektronikonfiguraatio on 4s1 3d5 eikä ennustettu 4s2 3d4. Vastaavasti kuparin havaittu elektronikonfiguraatio on 4s1 3d10 eikä s2 3d9. Todellinen elektronikonfiguraatio voidaan järkeistää puoliksi täytettyyn (ns1, np3, nd5, nf7) tai täytettyyn (ns2, np6, nd10, nf14) alakuoreen liittyvän lisävakauden avulla. Kun otetaan huomioon korkeampien energiatasojen väliset pienet erot, tämä lisästabiliteetti riittää siirtämään elektronin yhdeltä orbitaalilta toiselle. Raskaammissa alkuaineissa myös muut monimutkaisemmat vaikutukset voivat olla tärkeitä, mikä johtaa joihinkin kuvassa 2.2.3 esitettyihin lisäanomalioihin. Esimerkiksi ceriumin elektronikonfiguraatio on 6s2 4f1 5d1, jota on mahdotonta järkeistää yksinkertaisin termein. Useimmissa tapauksissa näillä ilmeisillä anomalioilla ei kuitenkaan ole merkittäviä kemiallisia seurauksia.
Huomautus
Lisästabiliteetti liittyy puoliksi täytettyihin tai täytettyihin alikuoriin.