Die Erzeugung erneuerbarer Energie deckt nicht immer die Nachfrage. Das hat den einfachen Grund, dass die Verbraucher Energie auch dann nutzen wollen, wenn die Sonne nicht scheint oder der Wind nicht weht. Mit Hilfe von Batterien lässt sich dieses Problem von Erzeugung und Nachfrage ausgleichen. Batterien können sich aufladen, wenn Energie erzeugt wird, und sich entladen, wenn Energie benötigt wird.
Batterien können noch viel mehr als nur Energieerzeugung und -nachfrage ausgleichen. Batterien können eine Vielzahl von Netzanwendungen unterstützen, wie z. B. Back-up-Dienste, die Erzeugung synthetischer Trägheit und die Umwandlung von nicht-synchronem Strom in synchronen Strom. Dies sind alles Dienste, die für den zuverlässigen Betrieb eines Stromnetzes unerlässlich sind.
Wie funktionieren also Batterien?
Batterien bestehen aus drei Hauptbestandteilen:
- einer positiven Elektrode;
- einer negativen Elektrode; und
- einem Elektrolyten, der die Elektroden voneinander trennt.
Unterschiedliche Elektroden und Elektrolyte führen zu unterschiedlichen chemischen Reaktionen, die die Funktionsweise der Batterie beeinflussen. Aus diesem Grund gibt es auf dem Markt und in der Entwicklung eine große Vielfalt an Batterien. Zu den verschiedenen Batterieeigenschaften gehören:
- Größe;
- Speicherkapazität;
- Reaktionsgeschwindigkeit;
- Aufladegeschwindigkeit;
- Lebensdauer;
- Sicherheit;
- Kosten; und
- Recyclingfähigkeit.
Die Vanadium-Redox-Batterie (VRB) ist eine der neuesten Batterien, die auf dem kommerziellen Markt auftauchen. Sie ist besonders vielversprechend, weil sie eine extrem hohe Speicherkapazität hat. Auch unter dem Gesichtspunkt des Umweltschutzes ist die VRB vielversprechend. Die VRB erzeugt keine Abfallprodukte und hat eine lange Lebensdauer. Die Chemikalien in einem VRB müssen nicht ersetzt werden und können unbegrenzt verwendet werden. Nur das VRB-Gehäuse und die Hardware müssen ausgetauscht werden. Die lange Lebensdauer bedeutet auch, dass die VRB eine kostengünstige Alternative zu anderen Optionen sein kann.
Die VRB hat eine positive und eine negative Kammer, die durch eine Membran getrennt sind. Die positive Kammer hat eine positive Elektrode und die negative Kammer eine negative Elektrode. In beiden Kammern zirkulieren Vanadiumelektrolyte: – ein positiver Vanadium-Elektrolyt oder eine positive Vanadium-Spezies in der positiven Kammer und eine negative Spezies in der negativen Kammer. Die Kammern sind mit Vorratsbehältern verbunden, so dass große Mengen der Vanadiumelektrolyte hineingepumpt werden können und in den Kammern zirkulieren. Die Membran verhindert, dass sich die positiven und negativen Elektrolyte vermischen, lässt aber Ionen (Atome mit positiver oder negativer Ladung) passieren.
Wenn der VRB geladen und entladen wird, werden die Vanadiumspezies gleichzeitig oxidiert und reduziert, wobei Elektronen durch die Membran übertragen werden. Die Oxidations-Reduktionsreaktion wird als Redoxreaktion bezeichnet. Bei der Reduktion werden Elektronen zugeführt. Bei der Oxidation gehen Elektronen verloren. Beim Aufladen wird der Elektrolyt in der positiven Kammer oxidiert und der Elektrolyt in der negativen Kammer reduziert. Bei der Entladung kehrt sich der Prozess um, und der Elektrolyt in der positiven Kammer wird reduziert, während der Elektrolyt in der negativen Kammer oxidiert wird.
Die Ladungs-Redox-Reaktion kann genutzt werden, um Strom zu speichern, wenn er erzeugt wird, und die Entladungs-Redox-Reaktion kann Strom liefern, wenn er benötigt wird. Die VRB hat einen Lade-/Entladewirkungsgrad von 75% – 80%.
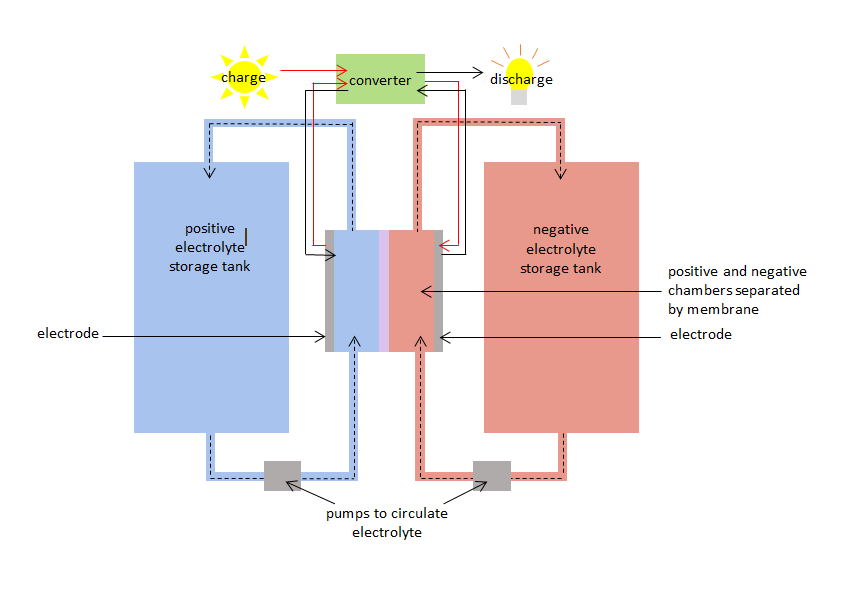
Diagramm der Vanadium-Redox-Batterie