Wie begann das Leben auf der Erde? Wie konnten auf einem jungen, felsigen Planeten Chemikalien in der richtigen Weise zusammenkommen, um die allerersten Zellen zu bilden? Wie begannen diese primitiven Zellen, sich wie Leben zu verhalten: zu wachsen, sich zu teilen und vorteilhafte Eigenschaften an die nächste Generation weiterzugeben?
Die Ursprünge des Lebens sind besonders undurchsichtig, weil die geologischen Aufzeichnungen – die Gesteinsschichten und die darin eingebetteten Fossilien, die Hinweise auf die Geschichte der Erde und des Lebens enthalten – vor etwa 3,9 Milliarden Jahren verschwunden sind, ausgelöscht durch Bewegungen in der Erdkruste. Infolgedessen fehlen den Wissenschaftlern direkte Beweise für die Bedingungen auf der frühen Erde, einschließlich des Nachweises der Moleküle, die in den Urteichen gewirbelt und die Bausteine des Lebens gebildet haben könnten.
Dies wirft eine Fülle von Fragen auf, genau die Art von großen Fragen, zu denen Jack Szostak hingezogen ist. Er und andere glauben, dass sie im Labor den langen Weg rekonstruieren können, der von den Chemikalien im Weltraum zur Entstehung der Erde, zur Chemie vor dem Leben auf dem Planeten, zu den frühen Protozellen und schließlich zu fortgeschrittenen Zellen mit Stoffwechsel und Proteinsynthese führte. Für solche weitreichenden Untersuchungen sind Fachkenntnisse in vielen Bereichen erforderlich, darunter Chemie und Biochemie, Geologie und Geophysik sowie Astronomie.
Szostak (ausgesprochen shah-stak) könnte die ideale Person sein, um Antworten zu finden. Als Nobelpreisträger, Professor für Genetik an der Harvard Medical School, Professor für Chemie und chemische Biologie an der Fakultät für Kunst und Wissenschaften, Rich Distinguished Investigator am Massachusetts General Hospital (MGH) und Forscher am Howard Hughes Medical Institute wird er von anderen als brillanter, engagierter Wissenschaftler beschrieben. Aber er ist auch für seine milde Bescheidenheit bekannt, einschließlich der Bereitschaft, sich tief in Themen einzulassen, die für ihn neu sind, und für seine Kollegialität, die dazu beiträgt, den Ideenaustausch zu fördern, der die Wissenschaft voranbringt.
Seine eigene Forschung konzentriert sich auf einen Abschnitt des Weges zum Leben: die Protozelle, „eine wirklich, wirklich einfache Urzelle, die sich aus Chemikalien zusammensetzen könnte, die schon früh auf der Erdoberfläche vorhanden waren“, erklärt Szostak. Er hofft zu verstehen, wie sie wachsen und sich teilen, sich vermehren und sich schließlich entwickeln konnte. „Wir wissen vielleicht nicht, was tatsächlich passiert ist, aber vielleicht können wir verschiedene mögliche Wege ausarbeiten“, sagt er. „Alles, was wir tun können, ist zu versuchen, im Labor Dinge zusammenzustellen, die plausibel erscheinen.“
„Gesteuerte Evolution“
Im August dieses Jahres feierte Szostak sein vierzigstes Jahr in Harvard und sein fünfunddreißigstes am MGH (wo sich sein Labor befindet), eine Amtszeit, die von wichtigen Entdeckungen in einer überraschenden Vielfalt von Bereichen geprägt ist. In den 1980er Jahren führte sein Labor Experimente mit Hefe durch, um die Genetik und Biochemie der DNA-Rekombination zu verstehen – eine Arbeit, die zum Modell der Doppelstrangbruch-Reparatur führte, das beschreibt, wie lange DNA-Stränge brechen, Segmente austauschen und sich dann wieder verbinden. Dies führte zu weiteren Forschungen über den Mechanismus der Rekombination während der Meiose, der Zellteilung, die zu Spermien und Eizellen führt.
Im gleichen Zeitraum machte sein Team auch wichtige Entdeckungen über Telomere – die Schutzkappen an den Enden der Chromosomen, die dafür sorgen, dass die DNA bei der Zellteilung ordnungsgemäß repliziert wird. Für diese Forschung erhielt Szostak später den Nobelpreis für Physiologie oder Medizin 2009, den er sich mit den Forschern Elizabeth Blackburn, Sc.D. ’06, jetzt emeritiert an der UC, San Francisco, und Carol Greider von Johns Hopkins, teilte.
Als Szostak im Oktober 2009 frühmorgens den Anruf aus Schweden erhielt, hatte er bereits mehr als 20 Jahre damit verbracht, grundlegende Beiträge in anderen Bereichen der Wissenschaft zu leisten. Nach der Entdeckung der Telomere Mitte der 1980er Jahre (die Forschung brachte verkürzte Telomere mit vielen Alterskrankheiten in Verbindung) stiegen viele Wissenschaftler in das Gebiet ein, und Szostak entschied sich für einen Richtungswechsel. „Es war ziemlich klar, was die nächsten Experimente sein mussten, und es fühlte sich so an, als ob alles, was wir taten, sowieso getan werden würde“, erinnert er sich. „Ich hatte noch nie das Gefühl, dass es sinnvoll ist, etwas zu tun, was sowieso getan wird. Das brachte mich dazu, mich umzusehen und zu überlegen, welche anderen wissenschaftlichen Fragen ich angehen könnte.“ 1984 nahm er das Angebot an, sein Labor vom damaligen Sidney Farber Cancer Institute ans MGH zu verlegen, um sich den dortigen Forschern anzuschließen, die an der Grundlagenforschung arbeiten. „Es war ein unglaubliches Angebot: Meine gesamte Forschung würde für 10 Jahre voll finanziert werden“, erinnert sich Szostak. „
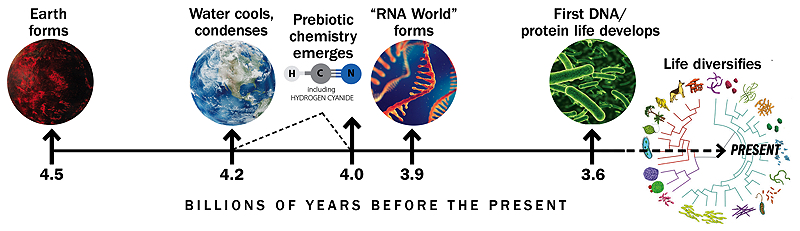
Die Zeitleiste basiert auf einer ähnlichen Grafik von Gerald Joyce
Nachdem er seine Optionen überdacht hatte, entschied er sich für RNA-Enzyme, die so genannten Ribozyme, ein Gebiet, das er als „interessant, überschaubar und wenig umkämpft“ ansah. Er und seine Doktoranden begannen mit der Entwicklung von Werkzeugen zur Entwicklung von RNA, den einzelsträngigen Molekülen in Zellen, die die in der DNA enthaltenen genetischen Informationen kopieren. In Reagenzgläsern brachte sein Team die RNA dazu, neue Aufgaben zu übernehmen, wie die Erkennung von Zielmolekülen und die Katalyse von Reaktionen. Bei diesem als „gerichtete Evolution“ bekannten Prozess wurden Mutationen in die RNA-Stränge eingebracht, nach Varianten gesucht, die nützliche Funktionen erfüllen könnten, und diese neuen Moleküle zur Reproduktion zugelassen. Ähnliche Arbeiten führten sie auch mit DNA, Peptiden und Proteinen durch.
1994 erhielt Szostak zusammen mit dem Forscher Gerald Joyce, jetzt vom Salk Institute for Biological Studies, den National Academy of Sciences Award in Molecular Biology für die gleichzeitige, aber unabhängige Entwicklung der In-vitro-Evolution von RNA. „Es ist eine Technologie, mit der man Moleküle herstellen kann, die den eigenen Wünschen entsprechen“, erklärte Joyce in einem Interview und beschrieb sie als vergleichbar mit der Art und Weise, wie Agrarwissenschaftler Kühe züchten, um mehr Milch zu produzieren, oder Pflanzen entwickeln, die der Trockenheit widerstehen. „Dies ist die molekulare Version davon. Und es ist etwas, das inzwischen sehr weit verbreitet ist“, fügt er hinzu (siehe „Harnessing Evolution“, Januar-Februar 2017, Seite 15), eine Methode zur Entwicklung neuer Moleküle für eine Reihe von Anwendungen, darunter auch Medikamente.
Für Szostak warf die Arbeit an der gelenkten Evolution neue Fragen auf. „Ich interessierte mich immer mehr dafür, wie die Evolution auf der frühen Erde von selbst in Gang kam“, erinnert er sich. „Es ist eine Sache, selektiven Druck auszuüben und die darwinistische Evolution im Labor mit Enzymen, Studenten und Instrumenten durchzuführen. Aber irgendwie hat sich die darwinistische Evolution ganz von selbst entwickelt. In Anbetracht der Tatsache, dass die Fähigkeit, sich zu entwickeln, ein Schlüsselmerkmal des Lebens ist, stellte Szostak eine der grundlegenden Fragen der Wissenschaft: Wie ist das Leben entstanden?
Ursprünge: „Drei große, fundamentale Fragen“
Der kanadisch-amerikanische Szostak wurde in London geboren, wo sein Vater einen Abschluss in Luftfahrttechnik machte. Die Familie kehrte schließlich nach Kanada zurück, wo sie in Ottawa und dann in Montreal lebte und sein Vater für die kanadische Luftwaffe arbeitete. (Szostaks Akzent erinnert noch an seine kanadische Herkunft.) Seine Mutter arbeitete viele Jahre lang in der Verwaltung eines Industriechemieunternehmens, und Szostak hatte dort als Teenager seinen ersten Sommerjob: Er testete die Farbechtheit im Farbstofflabor des Unternehmens. „Der Job war repetitiv und langweilig, aber er vermittelte mir zum ersten Mal einen Eindruck davon, wie wichtig es ist, Produkte für den realen Gebrauch zu testen und zu prüfen“, erinnert er sich. Zu diesem Zeitpunkt war er bereits ernsthaft an Wissenschaft, Mathematik und Technik interessiert. Mit 25 Jahren promovierte er an der Cornell University in Biochemie und bezeichnet seinen Doktorvater Ray Wu als einen wichtigen Mentor: „
Obwohl Szostak in seiner Laufbahn einige praktische, angewandte Forschungsarbeiten durchgeführt hat – eines der von ihm gegründeten Unternehmen, Ra Pharma, hat ein Medikament für die Krankheit Myasthenia gravis entdeckt, das in der klinischen Phase III getestet werden soll -, gilt seine größte Leidenschaft den Grundlagenwissenschaften.
„Dies ist eine aufregende Zeit, um in die Neurowissenschaften zu gehen, weil jetzt Probleme angegangen werden können, an die man vor 30 Jahren noch nicht einmal denken konnte.“
„Meiner Meinung nach gibt es drei große wissenschaftliche Grundfragen, die sehr interessant sind: der Ursprung des Lebens, der Ursprung des Universums und der Ursprung des Geistes oder des Bewusstseins“, bietet er an, während er in seinem ruhigen, fast leeren Büro im Mallinckrodt Laboratory in der Oxford Street in Cambridge sitzt. (Das Büro dient für gelegentliche Besprechungen; Szostak arbeitet hauptsächlich in seinem Labor im MGH). Nach dem Ursprung des Lebens interessiert ihn der Ursprung des Geistes am meisten. In den 1980er Jahren, als er überlegte, was er nach seiner Telomerforschung tun sollte, dachte er darüber nach, sich den Neurowissenschaften zuzuwenden und besuchte sogar Seminare in Harvard zu diesem Thema. „Es war faszinierend, aber auch deprimierend, weil die Technologie so primitiv war“, erinnert er sich. Seitdem hat er mit Interesse verfolgt, wie sich die Instrumente in diesem Bereich weiterentwickelt haben. „Es ist eine aufregende Zeit für junge Leute, die sich für die Neurowissenschaften interessieren, denn mit all den neuen Technologien können jetzt Probleme angegangen werden, an die man vor 30 Jahren nicht einmal denken konnte“, sagt er. „Dennoch ist das Gesamtproblem immer noch so groß und irgendwie entmutigend. So wie ich es sehe, arbeite ich an dem einfachsten dieser großen Probleme.“ Da sich Fragen zum Ursprung des Lebens gut für die heutigen Forschungstechnologien eignen, hält er es für „ein lösbares Problem“.
Modell-Protozellen und „chaotische“ RNA
Szostaks Team hat seit Anfang der 2000er Jahre Modell-Protozellen hergestellt, um herauszufinden, wie sie sich ursprünglich zusammengesetzt und entwickelt haben könnten. Diese primitiven Strukturen waren „extrem einfach“ im Vergleich zum einfachsten einzelligen Bakterium, das heute auf der Erde existiert, erklärt er. Die Urzellen verfügten wahrscheinlich über eine minimale Fettmembran und ursprünglich nur über ein einziges Gen, das der Zelle irgendeinen Vorteil verschaffte. Im Gegensatz dazu haben moderne Bakterien „mindestens Hunderte und typischerweise Tausende von Genen“
Trotz einiger Theorien, wonach frühes Leben in der Nähe von Hydrothermalquellen in der Tiefsee entstand, ist Szostak mehr von Forschungsergebnissen überzeugt, die zeigen, dass sich die frühesten Zellen an Land in Tümpeln oder Becken entwickelten, möglicherweise in vulkanisch aktiven Regionen. Ultraviolettes Licht und Blitzeinschläge könnten dazu beigetragen haben, Moleküle in der Atmosphäre in Cyanid und andere nützliche Stoffe umzuwandeln, um die Bausteine des Lebens zu erzeugen. Das flache Wasser würde diesen Stoffen einen Ort bieten, an dem sie sich in hohen Konzentrationen ansammeln könnten, und vulkanische Aktivität könnte heiße und kalte Temperaturschwankungen erzeugen, die für bestimmte chemische Reaktionen hilfreich sind.
Eine Geschichte der Erde und der Anfänge des Lebens
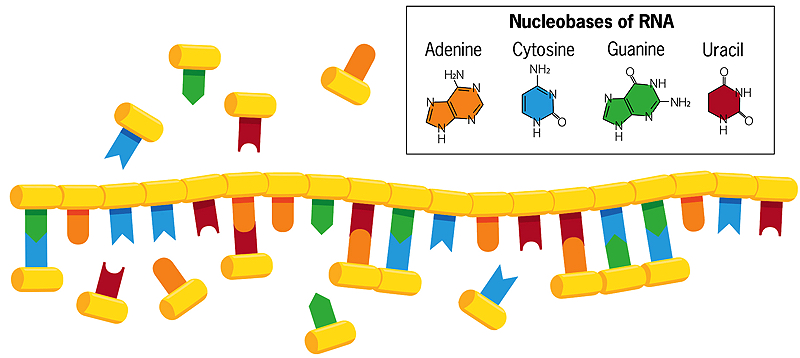
Im Gegensatz zur doppelsträngigen DNA, bei der sich die Basen Cytosin und Thymin mit Guanin und Adenin auf dem gegenüberliegenden Strang paaren, können die Basen eines einsträngigen RNA-Strangs im Wasser Assoziationen mit frei schwimmenden Nukleobasen bilden (siehe Abbildung oben). Wenn diese frei schwimmenden Basen dann miteinander verschmelzen, entsteht eine neue, spiegelbildliche Kopie des RNA-Strangs, die bei Erwärmung des Wassers vom Original abbricht. Wenn sich dieser neue Strang wiederum repliziert, entsteht eine Spiegelkopie von sich selbst, die mit dem ursprünglichen RNA-Strang übereinstimmt. Manchmal kommt es bei diesem Kopiervorgang zu Fehlern, die sich dann fortsetzen. Jede Kette, die als Vorlage für ihre eigene Replikation dient, entwickelt sich auf diese Weise und interagiert mit ihrer Umgebung.
Einige Wissenschaftler, darunter Gerald Joyce, vermuten, dass das Leben außerhalb der Zellen begonnen haben könnte, wobei frei schwimmende Moleküle einander begegneten und Verbindungen eingingen, die es ihnen ermöglichten, wie Leben zu handeln. Szostak argumentiert jedoch, dass die Zellmembran notwendig war, unter anderem, weil sie nützliche genetische Moleküle zusammenhält und verhindert, dass die nützlichen Stoffwechselprodukte, die von genetisch kodierten Ribozymen hergestellt werden, im umgebenden Wasser davonschwimmen oder von anderen vorbeiziehenden Protozellen aufgefangen werden.
Experimente in seinem Labor zeigten, wie eine solche Membran wachsen und sich teilen könnte. Die Forscher kombinierten Fettsäuren wie Ölsäure mit Wasser und einem Puffer (um den pH-Wert der Lösung stabil zu halten) und schüttelten dann die Lösung. Unter dem Mikroskop betrachtet, hatten sich die Bestandteile zu Vesikeln zusammengefügt: kreisförmige, flüssigkeitsgefüllte Strukturen mit zweischichtigen Membranen. Wenn man der Umgebung zusätzliche Fettsäuren hinzufügte, die als Nährstoffe dienten, wuchsen aus den Bläschen lange, haarähnliche Fäden, die so zerbrechlich waren, dass sie schon bei einem leichten Luftzug auf dem Objektträger in Stücke brachen. Das Team von Szostak erzielte ähnliche Ergebnisse mit verschiedenen membranbildenden Molekülen und in verschiedenen Umgebungen, was darauf hindeutet, dass dies eine plausible Möglichkeit für eine Protozellmembran ist, zu wachsen und sich dann zu teilen. Aber wie könnte diese Struktur nützliches genetisches Material an die nächste Generation von Tochterzellen weitergeben? „
Um vererbte Eigenschaften an nachfolgende Generationen weiterzugeben, sind die heutigen Zellen auf die DNA angewiesen – ein Doppelhelixmolekül, das aus den Nukleobasen Adenin, Cytosin, Guanin und Thymin besteht – um genetische Informationen zu speichern und zu übertragen. Für die Replikation der DNA in den Zellen sind jedoch sowohl das einzelsträngige Molekül RNA als auch Proteinenzyme erforderlich, und genetisch kodierte Proteine sind viel zu komplex, als dass sie sich auf der frühen Erde spontan gebildet hätten. Da RNA sowohl genetische Informationen speichern und übertragen kann (wie DNA) als auch chemische Reaktionen katalysieren kann (wie Proteinenzyme), glauben viele Forscher, dass primitive Zellen RNA-Moleküle benutzten, um sowohl genetische als auch enzymatische Aufgaben zu erfüllen.
In den späten 1960er Jahren schlug der britische Wissenschaftler Leslie Orgel vor, dass RNA oder etwas Ähnliches das erste Molekül auf der Erde gewesen sein könnte, das sich repliziert und entwickelt hat; dies wurde als die „RNA-Welt“-Hypothese bekannt. Orgel und andere arbeiteten jahrzehntelang daran, zu verstehen, wie RNA-Ketten zusammenkommen und sich replizieren konnten, aber ihre Bemühungen waren nicht ganz erfolgreich. „Am Anfang gab es viele Fortschritte, doch dann geriet die Forschung ins Stocken, weil es ein Dutzend verschiedener Probleme gab, für die es damals keine eindeutige Antwort gab“, erklärt Szostak. „So ziemlich jeder war frustriert und dachte: ‚Vielleicht hat das Leben nicht mit RNA begonnen. Vielleicht gibt es etwas Einfacheres, das leichter herzustellen und zu replizieren ist.“
„Wir wissen heute so viel mehr, und indem wir die Dinge einfach in einzelne, kleinere Probleme zerlegen, konnten wir einige davon lösen.“
Die Forscher suchten nach Alternativen zur RNA, „und das führte zu 10 bis 20 Jahren wirklich interessanter Chemie, in denen viele interessante Moleküle entwickelt wurden“, bemerkt Szostak. „Aber bis jetzt ist nichts Einfacheres oder Besseres als RNA aufgetaucht, das wirklich funktioniert“. Einige Forscher vertreten die „Metabolismus-first“-Hypothese, die besagt, dass das Leben ohne genetisches Material durch eine Reihe von sich selbst erhaltenden Reaktionen entstanden sein könnte, doch Szostak und andere sind davon nicht überzeugt. Vor etwa sieben Jahren begann er, sich erneut mit den Hürden zu beschäftigen, die Orgel und seine Zeitgenossen beim Verständnis der RNA-Synthese zu überwinden hatten. „Wir wissen jetzt so viel mehr“, erklärt er, „und indem wir die Dinge in einzelne, kleinere Probleme zerlegen, konnten wir einige davon lösen.“
Szostaks Labor konzentriert sich jetzt fast ausschließlich darauf, wie sich die ursprüngliche RNA selbst kopiert haben könnte. Moderne RNA setzt sich in sehr regelmäßiger, vorhersehbarer Weise zusammen, wobei die Nukleotidbausteine wie eine Kette ineinander greifen. Jeder Block enthält einen Zucker (Ribose), ein Phosphat und eine von vier Nukleobasen (auch Stickstoffbasen genannt) – Adenin, Cytosin, Guanin und Uracil (gewöhnlich A, C, G und U genannt). Die Ribose-Phosphat-Einheiten sind miteinander verbunden und bilden das RNA-„Rückgrat“. In modernen Zellen katalysieren Proteinenzyme die Reaktion, die die Nukleotideinheiten zu RNA-Ketten zusammenfügt.
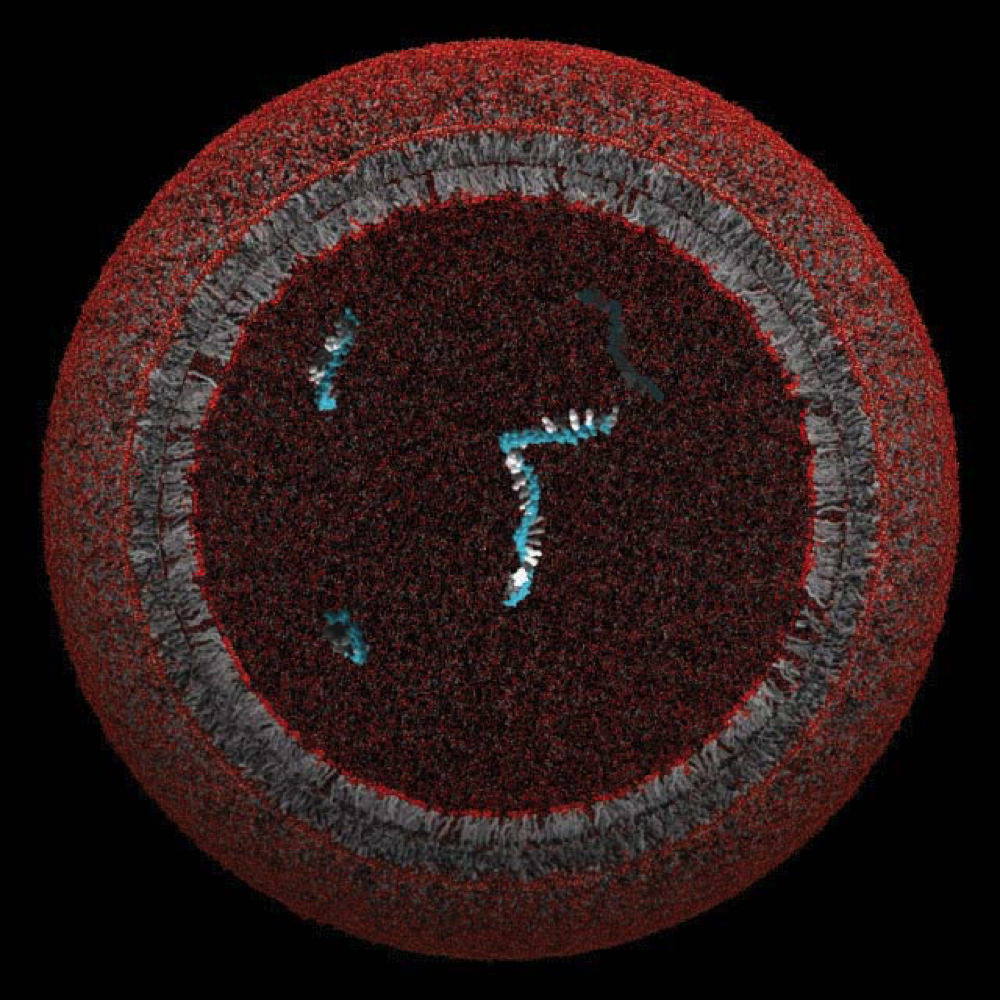
Eine Modell-Protozelle, deren Lipidmembran ein einzelnes Gen umschlossen und geschützt haben könnte
Bild mit freundlicher Genehmigung des Szostak-Labors
In Protozellen auf der frühen Erde hätte die RNA-Kette als Schablone gedient, an der sich eine neue, komplementäre Kette von Nukleotiden zusammenfügte, bevor sie sich ablöste, um zu einer weiteren Schablone zu werden, an die sich andere frei schwimmende Nukleotide anhängen konnten. Doch anders als die vorhersagbare moderne RNA hatte die frühe RNA nicht den Vorteil von Proteinen, die den Bauprozess katalysieren. (Da sich Proteine nicht ohne die komplexe und hoch entwickelte zelluläre Maschinerie bilden können, die für ihre Synthese erforderlich ist, gehen die meisten Forscher davon aus, dass es sie auf der Urerde nicht gab.) Die frühe RNA war daher wahrscheinlich unordentlicher, mit viel mehr Variationen im Zuckergerüst und in den Basen, sagt Szostak. Sein Team experimentiert derzeit, „um eine Vorstellung davon zu bekommen, welche Variabilität toleriert und welche aussortiert werden würde. Unser derzeitiges Modell geht davon aus, dass man mit etwas beginnt, das chaotisch ist und viele verschiedene Variationen aufweist, und dass man im Laufe der Replikationszyklen etwas erhält, das der modernen homogenen RNA näher kommt.“
Eine Arbeit von Szostak und der Doktorandin Seohyun Kim aus dem Jahr 2018 veranschaulicht die mögliche Variabilität der frühen RNA und ihrer Bausteine A, C, G und U. Szostak und Kim schlagen vor, dass die RNA mit verschiedenen Nukleobasen begonnen haben könnte, und ihre Experimente haben gezeigt, dass das Nukleosid Inosin, das aus A (Adenin) hergestellt werden kann, effektiv anstelle von G (Guanosin) funktioniert. „Das vereinfacht das Gesamtproblem“, erklärt Szostak. „Jetzt müssen wir nur noch wissen, wie man A herstellt.“
Weitere aktuelle Experimente im Labor haben sich auf die Metallionen konzentriert, die benötigt werden, um den RNA-Kopierprozess in Gang zu setzen. Normalerweise verwenden die Forscher Magnesium, „aber wir müssen es in sehr hohen Konzentrationen verwenden“, was negative Nebenwirkungen hat, da es den Abbau von RNA oder die Zerstörung der Zellmembran auslöst. „Hoffentlich finden wir einen einfachen, plausiblen Weg, um alles mit weniger Magnesium zum Laufen zu bringen, oder vielleicht müssen wir das ganze Problem neu überdenken und aus einer anderen Richtung angehen“, erklärt Szostak. „

Erwärmung und Abkühlung durch Vulkanismus, wie an der Grand Prismatic Spring im Yellowstone, hätten die frühe Evolution der RNA erleichtert.
Foto von Istock Images
Einige der Wege funktionieren nicht und führen sogar zu Fehlern. Im Jahr 2016 veröffentlichte Szostaks Labor eine Arbeit in Nature Chemistry, die zeigte, dass ein Peptid der RNA bei der Replikation ohne Enzyme geholfen haben könnte. Kurz darauf stieß die wissenschaftliche Mitarbeiterin Tivoli Olsen zum Labor und konnte diese Ergebnisse nicht reproduzieren. Ihre Überprüfung der Arbeit ergab, dass das Team die Daten falsch interpretiert hatte, woraufhin Szostak die Arbeit zurückzog. „Wir arbeiten an schwierigen Problemen, und das Schwierigste in der Wissenschaft ist, wie Feynman sagte, sich nicht selbst zu täuschen“, sagt Szostak. Die potenzielle Lösung war aufregend, „und ich glaube, sie hat uns einfach blind gemacht für das, was vor sich ging“. Die „rettende Gnade“, fügt er hinzu, ist, dass sie die Fehler selbst entdeckten, obwohl er sich wünschte, dass dies „vor der Veröffentlichung der Arbeit statt danach“ geschehen wäre. Ich würde sagen, dass viele unserer Ideen am Ende falsch sind, aber normalerweise erkennen wir das ziemlich schnell.“
Er ist optimistisch, was das Potenzial der jüngsten Entdeckungen in anderen Labors angeht. John Sutherland vom Labor für Molekularbiologie des Medical Research Council (MRC) in Cambridge, England, entdeckte beispielsweise vor kurzem eine neue Technik zur Aktivierung von Nukleotiden, d. h. zur chemischen Modifizierung dieser Bausteine, um den Replikationsprozess anzutreiben. Sutherland teilte diese Entdeckungen mit Szostaks Labor, bevor sie veröffentlicht wurden, und Szostak sagt, dass sie nach Möglichkeiten suchen, diese Technik in ihre eigenen Experimente einzubauen.
Wenn sein Team funktionierende Protozellen zusammensetzt, die RNA-Stücke enthalten, erwarten sie, dass Informationen in einigen spezifischen RNA-Sequenzen der sie umgebenden Protozelle einen gewissen Nutzen bringen. So deuten frühere Arbeiten darauf hin, dass sich einige RNA-Sequenzen zu einem Ribozym falten könnten, das etwas fortschrittlichere Lipide für die Zellmembran herstellen könnte. „Jede RNA-Sequenz, die irgendetwas tut, was ihren eigenen Zellen hilft, zu überleben oder sich schneller zu replizieren, wird anfangen, die Population zu übernehmen“, erklärt Szostak. „Das sind die Anfänge der darwinistischen Evolution.
Nach dem Nobelpreis hätte Szostak das Labor verlassen können, um sich Reisen und Einladungen zu Vorträgen zu widmen, aber „er bleibt auf die Wissenschaft konzentriert“, sagt Gerald Joyce. „Das ist es, was ich am meisten an ihm bewundere. Manche mögen die Grundlagenforschung als intellektuellen Luxus betrachten, aber ihre Vertreter argumentieren, dass jede angewandte Wissenschaft mit den Ergebnissen der Grundlagenforschung beginnt. „Als Crick und Watson sich hinsetzten und anfingen, Pappmodelle der DNA-Struktur zu basteln, hatten sie keine Ahnung, dass daraus 70 Jahre später eine milliardenschwere Industrie entstehen würde“, bemerkt John Sutherland.
Szostak ist nach wie vor bestrebt, diese großen, schwierigen Fragen zu lösen und die Arbeit von Jahrzehnten fortzusetzen. „Ich hoffe, dass ich in der Lage sein werde, ein sich entwickelndes zelluläres System zu bauen, bevor ich in Rente gehe“, sagt er. Er ist optimistisch, was seine Chancen angeht. „Ich glaube, wir sind auf dem Weg dorthin. Es gibt noch ein paar schwierige Probleme, und ich denke, dass wir in ein paar Jahren hoffentlich alles gelöst haben werden.“