Atome können Elektronen gewinnen oder verlieren, um in einem Prozess, der Ionisierung genannt wird, Ionen zu bilden (Verbindungen, die auf diese Weise entstehen, werden ionische Verbindungen genannt). Wenn sich ionische Verbindungen in Wasser auflösen, trennen sich ihre Ionen voneinander in einem Prozess, der Dissoziation genannt wird. Eine interessante Eigenschaft von Wasser und vielen anderen kovalenten Verbindungen ist, dass auch sie in Ionen dissoziieren können. Im Gegensatz zu ionischen Verbindungen wie Natriumchlorid werden sie nicht ionisiert, bevor sie dissoziieren; sie führen Ionisierung und Dissoziation gleichzeitig durch.
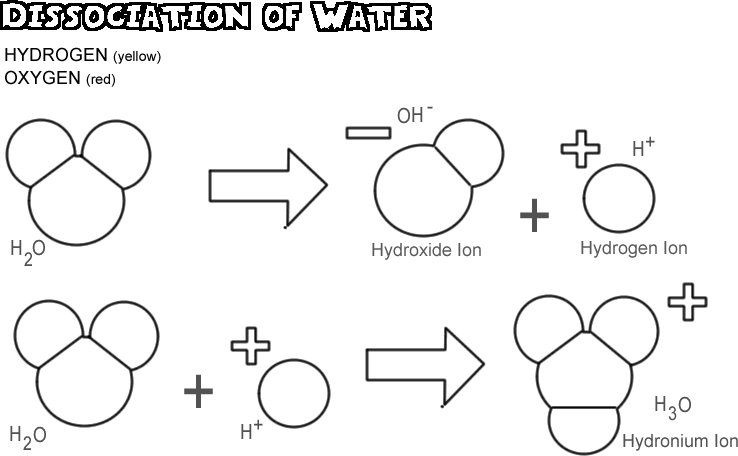
Dissoziation von Wasser
Wenn Wasser dissoziiert, lässt einer der Wasserstoffkerne sein Elektron beim Sauerstoffatom zurück und wird zu einem Wasserstoffion, während der Sauerstoff und die anderen Wasserstoffatome zu einem Hydroxidion werden. Da das Wasserstoffion kein Elektron hat, um die positive Ladung seines Protons zu neutralisieren, hat es eine volle Einheit positiver Ladung und wird als H+ bezeichnet. Das Hydroxid-Ion behält das zurückgebliebene Elektron und hat somit eine volle Einheit negativer Ladung, symbolisiert durch OH-. Das Wasserstoff-Ion (Proton) wandert nicht lange allein, bevor es sich an das Sauerstoffatom eines zweiten, nicht ionisierten Wassermoleküls anlagert und ein Hydronium-Ion (H3O +)
In einer beliebigen Wasserprobe sind nur sehr wenige Moleküle gleichzeitig dissoziiert, nämlich nur etwa eines von 550 Millionen. Es findet jedoch ein ständiger Wechsel statt; wenn sich ein Wasserstoffion wieder an ein Hydroxidion bindet, um ein Wassermolekül zu bilden, dissoziiert ein anderes Wassermolekül, um das Wasserstoff- und das Hydroxidion in der Lösung zu ersetzen.
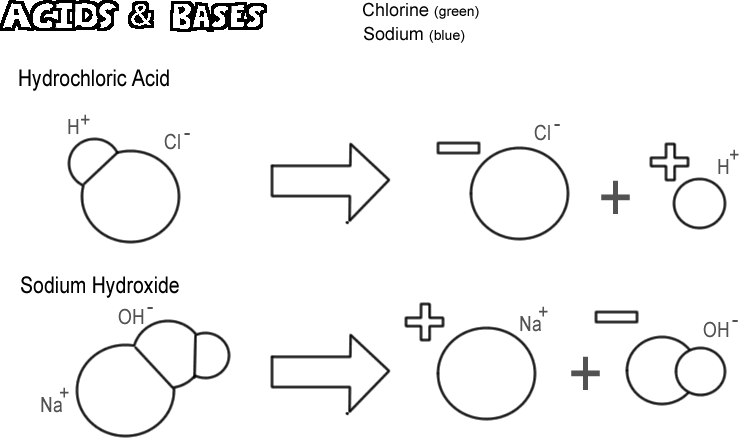
Salzsäure
Einige Moleküle, ionische und kovalente, dissoziieren so, dass sie ein Wasserstoffion freisetzen, ohne ein Hydroxidion freizusetzen. Diese Stoffe werden als Säuren bezeichnet. Da ein Wasserstoffion in den meisten Fällen nur ein einziges Proton ist, definiert der Chemiker eine Säure als „Protonendonator“. Wenn sehr viele Protonen (Wasserstoffionen) „gespendet“ werden, kann die Wirkung sehr tiefgreifend sein, wie z. B. das Verbrennen der Haut oder das Auflösen von Metall. Bei der abgebildeten Säure handelt es sich um Salzsäure. Reine Salzsäure ist gasförmig, aber sie löst sich leicht in Wasser auf und bildet eine Lösung aus Wasserstoff- und Chloridionen. Da sie fast vollständig in Wasser dissoziiert, nennt man sie eine starke Säure. Säuren, die nicht vollständig dissoziieren, nennt man schwache Säuren.
Natriumhydroxid
Das Gegenteil einer Säure ist eine Base, die auch als Alkali bezeichnet wird. Eine typische starke Base ist Natriumhydroxid, der Hauptbestandteil von Lauge. Natriumhydroxid dissoziiert unter Bildung eines Natriumions und eines Hydroxidions. Eine Base ist definiert als ein „Protonenakzeptor“. Die gebräuchlichsten Basen bilden bei ihrer Dissoziation ein Hydroxidion, das das Proton aufnimmt. Eine starke Base kann eine viel schlimmere Verätzung der Haut verursachen als eine Säure.
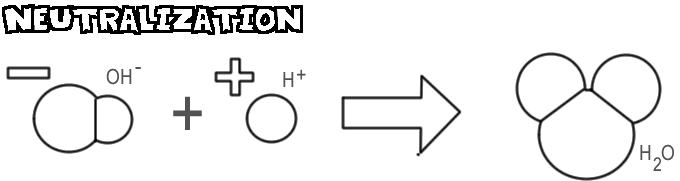
Neutralisation
Wenn eine Base und eine Säure gemischt werden, verbindet sich das Hydroxid-Ion der Base mit dem Wasserstoff-Ion der Säure und bildet Wasser. Dieser Vorgang wird als Neutralisation bezeichnet.
Fragen:
1. Was passiert, wenn ein Atom ein Elektron gewinnt oder verliert?