Un program de cercetare a fost realizat pentru a îmbunătăți tehnologia de procesare pentru extragerea aluminei din materiale nebauxitice. Succesul acestui program a furnizat tehnologia necesară pentru producerea unei rezerve adecvate de alumină de înaltă calitate din surse interne, satisfăcând astfel nevoile economice și strategice naționale referitoare la producția de aluminiu. Procedeul cu acid clorhidric pentru recuperarea aluminei din minereuri de calitate inferioară este unul dintre procedeele studiate în cadrul programului de cercetare.
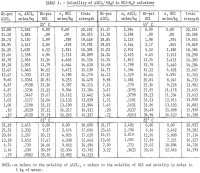
Una dintre fazele acestui procedeu utilizează efectul concentrației de ioni clorură asupra solubilității ionului de aluminiu în soluție. La 25° C, solubilitatea AlCl3 în apă pură este de aproximativ 31 pct în greutate și scade odată cu creșterea concentrației de acid clorhidric (HCl), devenind 0,1 pct atunci când concentrația de HCl crește până la 37 pct. Acest comportament a făcut obiectul a numeroase cercetări, procese și brevete. Astfel, este posibil să se lixiveze un minereu nebauxitic cu HCl, să se decanteze și să se filtreze lichidul și să se adauge HCl gazos pentru a precipita AlCl3-6H2O. Soluția acidă rămasă poate fi apoi utilizată pentru a leșia alt minereu, iar AlCl3-6H2O precipitat poate fi calcinat pentru a obține Al2O3 . Peters, Johnson și Kirby prezintă o discuție detaliată și o evaluare a acestui proces. Datele termodinamice, cum ar fi activitățile ionice și solubilitățile, necesare pentru analiza, interpretarea și îmbunătățirea completă a acestui proces sunt puține, iar datele existente privind solubilitatea sunt limitate la un interval îngust de temperatură. Prin urmare, obiectivele acestei investigații au fost (1) determinarea solubilității AlCl3, într-un interval de temperatură de la 25° la 85° C cu o concentrație de HCl de la 0,0 la 37.2 pct; (2) de a calcula activitățile AlCl3 și a H2O în soluții care conțin diverși electroliți , precum și constanta de echilibru pentru dizolvarea AlCl3-6H2O; și (3) de a sugera domenii de cercetare pentru generarea de date utile.
- Aparatură
- Procedură experimentală
- Analiză
- Rezultate
- Comparare cu alte date
- Tratament termodinamic
- Produs de solubilitate și activități în sistemul AlCl3-6H2O-H2O
- Stimarea activităților în sistemul AlCl3-6H2O-H2O
- Produs de solubilitate și activități în sistemul AlCl3-6H2O-HCl-H2O
- Stimarea activităților în sistemul AlCl3-6H2O-HCl-H2O
- Sistemul AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O
- Domenii recomandate pentru cercetare
- Clorura de aluminiu în soluții apoase de acid clorhidric
Aparatură
Aparatura folosită pentru măsurătorile de solubilități este prezentată în figura 1. Un balon de 100 ml, A, conține o soluție de electroliți și un oarecare exces de sare. Un filtru de sticlă friptă, B, fuzionat pe un tub Pyrex de 6 mm-OD este unit cu un tub exterior atașat la două robinete de teflon, D și E. Ansamblul superior este atașat de A la C printr-un racord de compresie din nailon filetat cu inel 0 din neopren. Un tub de polietilenă de 6 mm OD, F-L, distribuie o probă de soluție filtrată la B în cel de-al doilea balon, K, atunci când A este presurizat prin robinetul de închidere D, iar E este deschis. Racordul de la J este similar cu cel de la C. Baloanele sunt fixate pe o bară, G, care este atașată la un mecanism de balansare, cu H ca axă de balansare pentru a scutura baloanele A și K, alternativ în sus și în jos. Un termostat acoperit, 0, este controlat cu o precizie de ±0,2° C. Un control mai atent al temperaturii nu este necesar deoarece solubilitatea este o funcție foarte slabă a temperaturii.
Procedură experimentală
Măsurătorile solubilităților la 25°, 45°, 65° și 85° C au fost efectuate în condiții de echilibru de fază cu materiale analitice de calitate reactivă. Cantități adecvate de AlCl3-6H2O, soluție de HCl 37-pct și apă distilată au fost introduse în balonul A pentru a forma aproximativ 90 ml de soluție cu o cantitate mică de cristale de sare în exces (în continuare „sare” se referă la clorura de aluminiu hexahidrat). Cantitățile de materiale au fost estimate pe baza datelor existente privind solubilitatea sistemului ternar AlCl3-6H2O-HCl-H2O. După ce s-a format soluția în balonul A și s-a asamblat aparatul, acesta a fost scufundat în apă până la nivelul N, iar termostatul a fost reglat la temperatura dorită. S-a folosit o agitare mecanică continuă a baloanelor în timpul fiecărei serii care a durat 2 până la 3 zile. Periodic, s-a folosit, de asemenea, o agitare manuală viguroasă pentru a asigura
echilibrul, în special în cazul în care sarea ar putea forma o sare solidă complexă cu HCl. La sfârșitul perioadei de echilibrare, flacoanele au fost lăsate să rămână nemișcate în poziție verticală timp de 1 oră pentru a asigura sedimentarea particulelor solide. Se deschid apoi robinetele de închidere D și E pentru a transfera aproximativ jumătate din soluție în balonul de prelevare a probelor, K. Nivelul din B sub nivelul lichidului din A a determinat, de obicei, cantitatea de soluție transferată în K. Greutatea soluției din K a fost determinată prin cântărirea balonului înainte de asamblare și după admiterea soluției și dezasamblare. O cantitate cunoscută de apă distilată a fost injectată în balon prin L pentru a dilua proba și a dizolva orice vapori din faza gazoasă. Presiunea parțială a HCl în apa pură depășește 1 torr la 25° C la molalități mai mari de 8 m (m după un număr într-o propoziție denotă molalitatea); prin urmare, la concentrații mai mici de 8 m, este îndoielnic că ar putea avea loc vreo pierdere de HCl în timpul prelevării de probe. Din acest motiv, unele dintre încercările la 25° C, conținând mai puțin de 4 m HCl, au fost făcute cu un singur balon cu dop și, după echilibrare, o parte din soluție a fost decantată cu grijă și filtrată pentru prelevare.
Analiză
Soluțiile au fost analizate după diluții corespunzătoare pentru concentrațiile totale de ioni clorură și de ioni aluminiu. Concentrația totală de ioni clorură a fost determinată prin titrare potențiometrică cu Ag+. Concentrația de Al+++ a fost determinată mai întâi prin complexarea cu un exces de acid etilendiamină-tetraacetic (EDTA) și apoi titrarea inversă a excesului de EDTA cu Cu++ la un pH de 3,8.
Conținutul de AlCl3 a fost calculat din analiza Al+++. Sustragerea ionului clorură din cantitatea calculată de AlCl3 din concentrația totală de ioni clorură a permis calcularea concentrației de HCl în soluțiile saturate.
Această metodă de calcul a fost folosită pentru toate analizele, cu excepția celor în care se știa că concentrația de HCl este zero, adică atunci când AlCl3 era singurul electrolit din apa pură. Pentru aceste analize, concentrația de AlCl3 a fost calculată pur și simplu din analiza ionilor de clor, care a fost cea mai precisă dintre cele două analize, deși pentru aceste probe au fost completate în continuare atât analizele Al+++, cât și analizele Cl-.
Diferența dintre analiza Cl- calculată din analiza Cl- total și analiza Cl- din analiza Al+++ pentru experimentele fără adaos de HCl a fost de ±0,2 % în greutate Cl-. Acest lucru indică faptul că, în medie, analiza de Al++ a fost supusă unei erori de +0,05 pct în greutate, deoarece se știa că analiza Cl este considerabil mai precisă decât analiza Al+++. În soluțiile care conțin HCl, o eroare de ±0,05 % în conținutul de Al+++ s-a reflectat ca ±0,20 pct în conținutul de HCl; acest lucru s-a datorat faptului că, în timp ce conținutul total de Cl a fost foarte precis, Cl contribuit de HCl adăugat și, prin urmare, molalitatea de HCl, a fost calculată prin diferență, așa cum s-a menționat anterior.
Rezultate
Rezultatele sunt rezumate în tabelul 1 și prezentate în figura 2. Concentrația maximă de HCl pentru datele prezentate în tabelul 1 pentru 85° C este de aproximativ 30 % în greutate. Măsurătorile au fost oprite la această concentrație din cauza presiunilor de echilibru excesive în sistem la concentrații mai mari. Trebuie, de asemenea, remarcat faptul că s-au efectuat mai puține determinări la 65° și 85° C decât la 25° și 45° C. S-au efectuat replici la cele două temperaturi mai scăzute pentru a oferi o indicație a repetabilității satisfăcătoare a rezultatelor. Figura 2 arată că solubilitatea sării de aluminiu scade drastic odată cu creșterea concentrației de HCl. Prin urmare, lichefierea minereurilor nebauxitice cu soluție de HCl și precipitarea sării pure pentru extragerea aluminiului prin adăugarea de HCl este un proces fezabil; un astfel de proces a făcut obiectul mai multor brevete. Rezultatele arată că solubilitatea nu se modifică foarte mult cu temperatura, iar pentru o creștere a temperaturii cu 60° C (de la 25° la 85° C), solubilitatea sării pure singure în apă crește doar cu 2,2 pct în raport cu solubilitatea la 25° C.
Comparare cu alte date
Solubilitatea sării pure în apă la 25° C s-a dovedit a fi în concordanță exactă cu datele lui Palitzch și cu cele ale lui Ehret și Frere. Rezultatele date de Malquori sunt cu aproximativ 10 pct mai mari. Solubilitatea obținută de Tanaka este cu aproximativ 3,3 pct mai mare decât în prezenta cercetare la 45° C și la 65° C.
Efectul HCl în apă asupra solubilității sării a fost investigat de Seidel și Fisher la 0° C și de Malquori la 25° C. Rezultatele primilor cercetători la 0° C concordă foarte bine cu datele din tabelul 1, extrapolate la 0° C, în timp ce cele ale celui de-al doilea cercetător la 25° C se împrăștie oarecum și sunt în dezacord aproximativ cu 3 pet la concentrații mici de HCl; cu toate acestea, concordanța în intervalul de la 5 la 30 % în greutate de HCl este de 1 pct.
Tratament termodinamic
Produs de solubilitate și activități în sistemul AlCl3-6H2O-H2O
Coeficientul de activitate ionică Y12 al AlCl3 în apă a fost măsurat până la 1,8 m de Mason, iar valorile recalculate sunt date de Robinson și Stokes. Deoarece se așteaptă ca coeficientul de activitate de la 1,8 m până la valoarea de saturație de 3,3835 m să crească de mai mult de cinci ori, valoarea de saturație este utilizată pentru calcul prin metoda descrisă în detaliu într-un raport anterior (1 m = 1 mol în 1 kg de solvent). Metoda, cu aplicarea sa nouă corespunzătoare, este rezumată pe scurt în acest raport. Activitatea ionică medie a AlCl3, desemnată prin a12, se exprimă prin următoarea serie de puteri în termeni de molalitate m:

Ecuația corespunzătoare pentru activitatea apei aw, se obține prin aplicarea relației Gibbs-Duhem; rezultatul este
![]()
Rețineți că exponenții lui m cu aceiași coeficienți ai lui C, D, etc., sunt cu 1 mai mari în ecuația 2 decât în ecuația 1, iar coeficientul lui m din ecuația 2 provine din teoria Debye-Huckel, așa cum a fost discutată de Gokcen.
Reacția de dizolvare a sării este
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
unde (s) înseamnă solid și (l) lichid.
Constanta de echilibru corespunzătoare este
![]()
unde numitorul, activitatea solidului, se consideră unitate deoarece compoziția sa rămâne neschimbată atunci când se adaugă alți electroliți în soluție. Înlocuim pentru a12 în 1n Kp direct din ecuația 1 și pentru aw din ecuația 2 după ce înmulțim ecuația 2 cu 0,108093 pentru ca coeficientul 1n aw să fie egal cu 6. Deoarece Kp este independent de compoziție, este evident că
![]()
După înlocuirile necesare din ecuațiile 1 și 2 și apoi înlocuirea valorii medii m = 3.3835 din primele două serii din tabelul 1, se obține o ecuație pentru rezolvarea celor șase coeficienți necunoscuți din ecuația 1, iar celelalte cinci ecuații se obțin prin înlocuirea fiecăreia dintre cele cinci valori experimentale ale coeficientului mediu de activitate ionică al AlCl3 , y12 din tabelul 2, în
![]()
și apoi înlocuirea fiecărui rezultat în ecuația 1. Cele șase ecuații simultane obținute în acest mod sunt apoi rezolvate pe calculator. Rezultatele sunt următoarele:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
și H = +11,6880.
Substituind aceste valori în ecuațiile 1, 2 și 4 se obțin valorile lui Y12, aw și Kp. Rezultatele sunt prezentate în tabelul 3 sub titlul „Rezultatele Biroului:” Trebuie remarcat faptul că activitatea apei poate fi acum calculată din ecuația 2, iar presiunea de vapori a apei peste soluție, P, din
aw = P/P°,……………………………….(7)
unde P° este presiunea de vapori a apei pure la aceeași temperatură. Observați că presiunea de vapori a apei peste soluția saturată este puțin mai mult de jumătate din cea peste apa pură, deoarece aw = 0,509. Rezultatele de mai sus constituie primul set de date privind activitățile bazate pe solubilitatea sării.
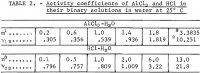
Nota.-În acest tabel, m se referă la molalitatea lui AlCl3, n se referă la molalitatea lui HCl, iar molalitatea reprezintă moli în 1 kg de apă.
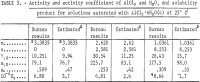
Nota.-În acest tabel, m se referă la molalitatea AlCl3, n se referă la molalitatea HCl, iar molalitatea este reprezentată de moli în 1 kg de apă.
Stimarea activităților în sistemul AlCl3-6H2O-H2O
Se utilizează două metode fiabile de estimare existente pentru a obține activitățile în sistemul AlCl3-6H2O-H2O dincolo de datele experimentale directe existente la m = 1,8. Prima metodă, așa cum a fost descrisă de Kusik și Meissner, dă o valoare estimată de γ12 = 9,94 la 3,3835 m. Această valoare estimată este în strânsă concordanță cu 10,251, valoarea obținută în prezenta investigație. Valoarea estimată corespunzătoare a activității apei, aw, este de 0,47, din nou în strânsă concordanță cu valoarea de 0,509 obținută în cadrul prezentei cercetări. Constanta de echilibru Kp calculată pornind de la aceste valori nu este departe de 6,8 x 10 5, având în vedere faptul că a patra putere a lui a12 și a șasea putere a lui aw sunt înmulțite pentru a obține Kp.
A doua metodă de estimare datorată lui Bromley dă 10,42 pentru γ12, o valoare mai apropiată decât cea obținută prin metoda precedentă. Coeficientul de activitate al apei a fost obținut de autorii de față, prin integrarea ecuației Gibbs-Duhem în care au fost folosite valorile lui a12 estimate prin metoda Bromley. Rezultatul este aw = 0,540. Media celor două metode este 0,505, ceea ce este în foarte bună concordanță cu valoarea de 0,509 a Biroului. Cu toate acestea, metoda Bromley nu conține o metodă convenabilă de determinare a aw inclusă în metoda Kusik-Meissner.
Concordanța valorilor estimate cu valorile din datele de solubilitate nu este întotdeauna atât de bună cum se arată aici pentru fiecare electrolit la fiecare compoziție. De exemplu, chiar și pentru AlCl3 la 1 m, cele două estimări ale lui γ12 diferă doar cu 13 procente una față de cealaltă.
Produs de solubilitate și activități în sistemul AlCl3-6H2O-HCl-H2O
Efectul creșterii concentrației de HCl asupra solubilității sării se datorează în mare parte creșterii concentrației ionilor de clorură. Constanta de echilibru în acest caz cu activitățile a1 și a2 ale ionilor individuali este
![]()
unde γ12 = γ1γ2 prin definirea lui γ12 din activitățile ionice individuale γ1 (pentru Al+++) și γ2 (pentru Cl-), iar n este molalitatea HCl-ului. Valoarea lui Kp este aceeași cu cea din ecuația 4, dar partea dreaptă din ecuația 8 este diferită de cea din ecuația 4. Se poate observa că, pe măsură ce n crește, m, concentrația de Al+++, trebuie să scadă, cu condiția ca γ12 și aw să nu scadă foarte mult; prin urmare, sarea precipită, ceea ce este cunoscut sub numele de efectul de sărare.
Calculul activităților în soluția ternară necesită o ecuație similară cu ecuația 1 pentru HCl. Deoarece datele pentru HCl sunt cunoscute cu exactitate pe o gamă largă de concentrații, este posibil să se ia o ecuație cu atâtea variabile câte se dorește. Următoarea ecuație oferă o reprezentare precisă a datelor pentru coeficientul de activitate al HCl, γ32, unde indicele 3 este pentru H+ și 2 pentru Cl-:
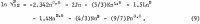
Datele selectate în acest scop de la Haase, Naas și Thutnm sunt enumerate în al treilea și al patrulea rând al tabelului 2. Valorile coeficienților calculați din aceste date sunt următoarele:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
și P = +0,02634.
Ecuațiile pentru activitățile lui AlCl3 și ale lui H2O conțin acești coeficienți, precum și coeficienții produselor încrucișate (m h/2)(n k/2), unde h și k sunt numere întregi, iar aceste ecuații sunt următoarele:
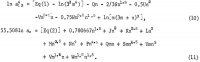
Cei cinci coeficienți suplimentari din aceste ecuații sunt determinați prin adăugarea ecuației 10 și a 6 1n aw din ecuația 11 pentru a obține 1n Kp și prin utilizarea următoarelor date de solubilitate selectate din tabelul 1:
m: 2.620, 2,016, 1,333, 0,953 și 0,535.
n: 2,581, 4,460, 6,780, 8,397 și 10,063.
Celelalte calcule rezultate dau următoarele valori ale coeficienților din ecuațiile 10 și 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
și W = +4,60246.
Rezultatele pentru γ12, a12, aw și Kp calculate din ecuațiile precedente sunt prezentate în tabelul 3. Valorile lui γ12 din ecuația 9 sunt în concordanță cu cele ale lui Harned și Gary la concentrații foarte mici de HCl și AlCl3.
Presiunea parțială a HCl(g), P32, peste o soluție poate fi calculată din următoarea ecuație (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
unde Kp(HCl) este constanta de echilibru la 25° C pentru H+ + Cl- = HCl(g), iar a32 este activitatea ionică medie a HCl în soluție. În acest scop, este necesar să se scrie o ecuație pentru a32, similară cu ecuația 10, folosind parametrii din ecuația 11, așa cum se arată în detaliu în altă parte.
Efectul temperaturii asupra solubilității sării este mic, așa cum se arată în tabelul 1. Prin urmare, se așteaptă ca efectul asupra activităților ionice să fie mic, deoarece toți parametrii din ecuația 11 ar fi putut fi obținuți din datele de solubilitate dacă eroarea experimentală ar fi fost mai mică de ±0,01 pct în greutate pentru analiza aluminiului. În general, pentru un interval de temperatură de până la aproximativ 80° C, fiecare parametru este o funcție liniară a temperaturii, iar această dependență poate fi determinată dacă ecuația 11 ar fi cunoscută la o altă temperatură cu cel puțin 50° C mai mare decât 25° C.
Stimarea activităților în sistemul AlCl3-6H2O-HCl-H2O
Valorile activităților, coeficientul de activitate și produsul de solubilitate estimate în prezentul raport, conform metodei concepute de Kusik și Meissner, sunt enumerate în tabelul 3. Coeficientul de activitate γ12 pentru AlCl3 este aproximativ de două ori mai mare decât valoarea estimată pentru soluțiile selectate care conțin HCl. Cu toate acestea, activitatea apei, aw, concordă bine cu valorile estimate, cu excepția cazului m = 2,620. Este evident că calculele ar fi fost considerabil mai fiabile dacă s-ar fi măsurat presiunea de vapori a apei, aw, deoarece aw intră în Kp ca aw, astfel încât erorile mici în aw determină erori mari în γ12 și Kp . În acest scop, se recomandă efectuarea unui număr limitat de măsurători ale presiunii de vapori pentru a testa acuratețea prezentelor calcule și a metodelor de estimare.
Dependența de temperatură a proprietăților termodinamice enumerate în tabelul 3 poate fi estimată așa cum este descrisă de Kusik și Meissner. Cu toate acestea, este probabil ca estimarea să dea un grad mai mare de dependență de temperatură decât cel indicat de dependența slabă de temperatură a solubilității. Nu s-a putut încerca să se calculeze efectul temperaturii prin metoda Biroului deoarece (1) a12 la concentrații mici de AlCl3 nu este cunoscut la diferite temperaturi, (2) solubilitatea AlCl3 nu a putut fi determinată cu o precizie apropiată de 0,01 pct în Al+++ și (3) intervalul de concentrație a HCl la 65° și 85° C este prea mic pentru a selecta un număr suficient de date de solubilitate foarte diferite pentru AlCl3 pentru a determina cu precizie parametrii din ecuațiile 10 și 11.
Sistemul AlCl3-FeCl3-KCl-NaCl-HCl-HCl-H2O
Date preliminare privind solubilitățile AlCl3, FeCl3 , KCl și NaCl în soluții apoase care conțin HCl de 24 până la 31 % în greutate la 25° C au fost obținute pentru a evalua contaminarea AlCl3-6H2O extractibil din minereuri nebauxitice. În acest scop, s-au preparat 2 litri dintr-o soluție care conține cantități cunoscute de săruri, 90 ml din această soluție au fost plasați într-un balon pentru fiecare probă și apoi a fost admisă o cantitate cunoscută de HCl gazos pentru a se ajunge la 24 până la 31 % în greutate de HCl dizolvat. În acest interval de HCl în soluție, au precipitat cristale anizotrope incolore de AlCl3-6H2O, cristale anizotrope strălucitoare de FeCl3-2KCl-H2O și cristale transparente izotrope cubice de KCl și NaCl, care au fost identificate prin examinare microscopică. Procedura și analizele pentru concentrațiile de ioni de aluminiu și de ioni de clorură au fost identice cu cele utilizate pentru sistemul AlCl3-6H2O-HCl-H2O prezentat anterior în acest raport. În plus, concentrația de ioni ferici a fost determinată prin titrare standard cu K2Cr2O7, concentrația de ioni de sodiu a fost determinată prin tehnici de absorbție atomică, iar concentrația de ioni de potasiu a fost determinată prin scăderea concentrației de ioni de sodiu dintr-o determinare a concentrațiilor combinate de ioni de potasiu și de ioni de sodiu după separarea prin schimb de ioni. Rezultatele sunt enumerate în tabelul 4 și reprezentate grafic în figura 3. Rezultatele similare obținute de Miles sunt, de asemenea, reprezentate în figura 3 pentru a arăta că acordul este excelent. Datele publicate pentru sisteme înrudite mai simple, care conțin mai puține componente, au fost compilate de Linke.
În procesele de cristalizare prin evaporare sau prin pulverizare cu gaz HCl pentru producerea hexahidratului de clorură de aluminiu pur, contaminarea cu alte cloruri metalice devine o problemă pe măsură ce nivelurile de impurități se acumulează în soluțiile de leșiere. Figura 3 arată nivelurile de concentrație la care impuritățile, cum ar fi NaCl, KCl și FeCl2-2KCl-H2O, vor cristaliza, de asemenea, din soluție ca faze separate distincte, provocând astfel contaminarea cristalelor de AlCl3-6H2O. De exemplu, la mai puțin de 2,4 % în greutate de FeCl3 în prezența a 1,6 % în greutate de KCl la 25° C, concentrația de HCl trebuie să fie mai mică de 28 % în greutate pentru a evita contaminarea AlCl3-6H2O cu sarea dublă, FeCl3-2KCl-H2O. Figura 3 este, de asemenea, utilă pentru redisolvarea fracționată a precipitatului prin recristalizare fracționată în vederea purificării sării de aluminiu. În plus, unele dintre sărurile elementelor de tranziție, cum ar fi FeCl3, pot fi reduse la minimum prin electroliză parțială pentru a elimina prin placare o cantitate suficientă de fier înainte de acidificarea cu HCl.
Un tratament termodinamic al sistemului cu eroarea obișnuită de ±0,05 % în greutate în concentrația de ioni clorură nu este fezabil, în special în absența datelor privind presiunea de vapori pentru H2O(g) și HCl(g). Cu toate acestea, se pot face estimări aproximative ale activităților prin metoda Kusik-Meissner. Se anticipează că astfel de estimări ar putea da doar valori aproximative ale activităților pentru sărurile hidratate și complexe și pentru apă.

Domenii recomandate pentru cercetare
Măsurătorile activităților sunt utile în interpretarea termodinamicii și cineticii de leșiere, precipitare și purificare a componentelor dorite din diferite minereuri. Există două motive pentru care activitățile pot fi determinate cu exactitate din măsurătorile presiunii de vapori a apei: (1) Presiunea de vapori poate fi măsurată cu un grad ridicat de precizie prin traductoare de presiune diferențială pentru a obține aw prin ecuația 7 și apoi pentru a calcula valorile parametrilor din ecuația 11, astfel încât toate proprietățile aferente să poată fi calculate așa cum s-a discutat anterior în detaliu (2) Produsul de solubilitate și activitățile pot fi ambele determinate cu precizie pentru sărurile multivalente care conțin un număr mare de molecule de apă în cristalele lor hidratate. Al doilea motiv rezultă din faptul că exponentul activității apei din ecuația 4 este egal cu molii de apă din cristalul hidratat.
Clorura de aluminiu în soluții apoase de acid clorhidric
Un alt tip de experiment interesant pentru sistemul ternar discutat aici este măsurarea presiunii parțiale a HCl(g) pe diferite soluții care conțin cantități suficient de mari de HCl dizolvat. Procedura experimentală în acest scop este descrisă în altă parte. Sărurile din grupele IIA, IIIA și sărurile metalelor de tranziție sunt candidați excelenți pentru aceste tipuri de investigații, deoarece electroliții cu valențe mai mari de 1:1 formează de obicei săruri hidratate.
Solubilitatea și activitatea clorurii de aluminiu hexahidrat, AlCl3-6H2O, în soluții apoase au fost determinate ca parte a cercetărilor Biroului de Mine, Departamentul de Interne al SUA, pentru îmbunătățirea tehnologiei de prelucrare a mineralelor în vederea recuperării aluminei din resursele interne de calitate inferioară. Solubilitatea AlCl3 în apă pură s-a dovedit a fi de 31,09 și 31,77 % în greutate la 25° și, respectiv, 85° C, și a scăzut drastic la 10 și 0,1 % în greutate atunci când s-au adăugat în soluție cantitățile respective de acid clorhidric (HCl) de 20,3 și 37 % în greutate. Constanta de echilibru pentru solubilitatea hexahidratului, activitățile și coeficienții de activitate ai AlCl3 și H2O au fost calculate și comparate cu rezultatele obținute prin metodele de estimare disponibile. Rezultatele s-au dovedit a fi utile în levigarea minereurilor nebauxitice pentru extragerea aluminei prin modificarea solubilităților sărurilor componente la adăugarea de HCl.
S-au determinat, de asemenea, solubilitățile simultane ale AlCl3 , FeCl3, KCl și NaCl în soluții de HCl-H2O și sunt discutate pe scurt efectele lor asupra purității AlCl3-6H2O cristalizat din soluții de săruri mixte.
.