J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Documentație de cercetare
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Outcomes after Treatment of Metaplastic Versus Other Breast Cancer Subtypes. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Disponibil la https://www.jcancer.org/v11p1341.htm
Scop: Cancerul de sân metaplastic (BC) este un subtip histologic neobișnuit, dar agresiv al BC. Am căutat să identificăm factorii asociați cu diagnosticul său și să comparăm managementul și rezultatele BC metaplastic cu cele ale altor BC și ale carcinomului ductal invaziv triplu negativ în special, având în vedere cât de des are un fenotip triplu negativ.
Pacienți și metode: Am identificat femeile diagnosticate cu BC invaziv în perioada 2010-2014 în National Cancer Data Base și am folosit analiza univariată pentru a compara caracteristicile inițiale ale pacienților și ale tumorii în funcție de subtipul BC. Supraviețuirea globală (OS) a fost estimată cu metoda Kaplan-Meier, iar modelele multivariate de hazard proporțional Cox au fost utilizate pentru a identifica predictorii independenți ai OS.
Rezultate: Din 247.355 de cazuri, 2.084 (0,8%) au fost BC metaplastic, 55.998 (23%) BC triplu negativ și 77% alte BC. Comparativ cu BC nemetaplastic, femeile cu BC metaplastic au fost mai predispuse să fie mai în vârstă în momentul diagnosticului (vârsta mediană, 62 vs. 59 de ani), să aibă ≥1 afecțiuni comorbide (22% vs. 18%) și să fie pe Medicare (41% vs. 33%; P<0,001). BC metaplastice au avut tendința de a fi de tip bazal (77%), iar în raport cu BC triplu-negative sau alte BC, BC metaplastice au fost asociate cu un statut T clinic mai ridicat (cT3-4, 18% vs. 11%, 8%), fără implicare clinică ganglionară (cN0, 86%, 77%, 80%), fără invazie limfovasculară (72%, 65%, 62%) și tumori de grad înalt (71%, 77%, 35%) (P<0,001). Majoritatea BC metaplastice au fost tratate cu mastectomie (58%), disecție a ganglionilor limfatici santinelă (65%), iradiere a peretelui toracic sau a sânului (74%) și chimioterapie (75%) ca terapie adjuvantă (60%). La un timp median de urmărire de 44,5 luni, ratele de supraviețuire au fost mai mici pentru BC metaplastic decât pentru BC triplu-negativ sau alte BC în toate stadiile clinice la 5 ani (stadiul I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) și la 3 ani (stadiul IV, 15%, 22%, 64%; P<0,001). În urma analizei multivariate, creșterea vârstei, stadiul clinic avansat, invazia limfovasculară, disecția ganglionilor axilari (față de ganglionul santinelă) și absența radioterapiei sau a chimioterapiei au fost asociate cu rezultate mai proaste în cazul BC metaplastic. Amploarea intervenției chirurgicale a afectat supraviețuirea pentru BC triplu-negativ și alte BC, dar nu și pentru BC metaplastic.
Concluzie: Rezultatele pentru BC metaplastic continuă să fie mai proaste decât cele pentru alte subtipuri de BC, în ciuda tratamentelor moderne. Optimizarea opțiunilor de terapie sistemică, care a fost un predictor semnificativ al supraviețuirii, ar trebui să fie o prioritate în gestionarea BC metaplastic.
Cuvinte cheie: cancer de sân metaplastic, cancer de sân triplu negativ, rezultatele cancerului de sân, radioterapie, chimioterapie.
Introducere
Deși cancerul mamar este cel mai frecvent diagnostic de cancer care afectează femeile, cu peste 268.000 de cazuri documentate anual, cancerul mamar metaplastic (BC) constituie mai puțin de 1%-2% din toate cazurile de cancer mamar. Din punct de vedere clinic, BC metaplastic se manifestă ca o masă mamară cu creștere rapidă, cu ecogenitate complexă (de exemplu, componente solide și chistice) la ecografie și o masă cu densitate mare la mamografie. Din punct de vedere histologic, BC metaplazică este compusă dintr-o populație eterogenă de tumori care pot fi clasificate prin prezența unor tipuri de celule non-glandulare sau mezenchimale sau prin clasificarea ulterioară în subtipuri în funcție de prezența diferitelor caracteristici, cum ar fi celulele gigantice osteoclastice sau celulele fusiforme.
La prezentare, rata de implicare clinică a ganglionilor limfatici în BC metaplazică este de obicei scăzută. Cu toate acestea, BC metaplastic este mai des diagnosticat în stadii clinice avansate din cauza tumorilor primare mai mari în comparație cu alte BC și este asociat cu rate mai mari de chimiorezistență, metastaze la distanță și o supraviețuire generală (OS) mai proastă. BC metaplastic are o prevalență deosebit de mare a statutului de receptor triplu-negativ sau absența receptorului de estrogen, a receptorului de progesteron și a amplificării receptorului 2 al factorului de creștere epidermal uman (HER2). Fără proteine care pot fi țintite, BC metaplastic rămâne dificil de tratat. Datele prospective sunt limitate pentru alegerea celui mai bun tratament pentru BC metaplastic, având în vedere raritatea diagnosticului. În schimb, o mare parte din standardul actual de tratament pentru BC metaplastic a fost extrapolat din constatările unor serii mici dintr-o singură instituție sau din rapoarte de caz. Prin urmare, am folosit National Cancer Data Base (NCDB), care cuprinde aproximativ 70% din toate cazurile de cancer diagnosticate în Statele Unite, pentru a evalua caracteristicile, managementul și rezultatele pe baza tratamentului și a caracteristicilor tumorale ale pacientelor cu BC metaplastic în comparație cu cele cu BC triplu-negativ și cu toate celelalte subtipuri de BC. De asemenea, am folosit analiza multivariată pentru a identifica predictorii independenți ai supraviețuirii femeilor cu BC metaplastic.
Sursa datelor și selecția cohortei
Proiect comun înființat în 1989 de către Comisia pentru Cancer a Colegiului American al Chirurgilor și Societatea Americană de Cancer, NCDB a colectat date oncologice de la aproximativ 1.500 de unități acreditate din Statele Unite, totalizând peste 34 de milioane de înregistrări. Informațiile disponibile despre pacienți sunt de-identificate și, prin urmare, sunt exceptate de la supravegherea protecției umane de către comisia de evaluare instituțională.
Criteriile de selecție utilizate pentru acest studiu sunt prezentate în figura 1. Au fost incluse femeile cu vârsta de 18 ani și peste care au fost diagnosticate cu cancer mamar invaziv între 2010 și 2014. Au fost excluse pacientele cu statut necunoscut al receptorilor hormonali (HR) (estrogen și progesteron). Motive suplimentare de excludere au fost informațiile lipsă privind intervenția chirurgicală, chimioterapia sau stadializarea clinică în conformitate cu ediția a 6-a sau a 7-a a American Joint Committee On Cancer (AJCC). Pacientele au fost apoi stratificate în trei grupe: 1-CBC metaplastic (cu codurile histologice 8575 sau 8573), 2-CBC triplu-negativ (TNBC, care a inclus doar histologiile nemetaplastice) și 3-toate celelalte tipuri de BC rămase. Termenul „non-metaplastic BC” a fost utilizat pentru a se referi la BC triplu-negativ și la celelalte BC combinate.
Diagrama CONSTANȚA. BC, cancer de sân.
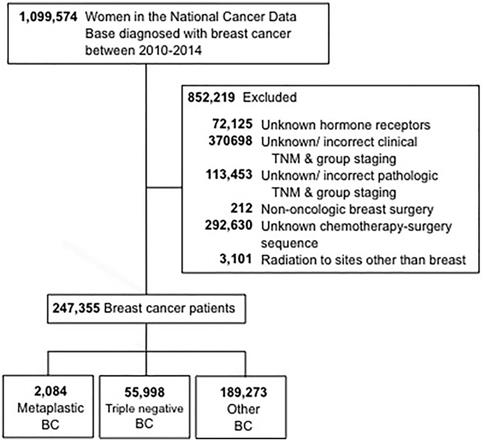 (Faceți clic pe imagine pentru a o mări.)
(Faceți clic pe imagine pentru a o mări.)
Variabile
Informațiile obținute și analizate din NCDB au inclus vârsta pacientului la momentul diagnosticului, anul diagnosticului, rasa, indicele de comorbiditate Charlson/Deyo, statutul de asigurare medicală, venitul median al gospodăriei și tipul de unitate de tratament (dihotomizat în academică/cercetare versus non-academică). Caracteristicile clinico-patologice au inclus desemnarea clinică AJCC T și N (ganglionară), grupul general de stadii clinice AJCC, statusul HR, statusul receptorilor HER2, gradul tumoral și invazia limfovasculară (LVSI). Subtipurile moleculare au fost definite ca fiind HR(+)/HER2(-), HER2(+), triplu negativ (receptor de estrogen(-), receptor de progesteron (-), HER2(-)) sau necunoscut. Pacientele cu BC metaplastic cu statut de receptor triplu-negativ au fost etichetate ca tn-metaplastic BC pentru a le deosebi de TNBC nemetaplastic. Managementul primar a inclus intervenția chirurgicală (conservatoare de sân, mastectomie sau niciuna), radioterapie cu sau fără includerea iradierii ganglionare regionale, utilizarea chimioterapiei (neoadjuvantă, adjuvantă sau niciuna) și terapia hormonală. Managementul chirurgical al axilei a fost definit fie ca o disecție ganglionară axilară (ALND), cu 10 ganglioni limfatici sau mai mult îndepărtați, fie ca o disecție a ganglionului limfatic santinelă (SLND), atunci când <10 ganglioni limfatici au fost îndepărtați.
Analiză statistică
Analiza univariată a fost utilizată pentru a evalua asociațiile potențiale între caracteristicile demografice, tumorale și clinice și diagnosticul de BC metaplastic, utilizând teste chi-pătrat pentru variabilele categorice și testul t/analiza varianței sau omologii lor din abordările neparametrice (Wilcoxon rank-sum sau Kruskal-Wallis) pentru variabilele continue. OS a fost definită ca fiind perioada cuprinsă între momentul diagnosticului și momentul decesului. Timpul OS pentru pacienții supraviețuitori a fost cenzurat pe dreapta la momentul ultimului contact. Distribuția OS a fost estimată prin metoda Kaplan-Meier. Testul log-rank a fost utilizat pentru a testa diferența de supraviețuire între grupuri. Au fost efectuate analize de regresie a datelor de supraviețuire bazate pe modelul de hazard proporțional Cox pentru OS. Un model multivariat al hazardelor proporționale Cox a fost obținut prin includerea mai întâi a unui set inițial de variabile predictive candidate cu o valoare P < 0,05 în analiza univariată. Apoi a fost utilizată eliminarea regresivă în trepte, cu 0,05 pentru nivelul de semnificație al chi-pătrat Wald pentru ca un efect să rămână în model.
Analizele de supraviețuire au fost efectuate în cadrul fiecărui tip de cancer în parte.
Localizarea și tipul de facilitate nu au fost incluse în procesul de selecție a modelului de BC metaplastic, deoarece niciunul dintre acești factori nu a fost semnificativ din punct de vedere statistic pentru acest grup în cadrul univariatului și datele nu au fost disponibile în totalitate pentru pacienții cu vârsta mai mică de 40 de ani. Pentru a explora dacă detaliile terapiei sistemice și ale administrării de radiații au afectat rezultatele în rândul pacienților cu BC metaplastic, am efectuat analize de subset pe această cohortă pentru a evalua influența potențială a secvențierii chimioterapiei și a amplorii țintelor de radiații asupra SG. Toate testele au fost cu două cozi, iar semnificația statistică a fost definită ca o valoare P <0,05. SAS versiunea 9.4 (SAS Institute, Cary, NC) și S-Plus versiunea 8.2 (TIBCO Software Inc., Palo Alto, CA) au fost utilizate pentru a efectua calculele pentru toate analizele.
Caracteristicile cohortei și ale tumorii
Am identificat 247.355 de femei cu un diagnostic de cancer mamar invaziv în perioada 2010-2014, dintre care 0,8% (n=2.084) au avut BC metaplastic, 23% (n=55.998) TNBC și 77% (n=189.273) au avut alte BC. Caracteristicile sociodemografice, clinice și patologice tumorale ale pacienților și caracteristicile tratamentului în funcție de tipul de BC sunt prezentate în tabelul 1. Vârsta mediană a fost de 63 de ani (interval 22-90) pentru femeile cu BC metaplastic și de 59 de ani (interval 18-90) ani atât pentru TNBC, cât și pentru alte BC. Femeile cu BC metaplastic au avut mai frecvent un scor de comorbiditate ≥1 (22% vs. 18% TNBC vs. 16% alte BC) și au avut asigurare publică (50% vs. 42% TNBC vs. 41% alte BC) (toate P<0,001). Diagnosticul de BC metaplastic sau TNBC a fost mai frecvent asociat cu rasa neagră decât cu alte BC (18% vs. 21% vs. 11%, P<0,001).
Diferențe semnificative în ceea ce privește stadiul clinic al bolii și caracteristicile tumorale au fost observate în funcție de tipul de cancer. BC metaplastic a fost adesea diagnosticat în stadii mai avansate, doar 31% dintre pacienții cu BC metaplastic având boala în stadiul clinic I față de 46% din TNBC și 54% din alte BC (P<0,001). Acest model a părut să se coreleze cu rate mai mari de tumori mai mari în grupul BC metaplastic (cT3-4, 18% vs. 11% vs. 8%, respectiv), dar prezența implicării ganglionare clinice a fost cea mai scăzută pentru BC metaplastic (cN1-3, 14% vs. 23% vs. 20%, respectiv) (toate P<0,001). Spre deosebire de statutul clinic ganglionar, ratele de implicare ganglionară patologică au fost ușor mai mici pentru BC metaplastic și TNBC, dar s-au dublat pentru alte BC (pN1-3, 18% vs. 26% vs. 40%, respectiv, P<0,001). În ceea ce privește statutul receptorilor, 77% din grupul BC metaplastic a avut BC tn-metaplastic, ceea ce este de 3,4 ori mai mare decât grupul BC nemetaplastic (23%), dintre care HR(+)/HER2(-) a fost cel mai frecvent subtip molecular, cu 59% (P<0,001). În plus, doar 5% din BC metaplastic a fost HER2(+), comparativ cu 16% din BC nemetaplastic. Atât BC metaplastic, cât și TNBC au avut o proporție aproape dublă de tumori de gradul 3 în raport cu alte BC (71%, 77% și, respectiv, 35%, P<0,001), iar BC metaplastic a avut rate mai mici de LVSI în raport cu TNBC și alte BC (13%, 20% și, respectiv, 24%, P<0,001).
Caracteristicile pacienților și ale tratamentului.
| Caracteristică | CBC metaplastic, nr. (%) | CBC triplu-negativ, nr. (%) | Alte BC, nr. (%) | Valoare P | ||||
|---|---|---|---|---|---|---|---|---|
| Vârsta medie, ani (interval) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | ||||
| Rasă | ||||||||
| Alb | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0.001 | ||||
| Negru | 368 (17.7) | 11771 (21) | 20722 (10.9) | |||||
| Altele | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |||||
| Necunoscut | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |||||
| Scurt de comorbiditate | ||||||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | ||||
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |||||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |||||
| Venit mediu | ||||||||
| <30.000$ | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | ||||
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |||||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |||||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |||||
| Necunoscut | 63 (3) | 1673 (3) | 6165 (3.3) | |||||
| Asigurare medicală | ||||||||
| Privat | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | ||||
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |||||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |||||
| Altele | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |||||
| Neasigurați | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |||||
| Necunoscut | 31 (1.5) | 577 (1) | 2257 (1.2) | |||||
| Tipul județului | ||||||||
| Metropolitan | 1720 (82.5) | 46252 (82,6) | 157058 (83) | 0,152 | ||||
| Urban | 271 (13) | 7456 (13,3) | 24367 (12.9) | |||||
| Rural | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |||||
| Necunoscut | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |||||
| Tipul instituției | ||||||||
| Academic | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | ||||
| Non-Academic | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | |||||
| Necunoscut | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||||
| Localizarea unității | ||||||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | ||||
| Nord-Est | 410 (19.7) | 10411 (18.6) | 37787 (20) | |||||
| Sud | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |||||
| Vest | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |||||
| Necunoscut | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |||||
| Stadiul clinic al bolii | ||||||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | ||||
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |||||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |||||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |||||
| Starea clinică T | ||||||||
| cT0 | 5 (0.2) | 131 (0,2) | 341 (0,2) | <0,001 | ||||
| cT1 | 674 (32,3) | 28452 (50,8) | 113113 (59.8) | |||||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |||||
| cT3 | 252 (12.1) | 3702 (6,6) | 10061 (5,3) | |||||
| cT4 | 127 (6,1) | 2183 (3,9) | 4613 (2.4) | |||||
| Starea clinică N | ||||||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 | ||||
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |||||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |||||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |||||
| Stadiul patologic | ||||||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | ||||
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |||||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |||||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |||||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |||||
| Starea T patologică | ||||||||
| pTis | 7 (0.3) | 432 (0,8) | 1862 (1) | <0,001 | ||||
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2,1) | |||||
| pT1 | 634 (30,4) | 29055 (51,9) | 106130 (56.1) | |||||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |||||
| pT3 | 290 (13.9) | 2540 (4,5) | 10588 (5,6) | |||||
| pT4 | 93 (4,5) | 1097 (2) | 2892 (1.5) | |||||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |||||
| Statut N patologic | ||||||||
| pN0 | 1705 (81.9) | 41587 (74,3) | 113787 (60,2) | <0,001 | ||||
| pN1 | 284 (13.6) | 9725 (17,4) | 51483 (27,2) | |||||
| pN2 | 66 (3,2) | 3031 (5.4) | 16111 (8.5) | |||||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |||||
| Gruparea receptorilor | ||||||||
| HR(+)/HER2(-)) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | ||||
| Triplu negativ | 1604 (77) | 55998 (100) | 0 (0) | |||||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |||||
| Necunoscut | 49 (2.4) | 0 (0) | 6860 (3.6) | |||||
| Grad tumoral | ||||||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | ||||
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |||||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |||||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |||||
| Necunoscut | 284 (13,6) | 3030 (5.4) | 11186 (5.9) | |||||
| LVSI | ||||||||
| Nu este prezent | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | ||||
| Prezent | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |||||
| Necunoscut | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |||||
| Tip de operație | ||||||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | ||||
| Mastectomie | 1200 (57.6) | 26561 (47.4) | 95910 (50.7) | |||||
| Fără intervenție chirurgicală | 8 (0.4) | 295 (0.5) | 1341 (0,7) | |||||
| Chirurgie axilară | ||||||||
| Fără intervenție chirurgicală | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | ||||
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |||||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |||||
| Necunoscut | 18 (0.9) | 855 (1.5) | 1941 (1) | |||||
| Radioterapie | ||||||||
| Da | 1087 (52.2) | 33938 (60.6) | 109268 (57.7) | <.001 | ||||
| Nu | 989 (47.5) | 21860 (39) | 79375 (41.9) | |||||
| Necunoscut | 8 (0.4) | 200 (0.4) | 630 (0.3) | |||||
| Ținte de radiații | ||||||||
| Numai sân/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | ||||
| Sân/CW + Noduli regionali | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |||||
| Chimioterapie | ||||||||
| Da | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | ||||
| Nu | 499 (23.9) | 11195 (20) | 53062 (28) | |||||
| Necunoscut | 14 (0,7) | 482 (0,9) | 2246 (1.2) | |||||
| Secvența chimioterapie-chirurgie | ||||||||
| Adjuvant | 1241 (59,5) | 31519 (56.3) | 116645 (61.6) | <0.001 | ||||
| Neoadjuvant | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | |||||
| Niciunul | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |||||
| Terapie hormonală | ||||||||
| Da | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | ||||
| Nu | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |||||
| Necunoscut | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |||||
| Anul diagnosticului | ||||||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | ||||
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |||||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |||||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |||||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
Abbreviații: BC, cancer de sân; ALND, disecția ganglionilor limfatici axilari; BCS, chirurgie conservatoare a sânului; CW, perete toracic; HER2, receptor al factorului de creștere epidermică umană; HR, receptor hormonal; LVSI, invazie limfovasculară; SLND, disecția ganglionului limfatic santinelă.
Tratament în funcție de tipul de cancer mamar
Cele mai multe paciente (99%) au fost supuse unei intervenții chirurgicale oncologice la sân, inclusiv evaluarea chirurgicală a axilei (97%). Mastectomia a fost mai frecvent utilizată în grupul BC metaplastic (58% vs. 47% TNBC vs. 51% alte BC, P<0,001), la fel ca și SLND (65% vs. 62% TNBC vs. 58% alte BC; P<0,001). Iradierea ganglionară regională a fost mai des utilizată ca parte a tratamentului pentru alte BC decât pentru BC metaplastic și TNBC (26%, 27% și 34%; P<0,001), respectiv.
În ceea ce privește terapia sistemică, chimioterapia neoadjuvantă a fost utilizată aproape de două ori mai des pentru BC metaplastic și TNBC decât pentru alte BC (16%, 23%, 9%; P<0,001), iar aproximativ un sfert dintre toate femeile nu au primit nicio chimioterapie. Terapia hormonală a fost utilizată cel mai rar pentru TNBC (2%), dar a făcut parte din paradigma de tratament pentru 11% din cazurile de BC metaplastic și 55% din celelalte cazuri de BC.
Analiză de supraviețuire
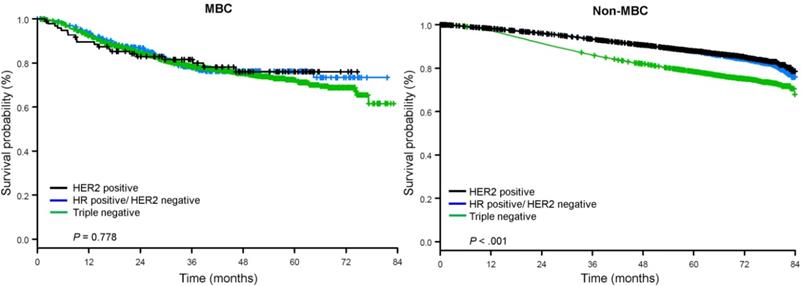
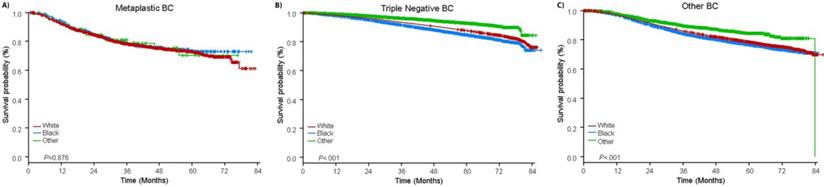
Timp mediu de urmărire a fost de 44,5 luni. Pacienții cu BC metaplastic au avut o SG neajustată semnificativ mai proastă, indiferent de stadiul clinic (Fig. 2). Estimările OS la 5 ani pentru pacienții cu BC metaplastic, TNBC și alte tipuri de BC cu boală în stadiul I au fost de 85%, 87% și 91%; cele pentru stadiul II au fost de 73%, 77% și 87%; iar cele pentru stadiul III au fost de 43%, 53% și 75% (P<0,001). Ratele de SG la 3 ani pentru pacienții cu boală metastatică au fost de 2-4 ori mai mari pentru grupurile TNBC și alte BC, de 30% și 64%, comparativ cu 15% pentru BC metaplastic (P<0,001). Supraviețuirea în funcție de subtipul molecular a fost, de asemenea, analizată (Fig. 3). În rândul pacienților cu BC metaplastic, nu s-au evidențiat diferențe în ceea ce privește OS în funcție de subtipul molecular (HR(+)/HER2(-), HER2(+) sau tn-metaplastic BC) (P=0,778). În schimb, pentru BC nemetaplastică, subtipul triplu-negativ a fost asociat cu o SG mai proastă decât subtipurile HER+ și HR(+)/HER2(-) (P<0,001). De asemenea, rasa nu a părut să fie asociată cu supraviețuirea în rândul pacienților cu BC metaplastic (rate de SG la 5 ani 73% pentru alb vs. 74% pentru negru, P=0,876), în timp ce rasa a fost asociată cu SG atât în cazul TNBC (P<0,001), cât și în cazul altor grupuri de BC (P<0,001; Fig. 4).
Curbe de supraviețuire generală a tipurilor de cancer de sân în funcție de stadiul clinic, examinând cancerele de sân metaplastic, triplu negativ și alte tipuri de cancer de sân. Abrevierea: MBC, cancer de sân metaplastic. 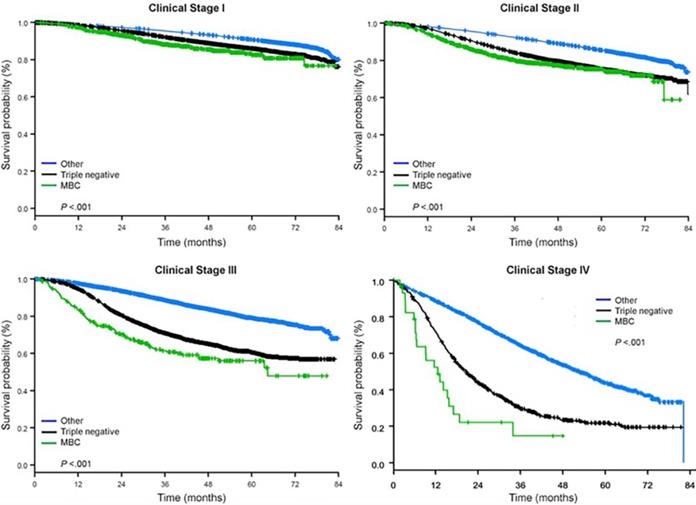 (Faceți clic pe imagine pentru a o mări.)
(Faceți clic pe imagine pentru a o mări.)
Curbe de supraviețuire generală pentru pacientele cu cancer de sân metaplastic și nemetaplastic, stratificate în funcție de statutul receptorilor. Abrevieri: HER2, Human epidermal growth factor receptor 2; HR, receptor hormonal; MBC, cancer de sân metaplastic.
 (Faceți clic pe imagine pentru a o mări.)
(Faceți clic pe imagine pentru a o mări.)
Curbe de supraviețuire generală pentru pacientele cu cancer de sân metaplastic, triplu negativ și alte tipuri de cancer de sân stratificate în funcție de rasă. Abrevieri: BC, cancer de sân.
 (Faceți clic pe imagine pentru a o mări.)
(Faceți clic pe imagine pentru a o mări.)
Analiză multivariabilă a factorilor asociați cu supraviețuirea globală pentru pacientele cu BC metaplastic.
| Factori asociați cu supraviețuirea globală în BC metaplastic | |||
|---|---|---|---|
| Variabilă (referință) | Raportul de risc (interval de încredere de 95%) | Valoare P | |
| Vârsta | Creștere pe an | 1.024 (1,015-1,033) | <0,0001 |
| Invazie limfovasculară (Niciuna) | Prezent | 1,307 (1,017-1,679) | 0.0364 |
| Starea N clinică (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 |
| Starea T clinică (cT1) | cT0 | 2.226 (0.301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3.029 (2.183-4.204) | ||
| cT4 | 3.145 (2.124-4.657) | ||
| Starea M clinică (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 |
| Chirurgie axilară (SLND) | ALND | 1.333 (1,065-1,670) | 0,0247 |
| Nici o intervenție chirurgicală | 1,538 (0.884-2.675) | ||
| Radiație (Nu) | Da | 0.709 (0.572-0,878) | 0,0016 |
| Chemoterapie (Nu) | Da | 0,579 (0,446-0,752) | <0,0001 |
Abbreviații: ALND, disecția ganglionului limfatic axilar; BC, cancer de sân; SLND, disecția ganglionului limfatic santinelă.
Pe analiza multivariată, creșterea vârstei, o clasificare T clinică mai mare, prezența bolii ganglionare clinice sau a LVSI și tratamentul cu ALND s-au corelat cu rezultate mai proaste pentru pacientele cu BC metaplastic, TNBC și alte BC (Tabelul suplimentar 1). Adăugarea chimioterapiei și a radioterapiei a îmbunătățit în mod independent atât OS, indiferent de tipul de cancer mamar. Alte caracteristici ale pacienților și ale tumorii asociate cu supraviețuirea în TNBC și alte BC, inclusiv rasa, comorbiditățile și gradul tumoral, nu au fost asociate cu rezultatele supraviețuirii pentru BC metaplastic în urma analizei multivariate.
Datorită rezultatelor relativ slabe în rândul pacienților cu BC metaplastic, au fost efectuate analize de subgrup pe grupul BC metaplastic pentru a evalua dacă unele modalități de tratament au fost asociate cu rezultate îmbunătățite. După ajustarea în funcție de statusul ganglionar (cN0 vs. N+), tratamentul cu o intervenție chirurgicală axilară mai agresivă (ALND vs. SLND) a fost asociat cu rezultate mai proaste, un fenomen care a fost observat și în rândul TNBC și al altor BC (tabelul 2). În rândul celor care au primit radioterapie, tratamentul cu iradiere ganglionară regională vs. iradiere doar a sânului sau a peretelui toracic nu a influențat semnificativ rezultatele în rândul pacientelor cu BC metaplastic (P=0,077 și 0,200 pentru N0 și, respectiv, N+ clinic). Primirea de chimioterapie neoadjuvantă a fost asociată cu rezultate mai proaste decât chimioterapia adjuvantă în rândul pacienților cu BC metaplastic clinic ganglionar-negativ (HR 1,9, 95% CI 1,3-2,6, P<0.001), dar nu și în cazul celor cu BC metaplastic clinic ganglionar-pozitiv (P=0,43).
Discuție
Cancerul mamar metaplastic este o formă rară, dar deosebit de agresivă de cancer mamar, în special în comparație cu alte subtipuri de tumori mamare. Această entitate patologică a fost relativ subreprezentată în literatura de specialitate. O căutare extinsă de către Rayson et al. a publicațiilor din 1966 până în 1997 a dat un total de numai 27 de cazuri. Marile baze de date naționale, cum ar fi NCDB, sunt avantajoase pentru studierea cancerelor rare, cum ar fi BC metaplastic. Cu toate acestea, incidența diagnosticului de BC metaplastic în Statele Unite, conform acestor baze de date, este încă scăzută, cu mai puțin de 500 de cazuri pe an. În studiul nostru, am constatat că BC metaplastic a fost cel mai frecvent diagnosticat ca o tumoare mare cu caracteristici de risc adverse, cum ar fi gradul tumoral slab diferențiat și statutul de receptor triplu-negativ. Pacientele cu BC metaplastic au avut o supraviețuire semnificativ mai proastă, indiferent de stadiul la prezentare, în comparație cu BC triplu-negativ și alte BC. Primirea chimioterapiei și a radioterapiei au fost predictori independenți ai unei OS mai bune, dar secvențierea chimioterapiei a părut să afecteze rezultatele, în special pentru pacienții cu BC metaplastic fără implicare ganglionară clinică, recunoscând că unii dintre acești pacienți aveau implicare ganglionară patologică. Cu toate acestea, constatările noastre pot reflecta o potențială eterogenitate a mecanismelor biologice care stau la baza răspunsurilor la tratamente în acest grup special de pacienți cu BC și evidențiază necesitatea unei mai bune stratificări a riscului și a opțiunilor de terapie sistemică pentru a îmbunătăți rezultatele.
Deși majoritatea BC metaplastice au un fenotip triplu negativ, comportamentul BC metaplastic pare a fi unic în comparație cu alte TNBC-uri. TNBC tinde să aibă un prognostic mai prost decât alte tipuri de BC, iar noțiunea că BC metaplastic este mai agresiv decât TNBC a fost coroborată de mai multe investigații retrospective mai mici. Astfel de studii au arătat modele similare de diagnosticare în stadii avansate pentru BC metaplastic față de TNBC, datorită ratelor mai mari de boală cT3-4 mai degrabă decât de implicare ganglionară, iar într-o analiză a unei singure instituții a 46 de cazuri de BC metaplastic, pacienții cu BC metaplastic au avut un risc semnificativ mai mare de recidivă locală a bolii (30% față de 15%; P=0,004). Aceste caracteristici s-au corelat, în cele din urmă, cu rate inferioare de supraviețuire fără boală la 5 ani (30% vs. 90%; P<0,001) și cu rate de SG (65% vs. 87%; P=0,002) pentru pacienții cu BC metaplastic în raport cu TNBC. Un studiu Surveillance Epidemiology and End Results realizat pe 1.1112 pacienți cu BC metaplastic a arătat, de asemenea, rate mai slabe de supraviețuire specifică cancerului la 3 ani pentru BC metaplastic decât pentru TNBC (78% vs. 84%). Atunci când au examinat BC tn-metaplastic, Li et al. au constatat o supraviețuire fără boală mai proastă (HR 1,48, 95% CI 1,19-1,84, P<0,01) și OS (HR 1,42 ; P<.01) pentru BC tn-metaplastic în comparație cu TNBC. Studiul nostru, care a inclus unul dintre cele mai mari grupuri de pacienți cu BC metaplastic de până acum (n=2.084), întărește aceste constatări și evidențiază faptul că statutul de receptor nu este un factor predictiv independent de supraviețuire pentru BC metaplastic (P=0.778), așa cum este pentru BC nemetaplastică.
O componentă terapeutică esențială asociată cu rezultate îmbunătățite pentru toți pacienții cu BC metaplastică din studiul nostru a fost utilizarea chimioterapiei (HR 0,58, 95% CI 0,45-0,75, P<0,001). Raportul nostru este primul, după cunoștințele noastre, care raportează rezultatele în BC metaplastic pe baza secvențierii chimioterapiei. În mod surprinzător, subanaliza noastră a constatat că, în special pentru pacienții cu BC metaplastic cN0, chimioterapia neoadjuvantă a fost asociată cu o SG mai proastă în comparație cu chimioterapia adjuvantă (HR 1,88, IC 95% 1,34-2,64, P<0,001), în timp ce secvențierea chimioterapiei nu a avut niciun efect asupra BC metaplastic cu ganglioni clinic pozitivi. O posibilă explicație pentru acest lucru poate fi faptul că pacienții noștri cu BC metaplastic au avut un statut T clinic mai ridicat, care în alte rapoarte a fost asociat cu rate mai mici de răspuns patologic complet și rezultate ulterioare mai proaste de supraviețuire. Mai mult decât atât, metodele de stadializare clinică (de exemplu, examinarea fizică singură, încorporarea ultrasonografiei) pot introduce eterogenitate într-o populație N0 clinică prin omiterea adevăratei încărcături ganglionare a bolii, care în sine poate fi asociată cu rezultate inferioare. În general, răspunsul BC metaplastic la chimioterapia neoadjuvantă a fost raportat ca fiind de până la 18%, ceea ce este mult mai mic decât ratele de răspuns cunoscute pentru TNBC la regimurile de chimioterapie pe bază de antracicline și taxani.
Pe baza supraviețuirii mai slabe și a dezvoltării relativ rapide a răspândirii metastatice la distanță în comparație cu alte subtipuri de cancer de sân observate în studiul nostru și în alte rapoarte, necesitatea unor opțiuni mai bune de terapie sistemică este în mod clar evidentă pentru BC metaplastic. Profilarea transcripțională a arătat că acest subtip de cancer prezintă o semnătură tumorigenă cu caracteristici asemănătoare celulelor stem, aberații frecvente în calea PI3K/AKT/mTOR și supraexprimarea factorului de creștere a endoteliului vascular (VEGF). Aceste caracteristici sunt similare cu cele întâlnite la TNBC mezenchimale. Sunt în curs de desfășurare eforturi promițătoare pentru a identifica regimuri terapeutice sistemice alternative pentru acești pacienți, inclusiv un studiu recent de fază I care a arătat rate îmbunătățite de răspuns obiectiv la doxorubicină lipozomală, bevacizumab (anticorp monoclonal împotriva VEGF-A) și everolimus (inhibitor mTOR) la pacienții cu TNBC metaplastic cu o aberație a căii PI3K.
În ceea ce privește tratamentele locale, mastectomia a fost mai frecvent utilizată în studiul nostru pentru BC metaplastic, dar nu a fost asociată cu o supraviețuire îmbunătățită în raport cu chirurgia conservatoare a sânului. De asemenea, nu s-a constatat niciun beneficiu de supraviețuire în cazul tratamentului care a încorporat ALND față de SLND. Cu toate acestea, radioterapia a fost un predictor semnificativ al supraviețuirii, pacientele cu BC metaplastic tratate cu radioterapie adjuvantă având cu 30% mai puține șanse de a muri decât cele care nu au primit radioterapie. Limitările relevante ale analizei noastre privind radioterapia includ detalii necunoscute cu privire la planificarea tratamentului, modalitatea selectată, asigurarea calității sau dacă au fost utilizate tehnici cum ar fi respirația inspirată profundă. În timp ce recidiva loco-regională nu poate fi examinată în NCDB, o serie instituțională de 113 pacienți cu BC metaplastic (54% care au primit radioterapie) a arătat că iradierea a fost singurul factor care s-a corelat cu reducerea recidivei loco-regionale (risc relativ fără iradiere 3.1; 95% CI 1,13-9,88, P=0,027).
Rezultatele noastre trebuie interpretate cu prudență, având în vedere limitările majore de a nu cunoaște ce regimuri de chimioterapie au fost utilizate, durata tratamentelor sau răspunsul la chimioterapia neoadjuvantă, deoarece aceste informații nu sunt disponibile în NCDB. Recunoaștem, de asemenea, limitările factorilor de risc clinico-patologici surprinși în NCDB, fără de care este posibil să nu fie fezabil să caracterizăm pe deplin diferențele clinice care determină unele dintre diferențele de rezultate pe care le-am constatat, cum ar fi rezultatele mai slabe de supraviețuire cu ALND chiar și atunci când se controlează statutul ganglionar. Deși dimensiunea eșantionului nostru de pacienți cu BC metaplastic a fost mică în raport cu studiile privind BC nemetaplastic, în mod paradoxal, acesta este, de asemenea, probabil, cel mai mare studiu existent până în prezent care examinează această întrebare, având în vedere numărul limitat de pacienți cu BC metaplastic raportat în seriile instituționale. Sunt necesare investigații suplimentare pentru a înțelege predilecția biologică pentru răspândirea metastatică în BC metaplastic și pentru a valida constatările noastre în seturi de date separate ale pacienților cu BC metaplastic.
Standardul nostru actual de îngrijire nu este în mod clar adecvat pentru această populație unică de cancer, iar obținerea de date randomizate privind BC metaplastic în viitor va necesita eforturi de cooperare din cauza numărului mic de pacienți. NCDB oferă un punct forte demn de remarcat, și anume capacitatea de a studia modelele de tratament și rezultatele asociate cu un diagnostic rar. Cu 2.084 de persoane cu BC metaplastic în această cohortă, aceasta este una dintre cele mai mari investigații privind BC metaplastic raportate în epoca modernă. Supraviețuirea pentru acești pacienți este slabă în raport cu cei cu orice alt tip de BC și, deși acest fapt determină probabil încorporarea unei terapii agresive, studiul nostru sugerează că un tratament local-regional mai extins (de exemplu, ALND sau iradierea ganglionilor regionali) ar trebui să fie luat în considerare cu atenție, de la caz la caz. În general, utilizarea terapiei sistemice este crucială pentru managementul BC metaplastic, indiferent de încărcătura ganglionară, iar dezvoltarea unor terapii țintite eficiente bazate pe analiza profilului genomic al tumorii este promițătoare pentru viitor.
Material suplimentar
![]()
Tabel suplimentar.
Recunoștințe
Mulțumiri speciale lui Christine Wogan pentru asistență editorială.
Finanțare
Sprijinit parțial de Cancer Center Support (Biostatistics Core) Grant CA016672 de la National Cancer Institute, National Institutes of Health, către The University of Texas MD Anderson Cancer Center.
Competing Interests
Autorii au declarat că nu există niciun interes concurent.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Carcinomul mamar – tipuri rare: revizuire a literaturii. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiș A, Ustün EE, Zekioglu O, Ozdemir N. Carcinomul metaplastic al sânului: constatări clinice, mamografice și ecografice cu corelație histopatologică. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Prognosticul mai rău al pacientelor cu cancer de sân metaplastic decât al altor paciente cu cancer de sân triplu negativ. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Carcinoamele metaplastice ale sânului: V. Carcinomul metaplastic cu celule gigantice osteoclastice. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Carcinoamele metaplastice ale sânului. I. Carcinomul producător de matrice. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Carcinoamele metaplastice ale sânului. II. Carcinomul cu celule fusiforme. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Jung S-Y, Ro JY. et al. Cancerul de sân metaplastic: caracteristici clinico-patologice și prognosticul său. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. Octombrie. 2018
10. Baza de date națională privind cancerul.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Disecția ganglionilor limfatici în cancerul mamar. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistical Methods for the Analysis of Biomedical Data (Metode statistice pentru analiza datelor biomedicale). New York, SUA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS* (Estimare neparametrică din observații incomplete). Sursa J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modele de regresie și tabele de viață. Tabele de viață Cox. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Cancerul mamar metaplastic: prognostic și răspuns la terapia sistemică. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. Baza națională de date privind cancerul: o inițiativă puternică pentru îmbunătățirea îngrijirii cancerului în Statele Unite. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Tratamentul cancerului mamar metaplastic și rezultatele la 2500 de pacienți: A Retrospective Analysis of a National Oncology Database (O analiză retrospectivă a unei baze de date naționale de oncologie). Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Cancerul de sân triplu-negativ la femeile afro-americane: disparități față de biologie. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Markeri prognostici în cancerul de sân triplu-negativ. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Epidemiologia cancerului de sân și factorii de risc. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. The Clinicopathological Features and Survival Outcomes of Different Histological Subtypes in Triple-negative Breast Cancer. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Carcinomul metaplastic al sânului este mai agresiv decât cancerul mamar triplu-negativ: A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Răspunsul la terapia neoadjuvantă și supraviețuirea pe termen lung la pacienții cu cancer de sân triplu-negativ. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Răspuns patologic complet și beneficiu clinic pe termen lung în cancerul de sân: analiza combinată CTNeoBC. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Brown A, Mamounas E. et al. Efectul chimioterapiei preoperatorii asupra bolii loco-regionale la femeile cu cancer de sân operabil: constatări din cadrul Proiectului național chirurgical adjuvant pentru sân și intestin B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Lin CH, Huang CS. et al. Lipsa de eficacitate la chimioterapia sistemică pentru tratamentul carcinomului metaplastic al sânului în epoca modernă. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. 30. Prat A, Parker JS, Karginova O. et al. Caracterizarea fenotipică și moleculară a subtipului intrinsec de cancer de sân cu nivel scăzut de claudină. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identificarea subgrupurilor relevante pentru prognostic la pacientele cu cancer de sân triplu-negativ chimiorezistent. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. 33. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Tehnici și avantaje pentru economisirea cardiacă în timpul iradierii cancerului de sân. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Revizuirea tehnicilor de menținere a respirației de inspirație profundă pentru tratamentul cancerului de sân. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Factori predictivi asupra rezultatelor în cancerul mamar metaplastic. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastic carcinom of the breast: Prognosticul și răspunsul la tratamentul sistemic în boala metastatică. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Tratamentul adjuvant al cancerului mamar metaplastic triplu-negativ cu paclitaxel săptămânal și chimioterapie cu platină: Retrospective Case Review From a Single Institution. Clin Breast Cancer. Mai. 2019
Contactul autorului
.