Proprietățile apei
Unul dintre lucrurile care face ca planeta noastră să fie specială este prezența apei lichide. Apa este fundamentală pentru toate formele de viață; fără ea, orice ființă vie ar muri.
Apa acoperă aproximativ 70% din suprafața Pământului și constituie 65-75% din corpul nostru (82% din sângele nostru este apă). Chiar dacă apa ar putea părea plictisitoare – fără culoare, gust sau miros – ea are proprietăți uimitoare care o fac necesară pentru susținerea vieții.
(Nevoia noastră de apă și a animalelor oceanice care trăiesc în apă, este ceea ce face ca deversările de petrol să fie atât de dăunătoare.)
Compoziția chimică a apei este H2O – doi atomi de hidrogen și un atom de oxigen. Proprietățile apei sunt speciale datorită modului în care atomii săi se leagă între ei pentru a forma o moleculă de apă și a modului în care moleculele interacționează între ele.
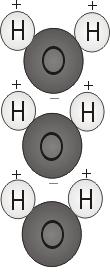
Polaritatea apei
Când cei doi atomi de hidrogen se leagă de oxigen, ei se atașează de partea superioară a moleculei mai degrabă ca niște urechi de Mickey Mouse. Această structură moleculară conferă moleculei de apă polaritate, sau o sarcină electrică dezechilibrată care atrage alți atomi.
Extremul moleculei cu cei doi atomi de hidrogen este încărcat pozitiv. Celălalt capăt, cu oxigenul, este încărcat negativ. La fel ca într-un magnet, unde polii nordici sunt atrași de polii sudici („contrariile se atrag”), capătul pozitiv al moleculei de apă se va conecta cu capătul negativ al altor molecule.
Ce înseamnă acest lucru pentru noi? Polaritatea apei îi permite să dizolve foarte ușor alte substanțe polare. Atunci când o substanță polară este pusă în apă, capetele pozitive ale moleculelor sale sunt atrase de capetele negative ale moleculelor de apă și viceversa. Atracțiile fac ca moleculele noii substanțe să se amestece uniform cu moleculele de apă.
Apa dizolvă mai multe substanțe decât orice alt lichid – chiar și cel mai puternic acid! Din acest motiv, ea este adesea numită „solventul universal”. Puterea de dizolvare a apei este foarte importantă pentru viața pe Pământ. Oriunde merge apa, ea transportă substanțe chimice dizolvate, minerale și nutrienți care sunt folosiți pentru a susține ființele vii.
Din cauza polarității lor, moleculele de apă sunt puternic atrase una de alta, ceea ce conferă apei o tensiune de suprafață ridicată. Moleculele de la suprafața apei „se lipesc” pentru a forma un fel de „piele” pe apă, suficient de puternică pentru a susține obiecte foarte ușoare. Insectele care merg pe apă profită de această tensiune superficială.
Tensiunea superficială face ca apa să se adune în picături în loc să se răspândească într-un strat subțire.
De asemenea, permite apei să se deplaseze prin rădăcinile și tulpinile plantelor, prin termometre și prin cele mai mici vase de sânge din corpul dumneavoastră. Pe măsură ce o moleculă se deplasează în sus, ea le „trage” și pe celelalte cu ea.
Trei stări ale materiei
Apa este unul dintre cele patru elemente și singura substanță naturală care poate exista în toate cele trei stări ale materiei – solid, lichid și gaz – la temperaturile întâlnite în mod normal pe Pământ.
Multe alte substanțe trebuie să fie supraîncălzite sau -răcite pentru a-și schimba stările.
Starea gazoasă a apei este prezentă în permanență în atmosfera noastră sub formă de vapori de apă. Starea lichidă se găsește peste tot în râuri, lacuri și oceane.
Starea solidă a apei, gheața, este unică. Majoritatea lichidelor se contractă pe măsură ce sunt răcite, deoarece moleculele se mișcă mai încet și au mai puțină energie pentru a rezista atracției reciproce. Când îngheață în stare solidă, ele formează cristale bine compactate care sunt mult mai dense decât era lichidul inițial.
Apa nu acționează în acest fel. Când îngheață, ea se extinde: moleculele se aliniază pentru a forma o structură cristalină foarte „deschisă” care este mai puțin densă decât apa lichidă.
De aceea gheața plutește. Și este un lucru bun că o face! Dacă apa ar acționa ca majoritatea celorlalte lichide, lacurile și râurile ar îngheța solide și toată viața din ele ar muri.
Alte trei proprietăți ale apei
Apa are o căldură specifică ridicată. Adică, spre deosebire de aer, apa poate absorbi multă căldură fără a-și schimba temperatura. Acesta este motivul pentru care înotul are o senzație atât de răcoritoare într-o zi călduroasă.
Apa pierde, de asemenea, căldura mai încet decât aerul. Rezultatul este că, în timpul verii, apa lacurilor și a oceanelor este de obicei cea mai rece la începutul sezonului și cea mai caldă la sfârșitul sezonului (după multe zile de absorbție a energiei solare).
Punctul de fierbere al apei (212° F sau 100°C la nivelul mării) este afectat de altitudine. În general, cu cât altitudinea este mai mare, cu atât punctul de fierbere al apei este mai mic. De exemplu, în Denver, CO (5.280 ft.), apa fierbe la 202,4° F. Pe Muntele Everest din Nepal (29.012 ft.), apa fierbe la 156° F.
Proiecte de științe ale apei:
- Ciclul apei
- Roata apei
- Apă super-răcită
- Rezervor de apă
.