- Context
- Fiziologia normală și fiziopatologia potasiului
- Potențialul de acțiune al unui cardiomiocit nepacemaker
- Potențialul de acțiune al unei celule cardiace pacemaker
- Conducția curentului
- Perioada refractară
- Hiperkaliemia, clasificare și cauze
- Clasificare
- Cauze
- Efectele hiperkaliemiei
- Efecte metabolice
- Pompa de sodiu și potasiu
- Concluzie
Context
Potasiul este un cation moale, alb-argintiu, foarte reactiv, aparținând familiei de metale alcaline din tabelul periodic. Este cel mai abundent cation în corpul uman în ansamblu și cel mai răspândit ion în compartimentele sale intracelulare.
În medie, o dietă occidentală conține între 80-100 mEq de potasiu pe zi, iar în condiții fiziologice normale, 90% din acesta este absorbit pasiv, lăsând doar 9,0 mmol pentru excreția fecală. Cei 3.500-4.000 mmol păstrați în organism sunt disproporționați față de nivelurile plasmatice diurne de potasiu, care sunt menținute în mod normal în intervalul 3,5-5,3 mmol/L printr-un mecanism strâns de homeostazie, nivelurile cele mai scăzute fiind noaptea și la primele ore ale dimineții, iar cel mai ridicat nivel maxim în orele după-amiezii.
După ce este absorbit în fluxul sanguin, devine rolul rinichiului de a adapta aportul de potasiu la producția de potasiu; fiind nevoie de mai multe ore, timp în care „echilibrul intern al potasiului” sub influența insulinei și a catecolaminelor menține homeostazia temporară prin deplasarea potasiului între spațiul intracelular și cel extracelular. Stimularea receptorilor alfa împiedică intrarea potasiului în celule, iar stimularea receptorilor beta o favorizează prin activarea pompei sodiu-potasiu ATPază.
Pompa sodiu-potasiu ATPază este enzima gate-keeper situată în sarcolemă. Ea ajută la salvgardarea a 98% din potasiul (aproximativ 144,0 mmol) reținut în interiorul celulei. Acest lucru asigură păstrarea diferenței de potențial vital de-a lungul membranelor celulare, necesară pentru buna funcționare a celulelor, în special a celulelor excitabile, cum ar fi celulele nervoase și celulele musculare cardiace.
Fiziologia normală și fiziopatologia potasiului
După absorbția sa rapidă, potasiul ajută la orchestrarea propriilor niveluri corporale prin eliberarea de insulină și aldosteron. Alți stimuli intrinseci organismului care se pare că controlează, de asemenea, nivelurile corporale de potasiu includ receptorii beta-2 adrenergici, PH-ul alcalin al sângelui și anabolismul celular.
Liberarea de insulină și aldosteron: Potasiul ingerat intră rapid în circulație. Ajuns în circulația portală, stimulează pancreasul să elibereze insulină. Concomitent, potasiul circulant care ajunge în celulele juxtaglomerulare determină eliberarea de renină. Când ajunge în ficat, renina este transformată în angiotensină I. Angiotensina I ajunge în plămâni, unde este transformată în angiotensină II. Angiotensina II își termină apoi drumul înapoi la rinichi prin sângele circulant pentru a stimula zona glomeruloasă să secrete aldosteron.
Echilibru intern de potasiu: Insulina eliberată post-prandial acționează în primul rând asupra mușchilor scheletici, activând două căi, calea dependentă de AKT responsabilă de inserția transportorului de glucoză GLUT4 și calea APK care activează ATPaza celulară sodiu-potasiu pentru a muta potasiul în spațiul intracelular. Spre deosebire de calea AKT-dependentă, calea APK nu este afectată nici de sindromul metabolic, nici de boala cronică de rinichi (figura 1).
Excreție: Potasiul filtrat de glomerulii renali este reabsorbit pasiv în tubulii proximali și în ansa Henle proporțional cu cantitatea de sodiu și apă furnizată. În mod normal, numai aproximativ 10% din încărcătura filtrată ajunge în nefronul distal.
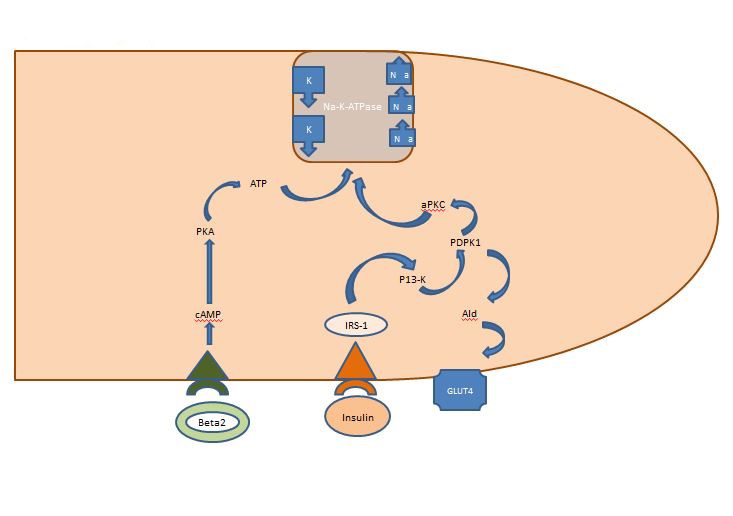
Figura 1. Acțiunea insulinei asupra unei celule musculare scheletice. Insulina eliberată post-prandial activează două căi în mușchii scheletici, calea dependentă de AKT responsabilă de inserția transportorului de glucoză GLUT4 și calea APK care activează ATPaza celulară sodiu-potasiu pentru a muta potasiul în spațiul intracelular.
La începutul tubului convolutat distal, începe secreția de potasiu în exces și crește progresiv pe măsură ce avansează mai departe spre nefronul distal și în canalul colector. Acest lucru este mediat de creșterea ATPazei hidrogenului de potasiu pe celulele alfa-intercalate .
Prezența unor niveluri mai ridicate de potasiu în celulele peritubulare ale rinichilor activează sistemul RAAS pentru a elibera aldosteron, care activează ATPaza sodiu-potasiu din membrana bazolaterală, rezultând o scădere a sodiului intracelular care duce la creșterea transportului electrogen de absorbție a potasiului prin hiperpolarizarea tensiunii membranare și permite excreția acestuia în urină .
În hiperkaliemia, cota de potasiu excretată prin colon poate crește cu până la 30%, de ex, în cazurile de insuficiență renală, unde potasiul este apoi preluat în mod activ de către pompa ATPază sodiu-potasiu activată în membrana bazolaterală a enterocitelor colonice, pentru a fi excretat pe partea cealaltă, în lumenul colonic, prin canalele mari de potasiu apicale dependente de calciu ale celulelor.
Din cele de mai sus se poate distinge astfel că mecanismul homeostaziei nivelului plasmatic al potasiului este ordonat în principal de interacțiunea a trei tranzacții simultane – aportul de potasiu, deplasările intra/extracelulare de potasiu și excreția urinară de potasiu, toate acestea bazându-se în cele din urmă pe pompa sodiu-potasiu.
Pentru a înțelege mecanismul pericolului iminent al hiperkaliemiei și managementul acesteia, trebuie să se înțeleagă fiziologia potențialului de acțiune și măruntaiele enzimei sodiu potasiu ATPază.
Electrofiziologia potențialului de acțiune, adică, mișcarea ionică prin membranele celulare, este determinată de diferența dintre două potențiale, un „potențial chimic” în care ionii se deplasează în josul gradientului lor de concentrație și un „potențial electric” în care ionii și moleculele resping sarcinile similare, rezultând potențialul transmembranar (TMP), despre care se spune că este +ve atunci când mișcarea netă a ionilor +ve este spre exteriorul celulei și invers.
Potențialul de acțiune al unui cardiomiocit nepacemaker
Există cinci faze ale unui potențial de acțiune, care încep și se termină la faza 4. Pompele implicate în acest proces includ schimbătorul de sodiu și calciu din sarcolemă, ATPază de calciu și, în cele din urmă, ATPază de sodiu și potasiu.
- Faza 4. Faza de repaus: aceasta are un potențial de repaus de -90 mV ca urmare a mișcării constante spre exterior a potasiului prin intermediul canalelor redresoare spre interior. În timpul acestei faze, atât canalele de sodiu cât și cele de calciu sunt închise.
- Faza 0. Faza de depolarizare: declanșarea unei celule pacemaker sau conducerea acesteia printr-o celulă vecină declanșează creșterea TMP la peste -90 mV. În acest moment , „canalele rapide de sodiu” încep să se deschidă unul câte unul, permițând sodiului să intre în celulă, ridicând TMP și, odată ce suficiente canale rapide de sodiu s-au deschis pentru a ceda -70 mV, se pune în mișcare un curent de sodiu de intrare autoîntreținut, depolarizarea rapidă a TMP la 0 mV pentru o perioadă tranzitorie intermediară cunoscută sub numele de „depășire”, moment în care canalele rapide de sodiu dependente de timp se închid și canalele de calciu „cu deschidere lungă” se deschid pentru a ridica TMP la -40 mV și a permite un mic aflux constant de calciu pe gradientul de concentrație.
- Faza 1. Faza de repolarizare timpurie: aceasta începe cu TMP ușor +ve și cu deschiderea scurtă a unor canale de potasiu care are ca rezultat fluxul acestuia spre exteriorul celulei, readucând TMP înapoi la aproximativ 0 mV.
- Faza 2. Faza de platou: aici cei doi contracurenți sunt echilibrați din punct de vedere electric și au ca rezultat menținerea TMP-ului echilibrat la puțin sub 0 mV. „Canalele de calciu cu deschidere îndelungată” sunt încă deschise, ceea ce duce la un flux constant de calciu în celulă. Canalul de potasiu cu redresor întârziat permite trecerea potasiului spre exteriorul celulei pe gradientul de concentrație al acesteia.
- Faza 3. Faza de repolarizare: în timpul acestei faze, canalele de calciu sunt inactivate treptat, iar fluxul persistent de potasiu spre exteriorul celulei depășește astfel fluxul de calciu care intră în interiorul celulei, returnând potasiul în spațiul intracelular, iar sodiul și calciul în exteriorul celulei.
Potențialul de acțiune al unei celule cardiace pacemaker
Celele cardiace pacemaker au o automatică înnăscută, permițând depolarizarea lor în cicluri ritmice. Nodul sinoatrial (SAN) are cel mai mare ritm de depolarizare autoinițiat, cu o rată de 60-90/min, urmat de nodul atrioventricular (AVN) cu o rată de 40-60/min și apoi de fibrele Purkinje și mușchiul ventricular cu 20-40/min.
Potențialele de membrană ale celulelor pacemaker sunt instabile și potențialele lor de acțiune nu au faze clare. Ele au mai puține canale de potasiu cu rectificare interioară și TMP-ul lor nu scade niciodată sub -60 mV, eliminând rolul canalelor de sodiu rapide care necesită un TMP de -90 mV, ceea ce duce la absența fazei de depolarizare rapidă.
La TMP >-60 mV, curentul „funny/pacemaker” este pus în acțiune cu un flux spontan de ioni prin canalele lente de sodiu, depolarizând TMP la <-50 mV și apoi înapoi la -60 mV când canalele de calciu se închid.
Conducția curentului
Toate cardiomiocitele sunt cuplate electric prin joncțiunea gap, inclusiv celula pacemaker. Acest lucru facilitează depolarizarea generalizată a tuturor celulelor învecinate, transformând inima într-o singură unitate funcțională în care celula cu cea mai mare rată inerentă devine „pacemaker”
Perioada refractară
Perioada refractară mai lungă în timpul platoului lung din faza 2 datorită canalelor de calciu lente asigură timpul necesar pentru golirea completă a ventriculilor înainte de următoarea contracție. Perioadele refractare pot fi absolute (ARP), efective (ERP) sau relative (RRP). Într-o ARP, celula este absolut neexcitabilă.
O ERP durează de la ARP până la segmentul scurt al fazei 3. Un stimul în acest moment ar putea depolariza minim celula, dar nivelul de depolarizare este mai slab decât propagarea unui potențial de acțiune la celulele vecine.
RRP este provocată de un stimul peste normal, care duce la depolarizarea celulei și la producerea unui potențial de acțiune.
O „perioadă supranormală” este o stare hiperexcitabilă în timpul căreia un stimul mai slab decât normal ar putea duce la o aritmie, necesitând sincronizarea în timpul cardioversiei pentru a evita fibrilația ventriculară (figura 2).
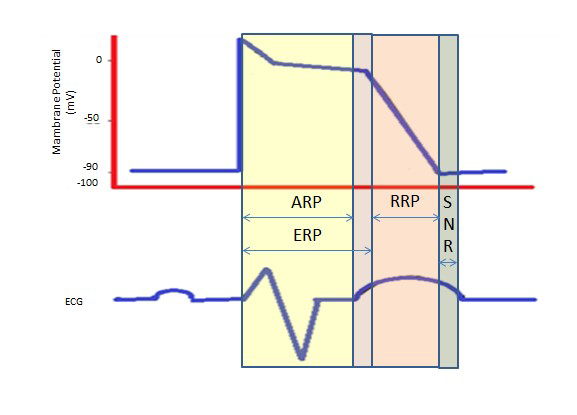
Figura 2. Perioade refractare. ARP: Absolute Refractory Period (perioadă refractară absolută); ERP: Perioadă refractară efectivă; RRP: Relative Refractory Period; SNR: Supranormal Refractory Period
Hiperkaliemia, clasificare și cauze
Clasificare
Hiperkaliemia este clasificată ca fiind ușoară atunci când nivelurile sunt în intervalul 5,5-6,0 mmol/L, moderată de la 6,1-6,9 mmol/L și severă la niveluri de 7.0 mmol/L sau mai mare, și la orice nivel la care apar modificări ECG .
Cauze
Hiperkaliemia apare atunci când mecanismele compensatorii nu mai pot face față dezechilibrului, motiv pentru care este de obicei multifactorială.
- Creșterea aportului de potasiu pe orice cale, de ex, aportul alimentar pe cale orală sau administrarea intravenoasă de lichide care conțin potasiu, cum ar fi penicilina G.
- Reținerea de către rinichi: deoarece excreția potasiului depinde de aldosteron și de aportul unei cantități distale suficiente de sodiu și apă în interiorul nefronilor, afecțiuni precum insuficiența renală, insuficiența suprarenală (boala Addison) , hiporeninemie hipoaldosteronism de tip IV, acidoza tubulară renală, în special la pacienții cu nefropatie diabetică, precum și orice afecțiune care favorizează hipoperfuzia, ca în cazul depleției de volum și al insuficienței cardiace congestive, va afecta echilibrul complicat al potasiului în organism și va predispune la hiperkaliemie.
- Insuficiența suprarenală: aceasta trebuie exclusă la pacienții hiperkaliemici, în special în prezența hiponatremiei și a slăbiciunii musculare. Pentru a depista insuficiența suprarenală primară, se efectuează un test standard de stimulare cu cosintropină, în care se administrează 0,25 mg de cosintropină sintetică sub formă de bolus intravenos, urmat de măsurarea cortizolului plasmatic între 45 de minute și 1 oră mai târziu. Valorile mai mici de 20 mcg/dL sunt sugestive pentru insuficiență suprarenală.
- Medicamentele care rețin potasiul: medicamentele eliberate pe bază de prescripție medicală care reduc activitatea ATPazei sodiu-potasiu, cum ar fi blocantele receptorilor beta-adrenergici, și medicamentele care reduc secreția de aldosteron, cum ar fi inhibitorii ACE și ARB, medicamentele antiinflamatoare nesteroidiene și diureticele care economisesc potasiul, trebuie urmărite îndeaproape pentru a evita hiperkaliemia iatrogenă, în special în grupa de vârstă geriatrică, cu declinul lor progresiv al funcției renale ca parte a procesului de îmbătrânire.
- Perturbații în deplasarea transcelulară a potasiului: aceasta poate apărea în condiții de acidoză, hiperglicemie, hiperosmolalitate, exerciții fizice severe, degradare tisulară, paralizie periodică hiperkaliemică și în cazul blocantelor beta-adrenergice. Pentru fiecare scădere de 0,1 unități a PH-ului sanguin, potasiul seric crește cu aproximativ 0,6 mmol/L (mai puțin dacă acidoza este cauzată de acizi organici) .
- Pseudo-hipoaldosteronismul este o boală congenitală autosomal recesivă în care rinichii sunt rezistenți la acțiunile aldosteronului.
- De asemenea, nu trebuie neglijată nici pseudohiperkaliemia: așa cum sugerează și numele, aceasta apare atunci când există un nivel ridicat al potasiului seric în prezența unui nivel normal al potasiului plasmatic. Ea poate fi observată în cazul sângelui hemolizat, al unui garou strâns prelungit în timpul unei proceduri de prelevare a sângelui, care determină eliberarea extracelulară de potasiu, la strângerea repetată a pumnului în timpul flebotomiei, la puncția venoasă traumatică, cu leucocitoză și trombocitoză și în unele sindroame genetice mai puțin frecvente, cum ar fi pseudohiperkaliemia familială și sferocitoza ereditară. Cu toate acestea, ar putea fi pur și simplu rezultatul unei simple erori de laborator.
Efectele hiperkaliemiei
Hiperkaliemia ușoară este adesea asimptomatică, detectată accidental prin teste de laborator, datorită simptomelor sale vagi, cum ar fi stare de rău, slăbiciune musculară și parestezii. Hiperkaliemia severă va afecta funcția neuromusculară sub formă de slăbiciune și paralizie a mușchilor scheletici; totuși, aceasta nu este o prezentare frecventă, deoarece toxicitatea cardiacă domină tabloul și este prezentarea preliminară. Toxicitatea cardiacă se va prezenta de obicei pe ECG în următoarea manieră escaladată în trepte, deși nu este neapărat așa, în funcție de etiologie:
- La niveluri mai mari de 5,5 mEq/L, creșterea conductanței canalelor de potasiu crește curentul lkr, ceea ce duce la repolarizare rapidă sub forma unei unde T cu vârf pe ECG de suprafață. Aceste unde T pot fi diferențiate de cele din infarctul miocardic și AVC prin durata lor scurtă, variind între 150-250 msec.
- La niveluri de potasiu mai mari de 6,5 mEq/L, apare o stare de depolarizare sub prag susținută, ceea ce determină o întârziere în depolarizarea atrială și ventriculară. Scăderea fazei 0 a potențialului de acțiune duce la un potențial de acțiune mai lung, producând o întârziere în conducerea intraventriculară și atrioventriculară. Pe ECG de suprafață, acest lucru se va prezenta cu o aplatizare și o pierdere a undelor P și o lărgire a complexelor QRS. Odată cu creșterea întârzierii în conducerea intraventriculară, ECG-ul de suprafață începe să prezinte semne de bloc de ramură stângă și dreaptă. Acest lucru poate fi diferențiat de boala de ramură a fasciculului prin faptul că în hiperkaliemie întârzierea persistă pe tot parcursul complexului QRS, nu doar în timpul porțiunii inițiale, respectiv terminale.
- La 10 mEq/L, conducerea sinoatrială nu mai apare și ritmul joncțional accelerat preia conducerea. Aritmiile ventriculare se dezvoltă cu fuziunea complexelor QRS lărgite cu undele T pentru a forma în cele din urmă modelul clasic de unde sinusoidale. Odată ce acest lucru se întâmplă, FV și asistolia sunt iminente și va urma apoi stop cardiac.
- Câteodată schimbările pot fi neregulate și imprevizibile, iar ECG-ul va sări de la normal la asistolie din cauza variabilității factorilor etiologici și a efectelor lor influente, de exemplu, rata de modificare a potasiului, concentrația de calciu, pH-ul și concentrația de sodiu. Astfel, hiperkaliemia trebuie tratată de urgență ori de câte ori nivelul de potasiu devine mai mare de 6,5 mmol/L sau în prezența manifestărilor ECG de hiperkaliemie, indiferent de nivelul de potasiu. Alte asocieri raportate cu hiperkaliemia acută includ: tablou de pseudo IM pe înregistrarea ECG, cu segment ST-T masiv ca urmare a dereglărilor în repolarizarea miocitelor, intervale PR și QT scurte, tahicardie sinusală, bradicardie sinusală, ritm idioventricular, bloc cardiac de gradul 1 și 2 .
Efecte metabolice
Hiperkaliemia duce la acidoză metabolică hipercloremică, deoarece hiperkaliemia favorizează absorbția intracelulară de potasiu în schimbul ionilor de hidrogen. Acest lucru creează alcaloză intracelulară, suprimând producția de amoniac renal în tubulii proximali, ceea ce duce la o scădere a excreției urinare de amoniu și acid și la o acidoză tubulară renală de tip IV .
Pompa de sodiu și potasiu
Pompa ATPază de sodiu și potasiu a fost descoperită în 1957 de Skou, care a primit ulterior o parte din Premiul Nobel pentru Chimie 1997 pentru descoperirea sa.
Skou a fost primul care a descoperit ATPaza de sodiu și potasiu în sarcolema de la suprafața celulară a mușchilor cardiaci. Prezența sa a fost detectată ulterior în fiecare organism eucariot unic și pluricelular.
Pompa sodiu-potasiu funcționează prin corelarea hidrolizei ATP cu exportul celular a trei ioni de sodiu în schimbul a doi ioni de potasiu împotriva gradienților electrochimici. Este ținta moleculară pentru digitalină și digoxină, care au fost folosite încă din secolul al XVIII-lea ca extracte de digitală.
Acțiunea pompei de sodiu și potasiu este reglată de o fosfoproteină fosfolemman, a cărei nefosforilare duce la inhibarea pompei și a cărei fosforilare duce la creșterea activității pompei. Aceasta are trei situsuri de fosforilare, două situsuri de palmitoilare și un situs de glutationilare, ceea ce explică multitudinea de semnale capabile să stimuleze și să inhibe pompa.
Pompa de sodiu și potasiu în sine este o enzimă compusă din mai multe subunități cu multiple izoforme. Prezența subunităților alfa și beta (în principal B1 în inimă) este esențială pentru funcția sa. Recent, o a treia subunitate proteică gamma a fost identificată în rinichi, dar până în prezent funcția sa rămâne necunoscută.
Subunitatea alfa este nucleul catalitic al enzimei pompei de sodiu și potasiu. Are aproximativ 100 kDa și conține situsurile de legare pentru sodiu, potasiu, ATP și steroizi cardiotonici precum ouabaina. Numai alfa 1 și alfa 2 prezintă o prezență semnificativă în miocitele cardiace normale și sunt legate funcțional de schimbătorul de sodiu și calciu (NCX). S-a raportat că alfa 3 înlocuiește alfa 2 în modelele experimentale de insuficiență cardiacă .
Datele din experimente recente favorizează implicarea ambelor subunități alfa 1 alfa 2 ale pompei în reglarea cuplării excitație-contracție (E-C). Se crede că alfa 1, despre care s-a constatat că este distribuită mai uniform în toată sarcolema, joacă mai mult un rol de „menajeră”, controlând atât contractilitatea cât și sodiul intracelular masiv, în timp ce alfa 2, a cărei expresie este concentrată în tubulii T împreună cu alte componente cheie ale cuplării E-C, se crede că se concentrează în principal pe contractilitate .
Factori cunoscuți care pot controla pompa de sodiu și potasiu includ: ATP, sodiul intracelular, barierele sub-sarcolemale și spațiile fuzzy, potențialul de membrană, căile de semnalizare intracelulară (căile de semnalizare adrenergică, proteina kinaza A & C, oxidul nitric, fosfolemmanul), reglarea directă prin molecule mici (lipide, steroizi cardiotonici endogeni), alte proteine asociate (caveolae și caveoline și ankyrin).
Concluzie
Hiperkaliemia este o provocare clinică și se poate prezenta la până la 10% din pacienții spitalizați . Rezultatul său final este amenințător de viață. Deoarece toate celulele din organism sunt în cele din urmă afectate de pompa sodiu-potasiu și se știe că mușchii cardiaci ischemici își extrudează extracelular potasiul, ceea ce duce la o reducere a pragului de aritmie cu posibilitatea apariției unor aritmii ventriculare care agravează hipopolarizarea și scad și mai mult pragul, trebuie să se concentreze mai multe studii asupra manipulării enzimei sodiu-potasiu, deoarece controlul acesteia ar putea modifica în mod favorabil rezultatele stopurilor cardiace și ar putea rescrie ghidurile actuale de resuscitare cardiopulmonară.