Contenit
- 1 Funcția
- 2 Lactat Dehidrogenază umană
- 2.1 Structura
- 2.2 Cataliză
- 2.3 Cinetică
- 2.4 Reglementare
- 3 Structuri 3D ale lactat dehidrogenazei
Funcția
L-lactat dehidrogenazei (L-LDH) catalizează interconversia piruvatului și a NADH+ în L-lactat și NAD+.
H-lactat dehidrogenază (H-LDH) catalizează interconversia D-lactatului și a fericitocromului c în piruvat și fericitocrom c.
Lactat Dehidrogenază (LDH) este o enzimă importantă la om. Ea apare în diferite regiuni ale corpului, fiecare regiune având o conformație unică a diferitelor subunități. LDH este o enzimă cheie în respirația anaerobă. Respirația anaerobă este cea în absența oxigenului. Această cale este importantă pentru glicoliză în două moduri principale. Primul este că, dacă piruvatul s-ar acumula glicoliza și, astfel, generarea de ATP ar încetini. Al doilea este că respirația anaerobă permite regenerarea NAD+ din NADH. NAD+ este necesar atunci când gliceraldehida-3-fosfat dehidrogenază oxidează gliceraldehida-3-fosfat în glicoliză, ceea ce generează NADH. Lactat dehidrogenaza este responsabilă de conversia anaerobă a NADH în NAD+. în Lactat dehidrogenază din Cryptosporidium parvum (4nd4).
Lactat Dehidrogenază umană
Structura
este o proteină cuaternară formată din combinarea a două subunități, M și H (mușchi și inimă) într-o structură de patru dintre subunități. Diferitele combinații întâlnite în corpul uman sunt:
- (4H) Inima
- (3H1M) Reticuloendotelială
- (2H2M) Plămânii
- (1H3M) Rinichii
- (4M) Mușchi și Ficat
Legenda LDH, așa cum este prezentată aici, este formată din 40% elice alfa și 23% foițe beta. Datele SCOP clasifică această formă de lactat dehidrogenază ca fiind mixtă beta-alfa-beta, cu foițe beta în principal paralele.
Vezi și
- Lactat Dehidrogenază umană
- Lactat de Jasper Final
- Plierea Rossmann.
Cataliză
Studiile au arătat că mecanismul de reacție al LDH urmează o secvență ordonată.
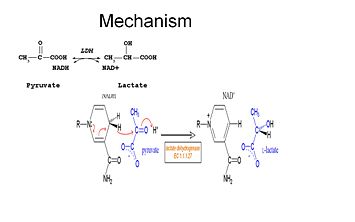
Pentru ca lactatul să fie oxidat, NADH trebuie să se lege mai întâi de enzimă, urmat de lactat. . Odată ce NADH este legat de enzimă, este posibilă legarea lactatului (este prezentat substratul oxamat; gruparea -CH3 este înlocuită cu -NH2 pentru a forma oxamat). Lactatul se leagă de enzimă între inelul de nicotinamidă și câteva reziduuri LDH. Transferul unui ion hidridă are loc rapid în ambele direcții, dând naștere la un amestec al celor doi complecși terțiari, enzimă-NAD+-lactat și enzimă-NADH-piruvat; în cele din urmă, piruvatul se disociază de enzimă, urmat de NAD+.
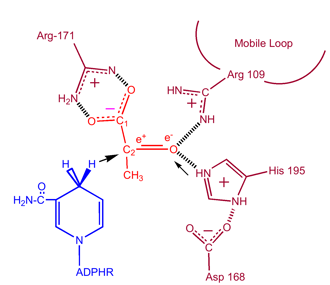
Cinetică
Studiile cinetice ale lactat-dehidrogenazei cu oxalat și oxamat (analogi structurali ai lactatului și piruvatului)au dovedit mecanismul enunțat mai sus. Etapa de limitare a vitezei în această reacție este viteza de disociere a NAD+ și NADH. Conversia piruvatului în lactat cu regenerarea ulterioară a NAD+ este foarte favorabilă.
Reglementare
Pentru că mecanismul este unul de echilibru, Se pare că nu există o reglare special concepută pentru lactat dehidrogenază, în schimb este dependentă de activarea reparării anaerobe și de prezența piruvatului și NADH, sau a lactatului și NAD+.
Structuri 3D ale lactat dehidrogenazei
Structuri 3D ale lactat dehidrogenazei
.
