Ce sunt enzimele și ce fac ele în corpul nostru? Enzimele sunt, în principiu, proteine care sunt produse de organismele vii pentru a determina anumite reacții metabolice și biochimice în organism. Ele sunt catalizatori biologici care accelerează reacțiile din interiorul organismului. Haideți să aflăm mai multe despre ele.
- Sugestii video:
- Care este structura enzimelor?
- Cercetăriți mai multe subiecte la rubrica Biomolecule
- Tipuri de enzime:
- Cum funcționează enzimele?
- Teoria 1: Ipoteza cheii și încuietorii
- Teoria 2: Ipoteza potrivirii induse
- Ce factori afectează activitatea enzimatică în celulă?
- Exemplu rezolvat pentru dumneavoastră
Sugestii video:
Care este structura enzimelor?
Enzimele, așa cum am menționat mai sus, sunt catalizatori biologici. În timp ce grăbesc sau accelerează un proces, ele oferă de fapt o cale alternativă pentru acest proces. Dar, în acest proces, structura sau compoziția enzimelor rămâne nealterată.
Enzimele sunt de fapt alcătuite din 1000 de aminoacizi care sunt legați într-un mod specific pentru a forma diferite enzime. Lanțurile enzimatice se pliază pentru a forma forme unice, iar aceste forme sunt cele care oferă enzimei potențialul său chimic caracteristic. Majoritatea enzimelor conțin, de asemenea, o componentă neproteică cunoscută sub numele de cofactor.
Cercetăriți mai multe subiecte la rubrica Biomolecule
- Biomacromolecule
- Monomeri de legătură
- Enzime
- Baze metabolice pentru viață
- Acizi nucleici
- Polizaharide
- Proteine
.
Tipuri de enzime:
Reacțiile biochimice care au loc în organism sunt, în principiu, de 6 tipuri, iar enzimele care determină aceste reacții sunt denumite în mod corespunzător:
- Oxidoreductaze: Aceste enzime determină reacții de oxidare și reducere și, prin urmare, se numesc oxidoreductaze. În aceste reacții, se transferă electroni sub formă de ioni de hidrură sau atomi de hidrogen. Atunci când un substrat este oxidat, aceste enzime acționează ca donator de hidrogen. Aceste enzime se numesc dehidrogenaze sau reductaze. Atunci când atomul de oxigen este acceptor, aceste enzime se numesc oxidaze.
- Transferaze: Aceste enzime sunt responsabile pentru transferul grupărilor funcționale de la o moleculă la alta. Exemplu: alanină aminotransferaza care amestecă grupa alfa-amino între alanină și aspartat etc. Unele transferaze transferă, de asemenea, grupe fosfat între ATP și alți compuși, reziduuri de zahăr pentru a forma dizaharide, cum ar fi hexokinaza în glicoliză.
- Hidrolaze: Aceste enzime catalizează reacții care implică procesul de hidroliză. ele rup legăturile simple prin adăugarea de apă. Unele hidrolaze funcționează ca enzime digestive, deoarece rup legăturile peptidice din proteine. Hidrolazele pot fi, de asemenea, un tip de transferaze, deoarece transferă molecula de apă de la un compus la altul. Exemplu: Glucoza-6-fosfataza care îndepărtează grupa fosfat din glucoza-6-fosfat, lăsând glucoza și H3PO4.
- Lilaza: Aceste enzime catalizează reacții în care se adaugă grupări funcționale pentru a rupe legăturile duble din molecule sau în care se formează legături duble prin îndepărtarea grupărilor funcționale. Exemplu: Piruvatul decarboxilază este o liază care elimină CO2 din piruvat. Alte exemple includ deaminazele și deshidratazele.
- Izomeraze: Aceste enzime catalizează reacțiile în care o grupare funcțională este mutată într-o altă poziție în cadrul aceleiași molecule, astfel încât molecula rezultată este de fapt un izomer al moleculei anterioare. Exemplu: triosefosfat izomeraza și fosfoglucoza izomeraza pentru transformarea glucozei 6-fosfat în fructoză 6-fosfat.
- Ligaze: Aceste enzime îndeplinesc o funcție care este opusă celei a hidrolazelor. În timp ce hidrolazele rup legăturile prin adăugarea de apă, ligazele formează legături prin îndepărtarea componentei de apă. Există diferite subclase de ligaze care implică sinteza de ATP.
Cum funcționează enzimele?
Pentru ca orice reacție să aibă loc în univers, există un necesar de energie. În cazurile în care nu există energie de activare furnizată, un catalizator joacă un rol important pentru a reduce energia de activare și a dus mai departe reacția. Acest lucru funcționează și în cazul animalelor și al plantelor. Enzimele ajută la reducerea energiei de activare a moleculelor complexe din reacție. Următorii pași simplifică modul în care funcționează o enzimă pentru a accelera o reacție:
Pasul 1: Fiecare enzimă are un „situs activ”, care este locul în care se poate lega una dintre moleculele de substrat. Astfel, se formează un complex enzimă-substrat.
Etapa 2: Această moleculă de enzimă-substrat reacționează acum cu cel de-al doilea substrat pentru a forma produsul, iar enzima este eliberată ca al doilea produs.
Există multe teorii care explică modul în care funcționează enzimele. Dar, există două teorii importante pe care le vom discuta aici.
Teoria 1: Ipoteza cheii și încuietorii
Aceasta este cea mai acceptată dintre teoriile acțiunii enzimelor.

Această teorie afirmă că substratul se potrivește exact în situsul activ al enzimei pentru a forma un complex enzimă-substrat. Acest model descrie, de asemenea, de ce enzimele sunt atât de specifice în acțiunea lor, deoarece sunt specifice moleculelor de substrat.
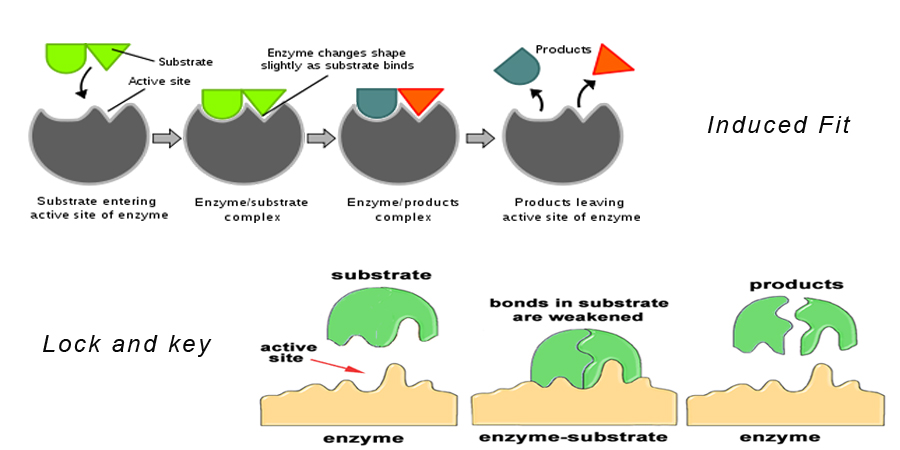
Teoria 2: Ipoteza potrivirii induse
Aceasta este similară cu ipoteza încuietorii și a cheii. Aceasta spune că forma moleculei enzimei se modifică pe măsură ce se apropie de molecula de substrat în așa fel încât molecula de substrat să se potrivească exact în situsul activ al enzimei.
Ce factori afectează activitatea enzimatică în celulă?
- Concentrația enzimelor și a substraturilor: Viteza de reacție crește odată cu creșterea concentrației de substrat până la un anumit punct, dincolo de care orice altă creștere a concentrației de substrat nu produce nicio modificare semnificativă a vitezei de reacție. Acest lucru se întâmplă deoarece, după o anumită concentrație a substratului, toate situsurile active ale enzimei sunt pline și nu mai poate avea loc nicio reacție.
- Temperatura: Odată cu creșterea temperaturii, activitatea enzimei crește din cauza creșterii energiei cinetice a moleculelor. Există un nivel optim în care enzimele funcționează cel mai bine și la maximum. Această temperatură este adesea temperatura normală a corpului. Atunci când temperatura crește dincolo de o anumită limită, enzimele, care sunt de fapt alcătuite din proteine, încep să se dezintegreze și viteza de reacție încetinește.
- pH: Enzimele sunt foarte sensibile la schimbările de pH și lucrează într-o fereastră foarte mică de niveluri de pH admisibile. Sub sau peste nivelul optim de pH, există riscul ca enzimele să se dezintegreze și astfel reacția încetinește.
- Inhibitori: Prezența anumitor substanțe care inhibă acțiunea unei anumite enzime. Acest lucru se întâmplă atunci când substanța inhibitoare se atașează la situsul activ al enzimei, împiedicând astfel atașarea substratului și încetinind procesul.
Exemplu rezolvat pentru dumneavoastră
Q: O enzimă acționează prin?
a. Creșterea energiei de activare
b. Scăzând energia de activare
c. Scăderea pH-ului
d. Creșterea pH-ului
Sol: a. Creșterea energiei de activare
Reactanții nu suferă modificări chimice în mod automat. Ei o fac în starea de tranziție. Starea de tranziție are mai multă energie liberă decât reactanții sau produșii. Incapacitatea reactanților de a suferi o schimbare din cauza necesității de energie suplimentară pentru transformarea lor în starea de tranziție se numește „barieră energetică”. Energia necesară pentru a depăși bariera energetică se numește „energie de activare”.
.