Cum a început viața pe Pământ? Pe o planetă tânără și stâncoasă, cum ar fi putut substanțele chimice să se unească în modul potrivit pentru a forma primele celule? Cum au început aceste celule primitive să se comporte ca o formă de viață: să crească, să se dividă și să transmită trăsături avantajoase generației următoare?
Originea vieții este deosebit de neclară, deoarece înregistrarea geologică – straturile de rocă și fosilele încorporate care conțin indicii despre istoria Pământului și a vieții – dispare în urmă cu aproximativ 3,9 miliarde de ani, fiind ștearsă de mișcările din scoarța planetei. Ca urmare, oamenii de știință nu au dovezi directe despre condițiile de pe Pământul timpuriu, inclusiv dovezi ale moleculelor care ar fi putut să se învârtă în iazurile primordiale și să formeze elementele constitutive ale vieții.
Acest lucru prezintă o multitudine de întrebări, exact genul de întrebări mari de care este atras Jack Szostak. El și alții cred că pot reconstrui în laborator lunga cale care a dus de la substanțele chimice din spațiu, la formarea Pământului, la chimia pre-viață pe planetă, la primele protocelule și, în cele din urmă, la celulele avansate cu metabolism și sinteză de proteine. Explorări întinse ca acestea necesită expertiză în multe domenii, inclusiv chimie și biochimie, geologie și geofizică și astronomie.
Szostak (pronunțat shah-stak) poate fi persoana ideală pentru a căuta răspunsuri. Laureat al premiului Nobel, profesor de genetică la Harvard Medical School, profesor de chimie și biologie chimică în cadrul Facultății de Arte și Științe, Rich Distinguished Investigator la Massachusetts General Hospital (MGH) și cercetător la Howard Hughes Medical Institute, el este descris de alții ca fiind un om de știință strălucit și motivat. Dar este, de asemenea, cunoscut pentru umilința sa blândă, inclusiv pentru disponibilitatea de a se scufunda în profunzime în subiecte care sunt noi pentru el, și pentru colegialitatea sa, pentru că ajută la încurajarea schimbului de idei care face ca știința să avanseze.
Propria sa cercetare se concentrează pe un segment al căii spre viață: protocelula, „o celulă primordială foarte, foarte simplă, care se putea asambla din substanțe chimice care existau încă de la început, pe suprafața Pământului”, explică Szostak. El speră să înțeleagă modul în care aceasta ar crește, s-ar diviza și ar începe să se reproducă și, în cele din urmă, să evolueze. „S-ar putea să nu știm ce s-a întâmplat de fapt, dar poate că putem elabora diferite căi posibile”, spune el. „Tot ce putem face este să încercăm să asamblăm în laborator lucruri care par plauzibile.”
„Evoluție dirijată”
În luna august a acestui an, Szostak a împlinit patruzeci de ani la Harvard și treizeci și cinci la MGH (unde se află laboratorul său), un mandat marcat de descoperiri importante într-o varietate surprinzătoare de domenii. În anii 1980, laboratorul său a efectuat experimente cu drojdii pentru a înțelege genetica și biochimia recombinării ADN – activitate care a condus la modelul de reparare a rupturii de dublu catenar, care descrie modul în care catenele lungi de ADN se rup, schimbă segmente și apoi se reunesc. Acest lucru a determinat cercetări ulterioare asupra mecanismului de recombinare în timpul meiozei, diviziunea celulară care duce la apariția spermatozoizilor și a ovulelor.
În aceeași perioadă, echipa sa a făcut, de asemenea, descoperiri importante despre telomeri-capacele protectoare, care se găsesc la capetele cromozomilor și care asigură că ADN-ul se replică în mod corespunzător pe măsură ce celulele se divid. Pentru aceste cercetări, Szostak a primit mai târziu Premiul Nobel pentru Fiziologie sau Medicină în 2009, pe care l-a împărțit cu cercetătorii Elizabeth Blackburn, Sc.D. ’06, acum emerită la UC, San Francisco, și Carol Greider de la Johns Hopkins.
Până în momentul în care Szostak a primit apelul telefonic de dimineață din Suedia, în octombrie 2009, el petrecuse deja mai mult de 20 de ani aducând contribuții fundamentale în alte domenii ale științei. După descoperirile despre telomeri de la mijlocul anilor 1980 (cercetările au legat telomerii scurtați de multe boli ale îmbătrânirii), mulți oameni de știință au intrat în acest domeniu, iar Szostak a ales să schimbe direcția. „Era destul de clar care trebuiau să fie următoarele experimente și am simțit că orice am fi făcut va fi făcut oricum”, și-a amintit el. „Nu am simțit niciodată că are rost să faci lucruri care oricum vor fi făcute. Așa că asta chiar m-a făcut să mă uit în jur și să mă gândesc la ce alte tipuri de întrebări științifice aș putea începe să abordez”. În 1984, a acceptat o ofertă de a-și muta laboratorul de la ceea ce era pe atunci Sidney Farber Cancer Institute la MGH, pentru a se alătura cercetătorilor de acolo care lucrau în domeniul științelor fundamentale. „A fost o ofertă uimitoare: toate cercetările mele urmau să fie finanțate integral timp de 10 ani”, își amintește Szostak. „Era perfectă pentru mine, deoarece îmi permitea să îmi schimb direcția fără să îmi fac griji cu privire la scrierea de granturi într-un domeniu nou.”
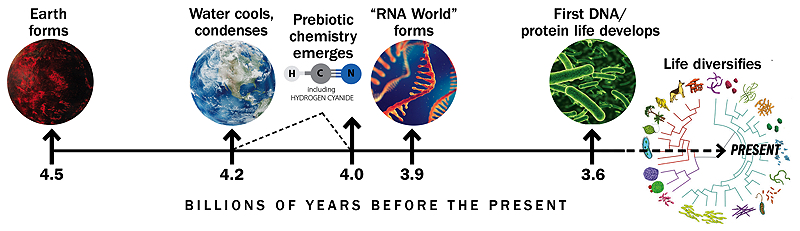
Timpul bazat pe un grafic similar realizat de Gerald Joyce
După ce și-a analizat opțiunile, a optat pentru enzimele ARN, cunoscute sub numele de ribozime, un domeniu pe care l-a văzut ca fiind „interesant, tratabil și nu foarte competitiv”. El și studenții săi absolvenți au început să dezvolte instrumente pentru a face să evolueze ARN-ul, moleculele monocatenare din celule care copiază informațiile genetice conținute în ADN. În eprubete, echipa sa a determinat ARN-ul să preia noi roluri, cum ar fi recunoașterea moleculelor țintă și catalizarea reacțiilor. Cunoscut sub numele de „evoluție dirijată”, acest proces a implicat introducerea de mutații în șirurile de ARN, căutând variante care ar putea îndeplini funcții utile și permițând acestor molecule noi să se reproducă. Ei au făcut, de asemenea, lucrări similare cu ADN, peptide și proteine.
În 1994, Szostak a primit Premiul Academiei Naționale de Științe în domeniul biologiei moleculare, împreună cu cercetătorul Gerald Joyce, în prezent de la Institutul Salk pentru Studii Biologice, pentru dezvoltarea simultană, dar independentă, a evoluției in vitro a ARN-ului. „Este o tehnologie pentru a crea molecule care îți execută ordinele”, a explicat Joyce într-un interviu, descriind-o ca fiind similară cu modul în care oamenii de știință din agricultură cresc vacile pentru a produce mai mult lapte sau dezvoltă culturi care rezistă la secetă. „Aceasta este versiunea moleculară a acestui lucru. Și este ceva care este acum practicat pe scară foarte largă”, adaugă el (vezi „Harnessing Evolution”, ianuarie-februarie 2017, pagina 15), o modalitate de a dezvolta noi molecule pentru o serie de utilizări, inclusiv medicamente.
Pentru Szostak, activitatea privind evoluția dirijată a ridicat noi întrebări. „Am devenit din ce în ce mai interesat de modul în care evoluția a început de la sine pe Pământul timpuriu”, își amintește el. „Una este să impui presiuni selective și să faci evoluția darwinistă în laborator, unde ai enzime și studenți și instrumente. Dar, cumva, evoluția darwiniană a început de la sine”. Având în vedere că abilitatea de a evolua este o caracteristică cheie a vieții, Szostak a pus una dintre întrebările fundamentale ale științei: Cum a început viața?
Origine: „Trei întrebări mari, fundamentale”
Canadianul american Szostak s-a născut la Londra, unde tatăl său studia pentru o diplomă în inginerie aeronautică. Familia s-a întors în cele din urmă în Canada, unde au locuit în Ottawa și apoi la Montreal, iar tatăl său a lucrat pentru Forțele Aeriene Canadiene. (Accentul lui Szostak păstrează indicii ale moștenirii sale canadiene.) Mama sa a lucrat mulți ani în funcții administrative pentru o companie chimică industrială, iar Szostak a avut acolo primul său loc de muncă de vară în adolescență, testând rezistența culorilor în laboratorul de coloranți al companiei. „Slujba era repetitivă și plictisitoare, dar mi-a oferit o primă imagine despre cât de important este să testez și să testez din nou produsele pentru utilizarea în lumea reală”, își amintește el. În acel moment, era „serios interesat” de știință, matematică și inginerie. Și-a obținut doctoratul în biochimie la 25 de ani, la Cornell, și îl numește pe consilierul său, Ray Wu, un mentor important: „El a creat un mediu de laborator grozav, dar mi-a arătat și cum să cer ajutor pentru un proiect atunci când mă confrunt cu probleme.”
Deși Szostak a efectuat unele cercetări practice și aplicate în cariera sa – una dintre companiile pe care le-a lansat, Ra Pharma, a descoperit un medicament pentru boala miastenia gravis, care urmează să înceapă testele clinice de fază III – el este cel mai pasionat de știința fundamentală.
„Acesta este un moment interesant pentru a intra în neuroștiință, deoarece acum pot fi abordate probleme la care nici măcar nu te puteai gândi acum 30 de ani.”
„După părerea mea, există trei mari întrebări științifice fundamentale care sunt super interesante: originea vieții, originea universului și originea minții sau a conștiinței”, oferă el, stând în biroul său liniștit, aproape gol, din laboratorul Mallinckrodt de pe Oxford Street din Cambridge. (Biroul este pentru întâlniri ocazionale; Szostak lucrează în principal în laboratorul său de la MGH). După originea vieții, originea minții îl interesează cel mai mult. În anii 1980, când plănuia ce să facă după cercetările sale asupra telomerilor, a avut în vedere trecerea la studiul neuroștiințelor și chiar a participat la seminariile de la Harvard pe această temă. „A fost fascinant, dar și deprimant, pentru că tehnologia era atât de primitivă”, își amintește el. De atunci, el a urmărit cu interes evoluția instrumentelor din domeniu. „Este un moment interesant pentru tineri să se îndrepte spre neuroștiințe, deoarece, cu toată noua tehnologie, există probleme care pot fi abordate acum și la care nici măcar nu te puteai gândi acum 30 de ani”, spune el. „Cu toate acestea, problema generală este încă atât de mare și oarecum descurajantă. Din punctul meu de vedere, lucrez la cea mai ușoară dintre aceste probleme mari.” Deoarece întrebările despre originile vieții se potrivesc bine cu tehnologiile actuale de cercetare, adaugă el, el crede că este „o problemă care poate fi rezolvată.”
Model de protocelule și ARN „dezordonat”
Echipa lui Szostak a realizat protocelule model încă de la începutul anilor 2000, căutând să își dea seama cum s-ar fi putut asambla și evolua inițial. Aceste structuri primitive erau „extrem de simple” în comparație cu cea mai simplă bacterie unicelulară de pe Pământ de astăzi, explică el. Probabil că protocelulele includeau o membrană grasă minimă și, inițial, doar o singură genă care conferea un anumit avantaj celulei. Bacteriile moderne, în schimb, „au cel puțin sute și, de obicei, mii de gene.”
În ciuda unor teorii conform cărora viața timpurie a apărut în apropierea gurilor hidrotermale din adâncurile oceanului, Szostak este mai convins de cercetările care arată că primele celule s-au dezvoltat pe uscat, în iazuri sau bălți, posibil în regiuni cu activitate vulcanică. Lumina ultravioletă și fulgerele ar fi putut ajuta la transformarea moleculelor din atmosferă în cianură și alte materiale utile pentru a genera elementele constitutive ale vieții. Apa puțin adâncă ar fi oferit acestor materiale un loc în care să se acumuleze în concentrații mari, iar activitatea vulcanică ar putea crea fluctuații de temperatură caldă și rece utile pentru anumite reacții chimice.
O istorie a Pământului și a începuturilor vieții
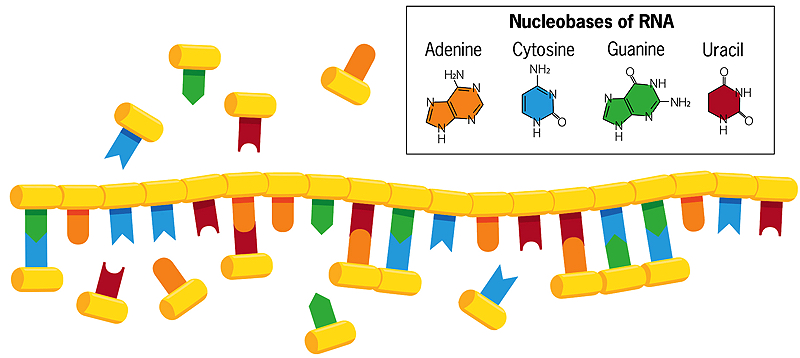
În comparație cu ADN-ul bicatenar, în care bazele citozină și timină se împerechează cu guanina și adenina de pe filamentul opus, bazele unui singur filament elicoidal de ARN din apă pot forma asociații cu nucleobaze care plutesc liber (prezentate în imaginea de mai sus). Dacă aceste baze care plutesc liber fuzionează apoi între ele, se creează o nouă copie în oglindă a șirului de ARN, care se separă de cea originală atunci când apa este încălzită. Atunci când acest nou șir se replică la rândul său, creează o copie în oglindă a lui însuși care se potrivește cu șirul original de ARN. Uneori apar erori în acest proces de copiere, iar greșelile benefice se perpetuează. Fiecare lanț, acționând ca un șablon pentru propria replicare, evoluează astfel și interacționează cu mediul său.
Câțiva oameni de știință, inclusiv Gerald Joyce, sugerează că viața ar fi putut începe în afara celulelor, cu moleculele care plutesc liber întâlnindu-se unele cu altele și formând legături care le-ar fi permis să acționeze ca și viața. Dar Szostak susține că membrana celulară a fost necesară, în parte pentru că ar fi ținut împreună moleculele genetice benefice și ar fi împiedicat ca metaboliții utili produși de ribozimele codificate genetic să plutească în apa din jur sau să fie agățați de alte protocelule care trec.
Experimentele din laboratorul său au arătat cum o astfel de membrană ar putea crește și se poate diviza. Cercetătorii au combinat acizi grași precum acidul oleic cu apă și un tampon (pentru a menține stabil pH-ul soluției) și apoi au agitat soluția. Când au fost privite la microscop, ingredientele s-au asamblat în vezicule: structuri circulare, pline de lichid, cu membrane bistratificate. Adăugarea de acizi grași suplimentari în mediul înconjurător – pentru a servi drept nutrienți – a făcut ca veziculele să crească filamente lungi, asemănătoare unor fire de păr, atât de fragile încât chiar și o ușoară adiere de aer pe lama microscopului le-a făcut să se rupă în bucăți. Echipa lui Szostak a obținut rezultate similare cu diferite molecule formatoare de membrană și în medii diferite, sugerând că aceasta este o modalitate plauzibilă pentru ca membrana unei protocelule să crească și apoi să se dividă. Dar cum ar putea această structură să transmită materialul genetic benefic către următoarea generație de celule fiice? „Materialul genetic este cel care pare, de fapt, o problemă mult mai dificilă”, spune el.
Pentru a împărtăși trăsăturile moștenite cu generațiile succesive, celulele de astăzi se bazează pe ADN – molecula cu dublă spirală compusă din bazele nucleice adenină, citozină, guanină și timină – pentru a stoca și transmite informații genetice. Dar replicarea ADN-ului în celule necesită atât molecula monocatenară ARN, cât și enzime proteice, iar proteinele codificate genetic sunt mult prea complexe pentru a se fi format spontan pe Pământul timpuriu. Deoarece ARN-ul poate atât să stocheze și să transmită informații genetice (ca ADN-ul), cât și să catalizeze reacții chimice (ca enzimele proteice), mulți cercetători cred că celulele primitive au folosit molecule de ARN pentru a îndeplini atât roluri genetice, cât și enzimatice.
La sfârșitul anilor 1960, omul de știință britanic Leslie Orgel a propus că ARN-ul, sau ceva asemănător, ar fi putut fi prima moleculă de pe Pământ care s-a replicat și a evoluat; aceasta a devenit cunoscută sub numele de ipoteza „Lumea ARN-ului”. Orgel și alții au lucrat timp de zeci de ani pentru a înțelege modul în care lanțurile de ARN ar fi putut să se unească și să se reproducă, dar eforturile lor nu au avut un succes deplin. „Au existat multe progrese la început, iar apoi s-au împotmolit pur și simplu, deoarece existau o duzină de probleme diferite și, la acea vreme, nu exista un răspuns evident la niciuna dintre ele”, explică Szostak. „Cam toată lumea a devenit frustrată și s-a gândit: „Poate că viața nu a început cu ARN. Poate că există ceva mai simplu, mai ușor de fabricat, mai ușor de replicat.””
„Știm mult mai multe acum și, doar prin descompunerea lucrurilor în probleme individuale, mai mici, am reușit să rezolvăm unele dintre ele.”
Cercetătorii au căutat alternative la ARN, „iar acest lucru a dus la 10-20 de ani de chimie cu adevărat interesantă, ajungând la o mulțime de molecule interesante”, notează Szostak. „Dar, până acum, nu a apărut nimic mai simplu sau mai bun decât ARN-ul care să funcționeze cu adevărat”. Unii cercetători susțin o ipoteză „metabolism-first”, sugerând că viața ar fi putut începe fără material genetic, printr-o serie de reacții care se întrețin singure, dar Szostak și alții rămân neconvinși. În urmă cu aproximativ șapte ani, a început să revadă obstacolele cu care Orgel și contemporanii săi s-au confruntat în înțelegerea sintezei ARN. „Știm mult mai multe acum”, explică el, „și doar prin descompunerea lucrurilor în probleme individuale, mai mici, am reușit să rezolvăm unele dintre ele.”
Laboratorul lui Szostak se concentrează acum aproape în întregime pe modul în care ARN-ul primordial s-ar fi putut copia singur. ARN-ul modern se unește în moduri foarte regulate și previzibile, cu blocuri de nucleotide care se înlănțuie ca un lanț. Fiecare bloc conține un zahăr (riboză), un fosfat și una dintre cele patru nucleobaze (numite și baze azotate) -adenină, citozină, guanină și uracil (denumite de obicei A, C, G și U). Unitățile de riboză-fosfat sunt unite între ele pentru a forma „coloana vertebrală” a ARN-ului. În celulele moderne, enzimele proteice catalizează reacția care unește unitățile de nucleotide în lanțuri de ARN.
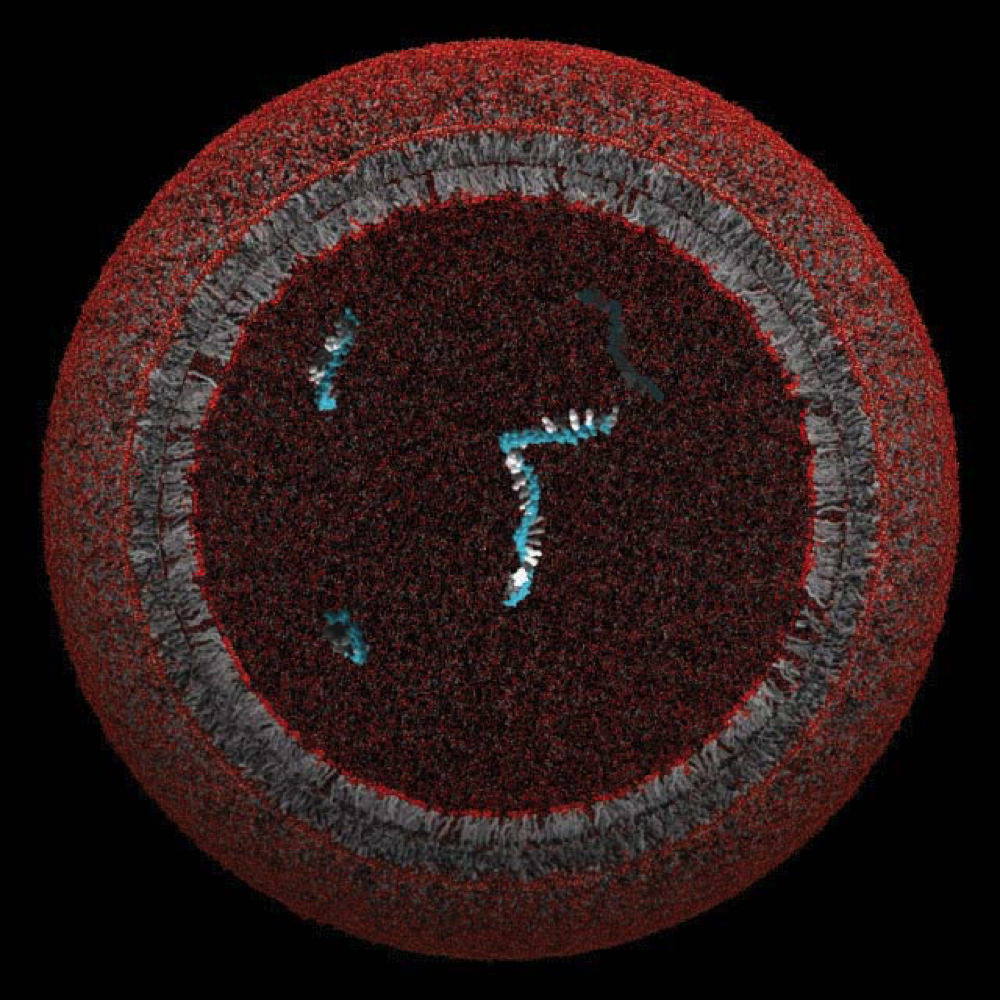
Un model de protocelulă, a cărei membrană lipidică ar fi putut să închidă și să protejeze o singură genă
Imagine obținută prin amabilitatea Laboratorului Szostak
În protocelulele de pe Pământul timpuriu, lanțul de ARN ar fi servit drept șablon pe care un nou lanț complementar de nucleotide s-a asamblat înainte de a se desprinde pentru a deveni un șablon suplimentar pe care alte nucleotide care pluteau liber puteau să se îmbine. Dar, spre deosebire de ARN-ul modern previzibil, ARN-ul timpuriu nu a beneficiat de proteine care să catalizeze procesul de construcție. (Deoarece proteinele nu se pot forma fără mașinăria celulară complexă și foarte evoluată necesară pentru sinteza lor, majoritatea cercetătorilor cred că era puțin probabil ca acestea să existe pe Pământul primordial). Prin urmare, ARN-ul timpuriu era probabil mai dezordonat, cu mult mai multe variații în coloana vertebrală de zahăr și în baze, spune Szostak. Echipa sa experimentează în prezent „pentru a avea o idee despre ce variabilitate ar fi tolerată și ce ar fi eliminată”. Modelul nostru actual este că începeți cu ceva care este dezordonat și are o mulțime de variații diferite în el și, de-a lungul ciclurilor de replicare, ajungeți la ceva care este mai aproape de ARN-ul omogen modern.”
O lucrare din 2018 a lui Szostak și a studentului absolvent Seohyun Kim ilustrează posibila variabilitate a ARN-ului timpuriu și a blocurilor sale de bază A, C, G și U. Oamenii de știință au făcut progrese în înțelegerea modului în care C și U ar fi putut fi generate prin reacții chimice prebiotice, dar s-au luptat cu A și G. Szostak și Kim sugerează că ARN ar fi putut începe cu diferite nucleobaze, iar experimentele lor au arătat că nucleozida inozină, care poate fi produsă din A (adenină), funcționează eficient în locul lui G (guanosină). „Acest lucru simplifică problema generală”, explică Szostak. „Acum trebuie doar să știm cum să facem A.”
Alte experimente recente din laborator s-au concentrat asupra ionilor metalici necesari pentru a declanșa procesul de copiere a ARN-ului. Cercetătorii folosesc de obicei magneziu, „dar trebuie să îl folosim la concentrații foarte mari”, ceea ce are efecte secundare negative, declanșând degradarea ARN-ului sau distrugerea membranei celulare. „Să sperăm că vom găsi o modalitate simplă și plauzibilă de a face ca totul să funcționeze cu mai puțin magneziu, sau poate că va trebui să regândim întreaga problemă și să o abordăm dintr-o altă direcție”, explică Szostak. „Noi doar ne pipăim în întuneric, încercând să vedem unde ar putea exista o cale spre o soluție.”

Încălzirea și răcirea atribuibile vulcanismului, ca la Marele Izvor Prismatic din Yellowstone, ar fi facilitat evoluția timpurie a ARN-ului.
Fotografie de Istock Images
Câteva dintre căi nu funcționează și chiar produc erori. În 2016, laboratorul lui Szostak a publicat o lucrare în Nature Chemistry care a arătat că o peptidă ar fi putut ajuta ARN-ul să se reproducă fără enzime. La scurt timp după aceea, colegul de cercetare Tivoli Olsen s-a alăturat laboratorului și nu a putut reproduce aceste rezultate. Revizuirea de către aceasta a lucrării a arătat că echipa a interpretat greșit datele, iar Szostak a retras lucrarea. „Lucrăm la probleme dificile, iar cel mai greu lucru în știință, așa cum cred că a spus Feynman, este să nu te păcălești singur”, spune Szostak. Soluția potențială era incitantă, „și cred că ne-a orbit la ceea ce se întâmpla”. „Harul salvator”, adaugă el, este faptul că au descoperit singuri erorile, deși și-ar fi dorit ca acest lucru să se fi întâmplat „înainte ca lucrarea să fie publicată, în loc de după”. Aș spune că multe dintre ideile noastre sfârșesc prin a fi greșite, dar, de obicei, ne dăm seama de asta destul de repede.”
Este optimist în ceea ce privește potențialul descoperirilor recente din alte laboratoare; de exemplu, John Sutherland de la Laboratorul de Biologie Moleculară al Consiliului de Cercetare Medicală (MRC) din Cambridge, Anglia, a descoperit recent o nouă tehnică de activare a nucleotidelor – modificarea chimică a acestor elemente constitutive pentru a alimenta procesul de replicare. Sutherland a împărtășit aceste descoperiri cu laboratorul lui Szostak înainte ca ele să fie publicate, iar Szostak spune că aceștia explorează modalități de a încorpora această tehnică în propriile experimente.
După ce echipa sa asamblează protocelule funcționale care conțin bucăți de ARN, se așteaptă ca informațiile din unele secvențe specifice de ARN să confere un anumit beneficiu protocelulei care o înconjoară. De exemplu, lucrările anterioare sugerează că unele secvențe de ARN s-ar putea plia pentru a deveni o ribozomă care ar putea produce lipide ușor mai avansate pentru membrana celulară. „Orice secvență de ARN care face ceva care își ajută propriile celule să supraviețuiască sau să se reproducă mai repede va începe să preia controlul asupra populației”, explică Szostak. „Acesta este începutul evoluției darwiniste. Și apoi ne întoarcem din nou la a fi biologi.”
După ce a câștigat Premiul Nobel, Szostak ar fi putut părăsi laboratorul pentru a se dedica călătoriilor și invitațiilor la conferințe, dar „El rămâne concentrat pe știință”, spune Gerald Joyce. „Asta este ceea ce admir cel mai mult la el”. Unii ar putea vedea cercetarea fundamentală ca pe un lux intelectual, dar cei care o practică susțin că toată știința aplicată începe cu descoperirile științei fundamentale. „Când Crick și Watson s-au așezat și au început să facă modele de carton ale structurii ADN-ului, nu aveau nicio idee că aceasta va da naștere unei industrii care valorează miliarde de dolari 70 de ani mai târziu”, notează John Sutherland.
Szostak rămâne angajat să se ocupe de aceste întrebări mari și provocatoare, continuând munca de zeci de ani. „Sper să reușesc să construiesc un sistem celular evolutiv înainte de a mă pensiona”, spune el. El este optimist în ceea ce privește șansele sale. „Cred că suntem pe cale să ajungem acolo. Mai sunt câteva probleme dificile și apoi cred că totul va fi, sper, rezolvat în câțiva ani.”