Fibrilația atrială (FA) este cea mai frecventă tahiaritmie susținută, apărând la 1% până la 2% din populația generală. Izolarea venei pulmonare (PVI) este pilonul principal al ablației FA.1 Deși această procedură este eficientă în prevenirea recurenței aritmiei la pacienții cu FA paroxistică, dacă este efectuată singură, are doar un succes limitat în FA persistentă.1,2 Datele inițiale au sugerat că recurența aritmiei ar putea fi diminuată prin ablația liniei suplimentare sau prin ablația complexă fracționată a electrogramelor atriale. Cu toate acestea, beneficiul ablației suplimentare dincolo de PVI nu a fost confirmat de rezultatele recente ale metaanalizelor3 și ale studiilor controlate randomizate,4 subliniind importanța unei PVI durabile, chiar și în FA persistentă.
În ultimii ani, ablația cu criobalon a devenit o abordare alternativă viabilă la ablația cu radiofrecvență (RF) și s-a dovedit a fi cel puțin la fel de eficientă ca și PVI la pacienții cu FA paroxistică. Rezultatele recente ale studiului FIRE & ICE au tranșat definitiv dezbaterea în acest domeniu.5 În plus, datorită simplității relative, curbei de învățare mai rapide -și poate chiar mai important- reproductibilității remarcabile6 a acestei proceduri, ea a fost adoptată pe scară largă în practica clinică.6
Pe de altă parte, tratamentul intervențional al FA persistente rămâne o provocare: această abordare nu a fost standardizată sau perfecționată și există loc pentru inovare. În acest context, problema unui posibil rol al crioablației este interesantă.
EVIDENȚE CLINICE
Deși există un interes crescând pentru eficacitatea ablației FA la pacienții cu FA persistentă, datele de urmărire după utilizarea noului cateter cu criobalon de a doua generație de 28 mm (Arctic Front Advance, Medtronic Inc., Minneapolis, MN) sunt încă limitate. Până în prezent, rezultatele ablației post-criobalon în FA persistentă au fost evaluate indirect prin meta-analize, comparații non-randomizate7 și studii observaționale.8-10
Ciconte et al.9 au raportat că 60% dintre pacienții cu FA persistentă au fost liberi de tahiaritmii atriale după tratamentul cu noul cateter cu criobalon. Durata FA persistentă, care a fost un predictor independent al recurenței aritmiei în timpul urmăririi, oferă un sprijin clar pentru ablația în stadii mai timpurii ale bolii.
Într-un studiu retrospectiv efectuat pe 48 de pacienți cu FA persistentă, rata de succes clinic la 1 an a fost de 69%.10
Un alt studiu cu un singur braț a evaluat eficacitatea crioablației de a doua generație la un grup de 100 de pacienți cu FA persistentă ca procedură index (durată medie de 5,5 ± 3,7 luni).8 După o urmărire medie de 10,6 ± 6,3 luni, nu au existat recurențe ale tahiaritmiei atriale la 67% dintre pacienți, după o perioadă de ștergere de 3 luni. Singurul predictor independent semnificativ al recurenței a fost apariția tahiaritmiei atriale în timpul perioadei de blanking.
Un studiu monocentric, neprospectiv, nerandomizat, a evaluat, de asemenea, RF în comparație cu crioablația doar la pacienții cu FA persistentă.7 În acel studiu, rezultatul procedural al ablației prin RF (utilizând un cateter de ablație cu forță de contact) în comparație cu crioablația (utilizând criobalonul de a doua generație de 28 mm) a fost evaluat într-o cohortă de 100 de pacienți cu FA persistentă refractară la medicamente (duratele medii ale FA au fost de 7,2 și, respectiv, 7,6 luni, în grupurile de ablație prin RF și crioablație). Atât timpul de procedură, cât și cel de fluoroscopie au fost semnificativ mai scurte în grupul de crioablație, dar rata pacienților fără aritmii atriale a fost similară între cele 2 grupuri după 12 luni de urmărire (60% în grupul de crioablație față de 56% în grupul de ablație RF, P = 0,71). În urma analizei multivariate, s-a constatat din nou că singurii predictori independenți ai eșecului au fost durata FA persistentă și recidivele în timpul perioadei de blanking.
În cele din urmă, un studiu prospectiv, multicentric, nerandomizat, a comparat rezultatele după o singură procedură de ablație, utilizând ablația cu criobaloane de primă generație doar pentru IVP vs. ablația cu RF deschisă, printr-o abordare în trepte, într-o cohortă de pacienți cu FA persistentă, potriviți în funcție de propensiune.11 Rezultatele, care au arătat o libertate de aproximativ 55 % față de aritmiile atriale în timpul unei urmăriri medii de 15,6 ± 11,5 luni după o singură ablație, atât cu criobalonul, cât și cu RF, au fost similare cu datele disponibile. Mai multe constatări au fost demne de remarcat:
- –
În primul rând, rezultatele clinice au fost similare în cele 2 brațe de tratament, chiar dacă grupul RF a fost supus unei ablații suplimentare și mai extinse dincolo de PVI.
- –
În al doilea rând, rata complicațiilor a fost similară cu cele 2 tehnici.
- –
În al treilea rând, durata procedurii a fost mai scurtă cu crioablația.
Există încă incertitudini cu privire la fiziopatologia și strategia optimă pentru ablația fibrilației atonice persistente și, prin urmare, pilonul principal al acestei terapii rămâne obținerea unei PVI durabile.4 Pentru a realiza acest lucru, crioablația pare a fi o abordare terapeutică alternativă valabilă la RF. Efectuarea unei ablații suplimentare pe lângă PVI este asociată cu un timp procedural mai lung.4 Deoarece abordarea ablației RF nu a fost standardizată (majoritatea pacienților din brațul RF au dezvoltat leziuni suplimentare), nu este clar dacă rezultatele se datorează sursei de energie sau strategiei de ablație. Mai mult, rezultatele pe termen mediu nu par să fie îmbunătățite semnificativ prin leziuni biatriale suplimentare dincolo de PVI la pacienții cu FA persistentă.4
SHOOTING AT THE RIGHT TARGET?
Rămân de elucidat motivele pentru lipsa unui beneficiu sporit în urma ablației suplimentare. Una dintre posibilități este potențialul iatrogen al unei abordări de substrat cu o ablație mai extinsă, care poate favoriza dezvoltarea de noi zone de aritmogeneză din cauza țesutului incomplet ablaționat sau a liniilor incomplete de bloc de conducere. O altă posibilitate este aceea că zona vinovată nu este identificată în mod obișnuit și nici electrogramele atriale complexe fracționate, nici leziunile liniare nu reprezintă ținte complementare optime pentru ablație.12 În această ipoteză, rămâne necesitatea de a localiza cu precizie ochiul furtunii (prin direcționarea rotorilor sau a ganglionilor),13 eventual prin utilizarea unor algoritmi de cartografiere mai noi. Datele disponibile oferă, de asemenea, sprijin pentru rolul duratei FA și, în consecință, al remodelării electrice a FA (FA generează FA), deoarece numai durata FA a fost un predictor independent al recurenței aritmiei în comparația propensity-score,11 așa cum au raportat anterior Tilz et al.2
Diverse studii în curs de desfășurare vor contribui la elucidarea siguranței și eficacității crioablației la pacienții cu FA persistentă. Studiul Cryoballoon Ablation for Early Persistent Atrial Fibrillation (Cryo4 Persistent AF – NCT02213731) este un studiu pilot european multicentric, prospectiv, cu un singur braț, care vizează evaluarea ratei de succes a PVI numai prin crioablație la 1 an la pacienții care prezintă un istoric de FA persistentă mai mic de 12 luni. Acest studiu se află încă în faza de recrutare, iar primele rezultate sunt așteptate până la sfârșitul anului 2017. Următorul obiectiv va fi compararea rezultatelor în cadrul unui studiu randomizat între abordarea treptată RF și crioablația PVI într-un grup omogen de pacienți cu FA persistentă. Rezultatele acestui studiu randomizat pe scară largă sunt așteptate cu nerăbdare.
Potriviri și limitări
La pacienții cu FA persistentă, chiar și cele mai mari diametre maxime ale PV (între 20 mm și 23 mm) sunt substanțial mai mici decât valoarea critică de 28 mm (diametrul maxim al criobalonului utilizat în practica clinică de rutină).14 Din cauza acestei nepotriviri între diametrele balonului și PV, atunci când acest dispozitiv este poziționat împotriva antrului PV, partea sa de răcire este în contact atât cu antrul PV, cât și cu țesutul atrial adiacent, ceea ce pare a fi un beneficiu important al acestei proceduri. Kenigsberg și colab,15 au calculat suprafața țesutului cardiac ablaționat după crioablația PV prin cartografierea electroanatomică tridimensională a tensiunii din atriul stâng după crioablație. Folosind această metodă, acești autori au demonstrat frumos că, după crioablația cu dispozitivul criobalon de 28 mm, procentul suprafeței peretelui posterior al atriului stâng care a rămas intact din punct de vedere electric a fost de numai 27%.
De remarcat că, deși criobalonul țintește în mod conceptual numai PV, acesta realizează, de asemenea, un debulking electric substanțial al peretelui posterior al atriului stâng (figura). Prin extinderea circumferinței zonei de răcire, acest dispozitiv poate conferi un beneficiu colateral prin ablația contribuitorilor locali la structurile care contribuie la declanșarea și menținerea FA, cum ar fi plexurile și rotoarele ganglionare, ceea ce poate avea implicații terapeutice majore pentru pacienții cu FA persistentă.13 Această caracteristică ar putea explica, de asemenea, cel puțin parțial, rezultatele studiilor menționate mai sus.
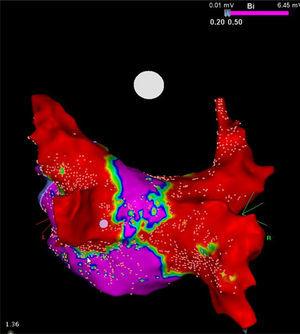
Hartă de tensiune de înaltă densitate a peretelui posterior după o procedură de crioablație la un pacient cu fibrilație atrială persistentă. Observați coridorul îngust (violet) rămas între cele două cicatrici mari (roșu) obținute cu criobalonul Artic Front Advance de 28 mm (Medtronic, Minneapolis, MN, Statele Unite). Prin amabilitatea Prof. Mario Oliveira, Spitalul Santa Marta, Lisabona, Portugalia.
Deși ratele de succes ale criobalonului sunt comparabile cu cele ale radiofrecvenței în studiile non-randomizate ale pacienților cu FA persistentă, rata relativ ridicată de recurență a aritmiei în ambele grupuri rămâne neexplicată și ar putea să nu fie atribuită doar recuperării conducției PV-urilor. Această posibilitate a fost menționată în studiile care ridică îngrijorări cu privire la rolul surselor non-PVI care furnizează mecanismul de recidivă.9
În FA persistentă, tratamentul invaziv rămâne o provocare din cauza fiziopatologiei sale diverse. Sunt necesare noi cunoștințe mecaniciste pentru a permite o abordare individualizată a FA persistentă, dar, până când astfel de cunoștințe vor fi disponibile, PVI de sine stătătoare de primă intenție poate fi suficientă, cel puțin pentru pacienții cu FA persistentă mai puțin severă. Pe baza acestei abordări „mai puțin înseamnă mai mult”, PVI cu criobalon se poate dovedi a fi o strategie de ablație adecvată în FA persistentă, permițând PVI fiabilă cu debulking adjuvant al miocardului atrial vecin. Modificarea suplimentară a substratului nu pare să aducă un beneficiu suplimentar. Această procedură „minimalistă” este o primă opțiune acceptabilă la pacienții care prezintă un istoric relativ recent de FA persistentă simptomatică, adică cu „mai mult declanșator decât substrat” (sau cu un substrat concentrat în jurul ostiei PVs…). Într-adevăr, criobalonul mare (28 mm) de a doua generație oferă rezultate similare cu cele ale unor proceduri mai complexe care utilizează energie RF și metode sofisticate. De remarcat, curba de învățare, reproductibilitatea și siguranța par a fi în favoarea dispozitivului criobalon în mâinile mai puțin experimentate. În acest context și în subgrupul de pacienți menționat mai sus, PVI cu criobalonul mare de a doua generație pare a fi o abordare inițială rezonabilă, oferind o îmbunătățire semnificativă pentru mai mult de jumătate dintre candidați. Pentru pacienții cu recurențe de FA, această primă procedură nu va fi inutilă. Într-adevăr, într-o cantitate considerabilă de substrat (care înconjoară antra PV dreapta și stânga) care a fost deja tratată, cea de-a doua procedură, prin RF de această dată, se va concentra în principal pe focare extra-PVs, potențiale fragmentate, circuite micro sau macroreentrante etc.
În opinia noastră, această strategie în 2 etape este compatibilă cu desfășurarea centrelor de volum mic și mediu care se concentrează în principal pe PVI și care lucrează mână în mână cu centrele de referință terțiare care efectuează procedurile mai complexe. Acestea din urmă vor trebui să se ocupe de cei aproximativ 40% de pacienți care au recidive după prima „crio-debulsificare”.
„Mai puțin înseamnă mai mult”, dar totuși, nu este suficient…
CONFLICTE DE INTERES
S. Boveda primește onorarii de consultanță de la Medtronic, Boston Scientific și Livanova.
.