- Tabel de geometrii
- Obiective de învățare
- Învățăminte cheie
- Puncte cheie
- Termeni cheie
- Modelul VSEPR
- Geometrii moleculare
- Cum se determină geometria moleculară – YouTube: Acest videoclip descrie o metodă pentru găsirea rapidă a principalelor forme geometrice pentru moleculele simple.
- Geometrii moleculare
- Obiective de învățare
- Învățăminte cheie
- Cele mai importante
- Termeni cheie
- Metoda AXE
- Geometrii principale (fără perechi de electroni solitari):
- Planar trigonal
- Tetraedral
- Octaedral
- Interactiv: Geometrie electronică: Moleculele iau forme diferite datorită modelelor de electroni partajați și nepartajați. În aceste exemple, toți electronii care afectează forma moleculelor sunt partajați în legăturile covalente care țin atomii împreună pentru a forma moleculele.
- P perechi de electroni singuri
- Obiective de învățare
- SURSELE PRINCIPALE
- Cele mai importante
- Termeni cheie
- Geometrii moleculare cu perechi de electroni solitari
- Numărul de coordinare și atomul central
- Efectul de respingere al electronilor perechii singuratice
- Interactiv: Electroni neîmpărtășiți și forma „îndoită”: Utilizați modelul 3D pentru a vedea cum electronii neîmpărtășiți îi resping pe cei care sunt împărtășiți în legăturile dintre hidrogen și oxigen, ceea ce face ca molecula să aibă o formă „curbată”.
- LICENȚE ȘI ATRIBUȚII
- CONȚINUT SUB LICENȚĂ DE LICENȚĂ DE C.C., PARTAJATĂ ANTERIORMENTE
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabel de geometrii
Teoria VSEPR detronează geometrii moleculare (liniară, trigonală, trigonală bipiramidală, tetraedrică și octaedrică).
Obiective de învățare
Aplicați modelul VSEPR pentru a determina geometria unei molecule care nu conține perechi de electroni solitari pe atomul central.
Învățăminte cheie
Puncte cheie
- Fundamental, modelul VSEPR teoretizează că regiunile cu sarcină electrică negativă se vor respinge reciproc, determinând ca acestea (și legăturile chimice pe care le formează) să rămână cât mai departe posibil.
- Geometriile moleculare iau în considerare numărul de atomi și numărul de electroni cu perechi singuratice.
- Principalele geometrii fără electroni de pereche solitară sunt: liniară, trigonală, tetraedrică, trigonală bipiramidală și octaedrică.
Termeni cheie
- Teoria VSEPR: un model de chimie utilizat pentru a prezice forma moleculelor individuale pe baza repulsiei electrostatice a perechilor de electroni
Modelul VSEPR
Modelul de repulsie a perechilor de electroni din învelișul de valență (VSEPR) se concentrează pe perechile de electroni de legătură și de nelegare prezente în învelișul cel mai exterior (de valență) al unui atom care se conectează cu alți doi sau mai mulți atomi.
Fundamental, modelul VSEPR teoretizează că aceste regiuni de sarcină electrică negativă se vor respinge reciproc, determinându-le (și legăturile chimice pe care le formează) să rămână cât mai departe posibil. Prin urmare, cei doi nori de electroni conținuți într-o moleculă triatomică simplă ![]() se vor extinde în direcții opuse. O separare unghiulară de 180° plasează cei doi orbitali de legătură cât mai departe unul de celălalt; prin urmare, ne așteptăm ca cele două legături chimice să se extindă în direcții opuse, producând o moleculă liniară.
se vor extinde în direcții opuse. O separare unghiulară de 180° plasează cei doi orbitali de legătură cât mai departe unul de celălalt; prin urmare, ne așteptăm ca cele două legături chimice să se extindă în direcții opuse, producând o moleculă liniară.

 . Cei doi atomi X (în alb) sunt la o distanță de 180° unul față de celălalt.
. Cei doi atomi X (în alb) sunt la o distanță de 180° unul față de celălalt. Dacă atomul central conține, de asemenea, una sau mai multe perechi de electroni nelegate, aceste regiuni suplimentare de sarcină negativă se vor comporta la fel ca cele asociate cu atomii legați. Orbitalii care conțin diferitele perechi de electroni de legătură și de nelegătură din învelișul de valență se vor extinde dinspre atomul central în direcții care minimizează respingerile lor reciproce. Dacă atomul central posedă orbitali d parțial ocupați, acesta poate fi capabil să găzduiască cinci sau șase perechi de electroni, formând ceea ce se numește uneori un „octet extins.”
Geometrii moleculare
Geometrii moleculare (liniară, trigonală, tetraedrică, trigonală bipiramidală și octaedrică) sunt determinate de teoria VSEPR. Un tabel al geometriilor care utilizează teoria VSEPR poate facilita desenarea și înțelegerea moleculelor. Tabelul geometriilor moleculare poate fi găsit în prima figură. A doua figură servește ca ajutor vizual pentru tabel.


Cum se determină geometria moleculară – YouTube: Acest videoclip descrie o metodă pentru găsirea rapidă a principalelor forme geometrice pentru moleculele simple.
Geometrii moleculare
Teoria VSEPR descrie cinci forme principale ale moleculelor simple: liniară, plană trigonală, tetraedrică, bipiramidală trigonală și octaedrică.
Obiective de învățare
Aplicați modelul VSEPR pentru a determina geometria moleculelor în care atomul central conține una sau mai multe perechi de electroni solitari.
Învățăminte cheie
Cele mai importante
- Liniară: o moleculă triatomică simplă de tipul
 ; cei doi orbitali de legătură sunt despărțiți la 180°.
; cei doi orbitali de legătură sunt despărțiți la 180°. - Trigonală plană: triunghiulară și într-un singur plan, cu unghiuri de legătură de 120°.
- Tetraedral: patru legături pe un atom central cu unghiuri de legătură de 109,5°.
- Trigonal bipiramidal: cinci atomi în jurul atomului central; trei într-un plan cu unghiuri de legătură de 120° și doi la capetele opuse ale moleculei.
- Octaedral: șase atomi în jurul atomului central, toți cu unghiuri de legătură de 90°.
Termeni cheie
- Teoria VSEPR: modelul VSEPR (Valence Shell Electron Pair Repulsion) este utilizat pentru a prezice forma moleculelor individuale pe baza gradului de repulsie electrostatică a perechilor de electroni
Metoda AXE
O altă modalitate de a analiza geometriile moleculare este prin „metoda AXE” de numărare a electronilor. A în AXE reprezintă atomul central și are întotdeauna un indice implicit unu; X reprezintă numărul de legături sigma între atomii centrali și cei externi (legăturile covalente multiple – duble, triple etc. – contează ca un singur X); iar E reprezintă numărul de perechi de electroni solitari care înconjoară atomul central. Suma dintre X și E, cunoscută sub numele de număr steric, este, de asemenea, asociată cu numărul total de orbitali hibridizați folosiți de teoria legăturilor de valență. VSEPR utilizează numărul steric și distribuția lui X și E pentru a prezice formele geometrice moleculare.

Rețineți că geometriile sunt denumite numai în funcție de pozițiile atomice, nu și de aranjamentul electronic.

Geometrii principale (fără perechi de electroni solitari):
Într-un model liniar, atomii sunt conectați în linie dreaptă, iar un unghi de legătură este pur și simplu unghiul geometric dintre două legături adiacente. O moleculă triatomică simplă de tipul ![]() are cei doi orbitali de legătură la o distanță de 180°. Exemple de molecule triatomice pentru care teoria VSEPR prezice o formă liniară includ
are cei doi orbitali de legătură la o distanță de 180°. Exemple de molecule triatomice pentru care teoria VSEPR prezice o formă liniară includ ![]() (care nu posedă suficienți electroni pentru a se conforma regulii octetului) și
(care nu posedă suficienți electroni pentru a se conforma regulii octetului) și ![]() . Atunci când scrieți formula punctului de electroni pentru dioxidul de carbon, observați că legăturile C-O sunt legături duble; acest lucru nu face nicio diferență pentru teoria VSEPR. Atomul central de carbon este în continuare unit cu alți doi atomi. Norii de electroni care leagă cei doi atomi de oxigen sunt despărțiți la 180°.
. Atunci când scrieți formula punctului de electroni pentru dioxidul de carbon, observați că legăturile C-O sunt legături duble; acest lucru nu face nicio diferență pentru teoria VSEPR. Atomul central de carbon este în continuare unit cu alți doi atomi. Norii de electroni care leagă cei doi atomi de oxigen sunt despărțiți la 180°.

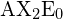 în tabel.
în tabel. Planar trigonal
Moleculele cu forma plană trigonală sunt triunghiulare și se află într-un singur plan, sau suprafață plană. O moleculă ![]() , cum ar fi
, cum ar fi ![]() , are trei regiuni de densitate electronică care se extind de la atomul central. Repulsia dintre acestea va fi minimă atunci când unghiul dintre oricare două este de 120o.
, are trei regiuni de densitate electronică care se extind de la atomul central. Repulsia dintre acestea va fi minimă atunci când unghiul dintre oricare două este de 120o.
Tetraedral
Tetra- înseamnă patru, iar -edral se referă la o față a unui solid; „tetraedral” înseamnă literalmente „având patru fețe”. ” Această formă se întâlnește atunci când există patru legături toate pe un atom central, fără perechi de electroni solitari. În conformitate cu teoria VSEPR, unghiurile de legătură dintre legăturile electronice sunt de 109,5o. Un exemplu de moleculă tetraedrică este metanul ![]() . Cele patru legături echivalente se îndreaptă în patru direcții echivalente geometric în trei dimensiuni, corespunzând celor patru colțuri ale unui tetraedru centrat pe atomul de carbon.
. Cele patru legături echivalente se îndreaptă în patru direcții echivalente geometric în trei dimensiuni, corespunzând celor patru colțuri ale unui tetraedru centrat pe atomul de carbon.

Se formează o formă bipiramidală trigonală atunci când un atom central este înconjurat de cinci atomi într-o moleculă. În această geometrie, trei atomi se află în același plan, cu unghiuri de legătură de 120°; ceilalți doi atomi se află la capetele opuse ale moleculei. Unele elemente din grupa 15 a tabelului periodic formează compuși de tipul ![]() ; exemplele includ
; exemplele includ ![]() și
și ![]() .
.

Octaedral
Octa- înseamnă opt, iar -edral se referă la o față a unui solid, astfel încât „octaedral” înseamnă literalmente „având opt fețe”. Unghiurile de legătură sunt toate de 90° și, așa cum patru perechi de electroni experimentează o repulsie minimă atunci când sunt îndreptate spre colțurile unui tetraedru, șase perechi de electroni încearcă să se îndrepte spre colțurile unui octaedru. Un exemplu de moleculă octaedrică (![]() ) este hexafluorura de sulf (
) este hexafluorura de sulf (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interactiv: Geometrie electronică: Moleculele iau forme diferite datorită modelelor de electroni partajați și nepartajați. În aceste exemple, toți electronii care afectează forma moleculelor sunt partajați în legăturile covalente care țin atomii împreună pentru a forma moleculele.
P perechi de electroni singuri
Electronii nelegate se află în orbitali care ocupă spațiu, resping ceilalți orbitali și schimbă forma unei molecule.
Obiective de învățare
Recunoașteți efectul perechilor de electroni solitari asupra geometriei moleculelor.
SURSELE PRINCIPALE
Cele mai importante
- Orbitalii care conțin diferitele perechi de legătură și nelegare din învelișul de valență se vor extinde dinspre atomul central în direcții care minimizează repulsiile lor.
- Un orbital de nelegare nu are un nucleu atomic la capătul său îndepărtat care să atragă norul de electroni spre el; sarcina dintr-un astfel de orbital va fi, prin urmare, concentrată mai aproape de atomul central.
- Orbitalele de nelegare exercită mai multă repulsie asupra altor orbitali decât orbitalii de legare.
Termeni cheie
- număr de coordonare: în chimie și cristalografie, numărul de vecini ai unui atom central într-o moleculă sau într-un cristal
- pereche singuratică: un set de valență format din doi electroni care există fără legătură sau partajare cu alți atomi
Geometrii moleculare cu perechi de electroni solitari
Până acum, am discutat doar despre geometrii fără perechi de electroni solitari. După cum probabil ați observat în tabelul de geometrii și în metoda AXE, adăugarea de perechi singulare modifică forma moleculei. Am menționat anterior că, dacă atomul central conține și una sau mai multe perechi de electroni nelegate, aceste regiuni suplimentare de sarcină negativă se vor comporta la fel ca cele asociate atomilor legați. Orbitalii care conțin diferitele perechi de electroni de legătură și de nelegătură din învelișul de valență se vor extinde dinspre atomul central în direcții care minimizează respingerile lor reciproce.

Numărul de coordinare și atomul central
Numărul de coordinare se referă la numărul de perechi de electroni care înconjoară un anumit atom, denumit adesea atomul central. Geometriile moleculelor cu perechi singuratice vor fi diferite de cele fără perechi singuratice, deoarece perechea singuratică arată ca un spațiu gol într-o moleculă. Ambele clase de geometrie sunt denumite după formele figurilor geometrice imaginare (în mare parte poligoane solide regulate) care ar fi centrate pe atomul central și ar avea câte o pereche de electroni la fiecare verigă.
În molecula de apă (![]() ), atomul central este
), atomul central este ![]() , iar formula punctului electronic Lewis prezice că vor exista două perechi de electroni nelegate. Prin urmare, atomul de oxigen va fi coordonat tetraedric, ceea ce înseamnă că se află în centrul tetraedrului. Două dintre pozițiile de coordonare sunt ocupate de perechile de electroni comuni care constituie legăturile O-H, iar celelalte două de perechile nelegate. Prin urmare, deși atomul de oxigen este coordonat tetraedric, geometria de legătură (forma) a moleculei
, iar formula punctului electronic Lewis prezice că vor exista două perechi de electroni nelegate. Prin urmare, atomul de oxigen va fi coordonat tetraedric, ceea ce înseamnă că se află în centrul tetraedrului. Două dintre pozițiile de coordonare sunt ocupate de perechile de electroni comuni care constituie legăturile O-H, iar celelalte două de perechile nelegate. Prin urmare, deși atomul de oxigen este coordonat tetraedric, geometria de legătură (forma) a moleculei ![]() este descrisă ca fiind curbată.
este descrisă ca fiind curbată.

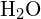 este descrisă ca fiind curbată.
este descrisă ca fiind curbată.Efectul de respingere al electronilor perechii singuratice
Există o diferență importantă între orbitalii electronilor de legătură și cei de nelegătură. Deoarece un orbital de nelegare nu are la capătul său îndepărtat un nucleu atomic care să atragă norul de electroni spre el, sarcina dintr-un astfel de orbital va fi concentrată mai aproape de atomul central; în consecință, orbitalii de nelegare exercită mai multă repulsie asupra altor orbitali decât orbitalii de legare. În ![]() , cei doi orbitali nelegători împing orbitalii de legătură mai aproape unii de alții, făcând ca unghiul H-O-H să fie de 104,5° în loc de unghiul tetraedric de 109,5°.
, cei doi orbitali nelegători împing orbitalii de legătură mai aproape unii de alții, făcând ca unghiul H-O-H să fie de 104,5° în loc de unghiul tetraedric de 109,5°.
Structura electron-dot a ![]() plasează o pereche de electroni nelegători în învelișul de valență al atomului de azot. Acest lucru înseamnă că există trei atomi legați și o pereche solitară pentru un număr de coordonare de patru în jurul azotului, la fel cum se întâmplă în
plasează o pereche de electroni nelegători în învelișul de valență al atomului de azot. Acest lucru înseamnă că există trei atomi legați și o pereche solitară pentru un număr de coordonare de patru în jurul azotului, la fel cum se întâmplă în ![]() .
.

 ..: Perechea solitară atașată la azotul central creează unghiuri de legătură care diferă de cele ale tetraedrului de 109,5 °.
..: Perechea solitară atașată la azotul central creează unghiuri de legătură care diferă de cele ale tetraedrului de 109,5 °.Potem, prin urmare, să prezicem că cei trei atomi de hidrogen se vor afla la colțurile unui tetraedru centrat pe atomul de azot. Orbitalul perechii singuratice va fi îndreptat spre cel de-al patrulea colț al tetraedrului, dar, deoarece această poziție va fi liberă, molecula ![]() însăși nu poate fi tetraedrică; în schimb, ea ia o formă piramidală, mai precis, cea a unei piramide trigonale (o piramidă cu baza triunghiulară). Atomii de hidrogen se află toți în același plan, cu azotul în afara planului. Electronii de nelegătură împing ușor orbitalii de legătură între ei, ceea ce face ca unghiurile de legătură H-N-H să fie de aproximativ 107°.
însăși nu poate fi tetraedrică; în schimb, ea ia o formă piramidală, mai precis, cea a unei piramide trigonale (o piramidă cu baza triunghiulară). Atomii de hidrogen se află toți în același plan, cu azotul în afara planului. Electronii de nelegătură împing ușor orbitalii de legătură între ei, ceea ce face ca unghiurile de legătură H-N-H să fie de aproximativ 107°.
În moleculele cu 5 coordonate care conțin perechi singuratice, acești orbitali de nelegătură (care sunt mai apropiați de atomul central și, prin urmare, este mai probabil să fie respinși de alți orbitali) vor locui preferențial în planul ecuatorial. Acest lucru îi va plasa la unghiuri de 90° față de nu mai mult de doi orbitali de legătură orientați axial. Prin urmare, putem prezice că o moleculă ![]() (una în care atomul central A este coordonat cu alți patru atomi X și cu o pereche de electroni fără legătură), cum ar fi
(una în care atomul central A este coordonat cu alți patru atomi X și cu o pereche de electroni fără legătură), cum ar fi ![]() , va avea o formă de „balansoar”.
, va avea o formă de „balansoar”.

Substituirea perechilor nelegate pentru atomii legați reduce coordonarea bipiramidă triunghiulară la forme moleculare și mai simple.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactiv: Electroni neîmpărtășiți și forma „îndoită”: Utilizați modelul 3D pentru a vedea cum electronii neîmpărtășiți îi resping pe cei care sunt împărtășiți în legăturile dintre hidrogen și oxigen, ceea ce face ca molecula să aibă o formă „curbată”.
LICENȚE ȘI ATRIBUȚII
CONȚINUT SUB LICENȚĂ DE LICENȚĂ DE C.C., PARTAJATĂ ANTERIORMENTE
- Curare și revizuire. Furnizat de: Boundless.com. Licență: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- Teorie VSEPR. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory. Licență: CC BY-SA: Attribution-ShareAlike
- Geometrie moleculară. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licență: CC BY-SA: Attribution-ShareAlike
- Teorie VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licență: CC BY-SA: Attribution-ShareAlike
- Geometrie moleculară. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licență: Public Domain: Nu se cunosc drepturi de autor
- Geometrii VSEPR. Furnizat de: A: Wikimedia. Localizat la: Wikimedia: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licență: CC BY-SA: Attribution-ShareAlike
- Cum se determină geometria moleculară – YouTube. Localizat la: A: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licență: Public Domain: Fără drepturi de autor cunoscute. Termeni de licență: Licență standard YouTube
- Linear-3D-balls. Furnizat de: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licență: CC BY: Atribuire
- Geometrie moleculară. Furnizat de: A: Wikipedia. Localizat la: K: http://en.wikipedia.org/wiki/Molecular_geometry. Licență: CC BY-SA: Attribution-ShareAlike
- Teorie VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory. Licență: CC BY-SA: Attribution-ShareAlike
- Teorie VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licență: CC BY-SA: Attribution-ShareAlike
- Geometrie moleculară. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licență: Public Domain: Nu se cunosc drepturi de autor
- Geometrii VSEPR. Furnizat de: A: Wikimedia. Localizat la: Wikimedia: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licență: CC BY-SA: Attribution-ShareAlike
- Cum se determină geometria moleculară – YouTube. Localizat la: A: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licență: Public Domain: Fără drepturi de autor cunoscute. Termeni de licență: Licență standard YouTube
- Linear-3D-balls. Furnizat de: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licență: CC BY: Atribuire
- Teoria VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licență: Public Domain: Nu se cunosc drepturi de autor
- Teorie VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licență: Public Domain: Niciun drept de autor cunoscut
- număr de coordonare. Furnizat de: Wikționar. Localizat la: Wikipédia: http://en.wiktionary.org/wiki/coordination_number. Licență: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Studii de dezvoltare a conceptelor în chimie. 18 septembrie 2013. Furnizat de: A: OpenStax CNX. Situat la adresa: A.C: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licență: CC BY: Atribuire
- Limitat. Furnizată de: A: Boundless Learning. Situat la adresa: Boundless Learning: http://www.boundless.com//chemistry/definition/lone-pair. Licență: CC BY-SA: Attribution-ShareAlike
- Geometrie moleculară. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/Molecular_geometry. Licență: Public Domain: Nu se cunosc drepturi de autor
- Geometrii VSEPR. Furnizat de: A: Wikimedia. Localizat la: Wikimedia: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licență: CC BY-SA: Attribution-ShareAlike
- Cum se determină geometria moleculară – YouTube. Localizat la: A: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licență: Public Domain: Fără drepturi de autor cunoscute. Termeni de licență: Licență standard YouTube
- Linear-3D-balls. Furnizat de: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licență: CC BY: Atribuire
- Teoria VSEPR. Furnizată de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licență: Public Domain: Nu se cunosc drepturi de autor
- Teorie VSEPR. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licență: Public Domain: Nu se cunosc drepturi de autor
- Teorie VSEPR. Furnizat de: A: Wikipedia. Localizat la: Wikipedia: http://en.wikipedia.org/wiki/VSEPR_Theory. Licență: Public Domain: Niciun drept de autor cunoscut
- Tetrahedral_Structure_of_Water.png. Furnizat de: A: Wikimedia. Localizat la: WATWAT: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licență: Public Domain: Fără drepturi de autor cunoscute
un model de chimie folosit pentru a prezice forma moleculelor individuale pe baza electronilor-repulsie electrostatică a perechilor de electroni
numărul total de atomi care se învecinează direct cu un atom central într-o moleculă sau ion
doi (o pereche de) electroni de valență care nu sunt utilizați pentru a forma o legătură covalentă
.