Interacțiunile dintre creier și procesul de coagulare au o istorie îndelungată, inclusiv observația că mecanismul de coagulare din cadrul sistemului nervos central are o serie de diferențe față de cel întâlnit în alte organe – endoteliul creierului exprimând puțină trombomodulină, de exemplu.
Care ar fi mecanismul, este greu de evitat observația că tratamentul cu anticoagulante (de ex, cu heparină cu greutate moleculară mică) inversează adesea în mod dramatic simptomele, inclusiv migrena, dificultățile de memorie și coreea. Astfel de observații sugerează că, în multe cazuri, patologia cerebrală ar putea să nu fie atât de mult infarct, ci ar putea fi legată mai mult de „nămolirea” alimentării cu sânge și alterarea oxigenării.
Migrenă & Accident vascular cerebral
„Ați suferit de dureri de cap în adolescență?”
„Da, domnule doctor. Au fost aproape săptămânale pentru o perioadă de timp. Au dispărut timp de câțiva ani, dar acum au revenit în forță. Sunt ceva ereditar în familia mea.”
Așa vorbește femeia de 30 de ani, pacientă cu APS (membrii de sex masculin ai familiei apar mai rar în clinicile de APS).
Acesta este un indiciu de diagnostic atât de important în evaluarea unui pacient cu posibil APS. Cu toate acestea, în ciuda multor ani de experiență în domeniul APS, există surprinzător de puține date care să evalueze adevăratul rol al APS în lumea mai largă a migrenei. Există atât de multe motive pentru a studia asocierea – răspunsul la anticoagulare – de obicei bun, adesea izbitor – studiul fraților și al altor membri ai familiei pacienților cu migrenă/APS. Și, mai presus de toate, legăturile care se raportează acum între migrenă și accidentul vascular cerebral.
SAP/Sindromul Hughes este în mare măsură o afecțiune neurologică. Funcția creierului pare să fie vizată în mod special – cu cât mai mulți pacienți cu APS sunt văzuți, cu atât mai & larg se răspândesc undele neuro-psihiatrice.
Ca și migrena, accidentul vascular cerebral este una dintre complicațiile recunoscute ale sindromului APS/Hughes. Au fost raportate cifre de până la 1 din 5 accidente vasculare cerebrale tinere (sub 45 de ani) cu teste aPL pozitive.14-19
Cu toate acestea, ca și în cazul migrenei, recunoașterea aPL în etiologia accidentului vascular cerebral este, în general, încă slabă. De exemplu, accidentul vascular cerebral din copilărie – bine recunoscut din punct de vedere clinic – este o țintă principală pentru studiile aPL.
Cu câțiva ani în urmă, guvernul britanic a lansat o inițiativă majoră privind accidentul vascular cerebral, educând publicul cu privire la simptomele, semnele și tratamentul accidentului vascular cerebral. Sindromul antifosfolipidic nu se afla pe listă.
Convulsii
În 1985, am observat că la pacienții cu lupus, convulsiile erau mai frecvente la acei pacienți cu teste aPL pozitive.20 De atunci, a devenit clar că epilepsia, în toate formele sale, este un acompaniament important al APS. Atât de mult, încât într-un studiu al epilepsiei idiopatice la adolescenți, 1 din 5 s-a dovedit a fi aPL pozitiv.21

Screeningul inițial al moașei sau al obstetricianului ar trebui să includă un chestionar simplu pentru a exclude APS.
Creditul imaginii: SPL/Science Source
Ramnificațiile acestor observații sunt multe. Permiteți-mi să dau două exemple clinice:
În primul rând, epilepsia lobului temporal în APS poate fi subrecunoscută. Unul dintre pacienții mei, o femeie cu APS clasic, a devenit tehnician EEG. În timpul pregătirii sale, ea a folosit patru dintre frații ei pe post de cobai. Trei dintre ei aveau o activitate anormală a lobului temporal. Este interesant de văzut cât de des apare un istoric familial de epilepsie în anamneza pacienților cu APS.
Cea de-a doua anecdotă clinică a fost publicată în altă parte.22 Un pacient de 42 de ani avea în trecut un istoric de lupus ușor. Cu toate acestea, problema sa majoră – și una cu un impact semnificativ asupra vieții sale ocupate – erau crizele recurente, atât petit mal, cât și grand mal, acestea din urmă necesitând îngrijiri de specialitate și combinarea mai multor medicamente antiepileptice. În timpul șederii sale la Londra, a dezvoltat o TVP (s-a constatat că era aPL pozitiv) și a fost începută anticoagularea de rutină cu warfarină. Un bonus imediat și neașteptat a fost o reducere semnificativă a frecvenței și severității crizelor, necesitând un tratament antiepileptic mult mai puțin agresiv.
‘SCANDALUL MORTINATULUI: În fiecare zi, în Marea Britanie se nasc morți până la trei copii care ar fi putut trăi. Una din 200 de nașteri ale femeilor britanice se va naște moartă. Este timpul ca NHS să adapteze noi politici și o nouă atitudine”. -The Times (Londra), 28 noiembrie 2012
Pierderea memoriei
Posibil cea mai comună manifestare a APS este pierderea memoriei. Adesea, problema nu vede lumina zilei decât atunci când pacientul este întrebat despre acest simptom. Atât de mulți pacienți mărturisesc că sunt îngrijorați de Alzheimer. Până în prezent, studiile clinice detaliate sunt puține și foarte rare. Din când în când, și, trebuie spus, într-un mod destul de dezolant, am efectuat teste psihometrice pe pacienți APS selectați – iar rezultatele au fost adesea surprinzătoare. Cu atât mai mult, având în vedere îmbunătățirea izbitoare observată la testele de memorie atunci când se începe anticoagularea.23
Scleroză multiplă
Din cauza proeminenței caracteristicilor neurologice, inclusiv a tulburărilor vizuale și a mielopatiei fluctuante, observate în APS, nu este surprinzător faptul că un număr de cazuri sunt diagnosticate ca fiind SM.24,25
Subiectul este departe de a fi simplu. Unii în neurologie declară că testele aPL pozitive sunt, de fapt, uneori observate în SM clasică. Eu aș prefera să întorc imaginea în sens invers. Astfel de pacienți, cel puțin unii, pot fi mai întâi APS și apoi SM. Deși, din punct de vedere anecdotic, un număr de astfel de cazuri răspund la anticoagulare, la alții răspunsul este, în cel mai bun caz, la limită. Uthman a trecut recent în revistă literatura destul de substanțială privind APS vs. SM.26
Alte caracteristici neurologice
Acestea includ probleme de echilibru (un număr de cazuri care se prezintă ca Meniere), coree (uneori severă),27,28 anosmie, tulburări de somn (inclusiv cataplexie și narcolepsie) și, recent, tulburări autonome cu o serie de cazuri de POTS (sindrom de tahicardie ortostatică posturală).29
Una dintre întrebările asupra căreia există dezbateri este prevalența manifestărilor psihiatrice.
Am fost de părere că psihoza acută a fost mai mult o caracteristică a lupusului decât a APS, dar în acest sens s-ar putea să mă înșel. Unul dintre pacienții mei, o femeie cu APS și TOC (tulburare obsesiv-compulsivă), s-a ameliorat cu tratamentul anticoagulant. În mod interesant, fiul ei adolescent, de asemenea pacient cu TOC (și aPL pozitiv), a constatat că manifestările neuropsihiatrice au fost mult mai puțin proeminente atunci când s-a început tratamentul cu aspirină.
Nu creierul
Oasele & articulațiilor-Ai suferit fracturi? O întrebare care poate nu face parte din anamneza de rutină la pacienții cu APS. Și totuși, fracturile osoase spontane încep să fie bine recunoscute după raportarea a 27 de fracturi spontane de metatarsiene de către Dr. Shirish Sangle la pacienții cu APS.30
Raportările anecdotice sugerează că fracturile osoase (ischemice) pot fi o manifestare importantă a bolii: Colegul meu, profesorul Munther Khamashta, are un pacient cu sindromul Hughes, cu studii DEXA și paratiroidiene normale, care a avut 57 de fracturi spontane. În mod clar, acesta este un domeniu important pentru cercetarea clinică.
La fel, durerea de șold din cauza necrozei avasculare (AVN) nu este neobișnuită la pacienții noștri cu APS. IRM a arătat AVN precoce în unele cazuri fără alți factori de risc, cum ar fi steroizii. Impresia mea clinică este că durerea de șold se ameliorează adesea atunci când se începe administrarea de heparină sau warfarină.
Cuorele – O preocupare majoră este prezența anginei și a altor simptome cardiace în APS. În ciuda câtorva rapoarte timpurii de ischemie miocardică și tromboză coronariană, abia în ultimii ani a crescut frecvența publicațiilor care relevă o frecvență ridicată a acestor complicații.
Două exemple sunt cercetările lui Greco și colab. care arată o prevalență relativ ridicată a testelor aPL pozitive la pacienții cu ischemie cardiacă și observația izbitoare că femeile fumătoare care luau pilule și care erau pozitive la aPL aveau un risc relativ de 22 de ori mai mare de apariție a infarctului miocardic.31,32
Legăturile cardiace sunt sporite de raportarea unei asocieri cu sindromul cardiac X, angina pectorală cu angiografii coronariene normale.33 Este un pariu corect că testarea aPL va deveni un standard în clinica de cardiologie, în special la femeile simptomatice sub 40 de ani.
Ca și migrena, accidentul vascular cerebral este una dintre complicațiile recunoscute ale sindromului APS/Hughes. Au fost raportate cifre de până la 1 din 5 accidente vasculare cerebrale tinere (sub 45 de ani) care au teste aPL pozitive.
Tractul GI & ficat-Din momentul în care am făcut observațiile noastre asupra leziunilor stenotice focale în diverse artere, inclusiv arterele celiace și mezenterice, ne-am concentrat mai mult asupra simptomelor de angină abdominală la pacienții cu aPL/APS.34 Aceasta este o afecțiune dificil de cuantificat, dar am văzut un număr de cazuri la care clopidogrelul sau heparina au dus la o ameliorare (uneori marcată) a durerii postprandiale.
Deși implicarea ficatului în lupus este rară, testele funcției hepatice anormale în APS sunt observate frecvent. Deși acestea pot prezice tromboze hepatice grave, cum ar fi sindromul Budd-Chiari sau sindromul HELLP în sarcină care avertizează asupra APS catastrofale iminente, mai frecvent, au un prognostic mai benign.35,36
Un caz istoric foarte pozitiv: La începutul anilor 1980, am văzut o adolescentă cu TVP, aPL pozitiv și sindrom Budd-Chiari.
Pronostic slab?
La peste 30 de ani distanță, ea se simte bine – sub tratament atent cu warfarină pe tot parcursul vieții, gestionat de medicii ei din Portugalia.
Boala lui Goldblatt, rinichiul & APS- Stenoza arterelor renale, observată pe un fond clar de artere altfel normale, poate mima observațiile timpurii ale lui Goldblatt privind dezvoltarea hipertensiunii arteriale la animale cu artere renale ocluzate experimental. Descoperirea leziunilor localizate de stenoză a arterei renale de către Sangle a dus la constatări similare în alte vase, ceea ce a condus la teorii despre patologia trombotică/endotelială localizată.37
Piel: livedo reticularis, o enigmă-Deși ulcerele cutanate, venele dilatate și hemoragiile subunghiale cu așchii sunt sechele bine cunoscute ale trombozei cutanate în APS, livedo reticularis are o aură de mister.38,39
Diagnostic, prezența sa este un indiciu important la pacienții suspectați de a avea sindromul Hughes – inclusiv APS seronegativ.
Cu o privire retrospectivă asupra unora dintre afecțiunile menționate în acest articol – SM, migrenă, fracturi multiple, probleme de memorie – de exemplu, ne întrebăm dacă observarea atentă a prezenței sau absenței livedo s-ar putea dovedi semnificativă în diagnosticul diferențial al acestor afecțiuni.
Un lucru este sigur: Prezența livedo adaugă o dimensiune în plus la severitatea tabloului clinic.
Gestație
Desigur, povestea de căpătâi a sindromului este în sarcină, unde rata de succes a nașterilor sănătoase în cazul sarcinilor aPL-pozitive a crescut vertiginos de la sub 15% la peste 90%. Fără îndoială, diagnosticarea și tratamentul acestor cazuri a reprezentat un progres semnificativ în lumea obstetricii.40
Din păcate, toți cei care lucrăm cu APS ne-am ocupat de pacienți aPL-pozitivi (dintre care unii au suferit avorturi spontane timpurii) care au pierdut un copil târziu în timpul sarcinii. Nașterea de morți.
Cu doi ani în urmă, The Times of London a publicat un articol principal intitulat „Scandalul nașterilor de morți”, subliniind cifrele slabe privind nașterile de morți din Marea Britanie.41 Cu toate acestea, unele cazuri de nașteri de morți la femeile aPL-pozitive ar fi putut fi prevenite. De exemplu, un studiu recent din Utah a constatat că sarcinile cu aPL aveau o probabilitate de trei până la cinci ori mai mare de a naște morți.42
Ar putea ajuta o testare mai sistematică a aPL în sarcină? Se aplică considerente legate de costuri. Avortul spontan este frecvent și există numeroase cauze. Astfel, recomandarea actuală este de a rezerva testarea pentru acele femei cu trei sau mai multe avorturi spontane. Acest lucru pare dur. Poate că un proces simplu de screening ar putea ajuta.
Am sugerat că o parte din screeningul inițial al moașei sau al obstetricianului ar trebui să includă un chestionar simplu cu trei părți:
- Ați avut o tromboză?
- Suferiți de migrene?
- Aveți antecedente familiale de boli autoimune (de ex, lupus, AR, scleroză multiplă, boală tiroidiană)?
Sunt sigur că un chestionar atât de simplu ar putea ajuta la identificarea unui mic grup de risc.
În majoritatea centrelor, odată ce mama și copilul sunt trimiși acasă în siguranță, nu există o urmărire pe termen lung. Cu toate acestea, de multe ori, pacientele cu APS care se prezintă, să zicem, la vârsta de 40 de ani cu o problemă trombotică, dau un istoric de avort spontan cu 20 de ani înainte. Într-o lume ideală, femeile cu avorturi spontane recurente merită o monitorizare regulată pe termen lung. Dar lumea este departe de a fi ideală.
Lupus & APS
Primele studii clinice ale APS au fost efectuate în clinicile de lupus și ar fi putut foarte bine să includă „caracteristici lupice”. Poate surprinzător, timpul a arătat puține diferențe între APS primară și APS asociată cu lupus. Există, fără îndoială, unele trăsături clasice ale lupusului (de exemplu, endocardită Libman Sachs, accident vascular cerebral, convulsii) care sunt mai susceptibile de a fi legate de aPL. De asemenea, pare probabil ca pozitivitatea aPL în lupus să confere un indice de cronicitate mai mare.
Pasarea timpului a relevat, de asemenea, o constatare pozitivă: Este foarte neobișnuit ca pacienții cu APS primar să dezvolte lupus în anii următori.
The Big 3
Asociația dintre sindromul Hughes, Sjögren și hipotiroidism este atât de frecventă încât am luat obiceiul de a le numi cele 3 mari. Din punct de vedere clinic, este o asociere importantă, deoarece simptomele clinice ale celor trei afecțiuni – oboseală, circulație rece, dureri și dureri și probleme de echilibru și memorie – sunt comune tuturor celor trei. În mod similar, mulți dintre acești pacienți sunt împovărați cu eticheta de fibromialgie.
Care dintre cele trei sindroame interconectate poate răspunde bine la tratament – de exemplu, Sjögren clinic la hidroxicloroquină și așa mai departe. Mulți dintre acești pacienți urmează tratamentul cu cei doi arbori ai mei – salcie (aspirină) și cinchona (chinină).
PSA seronegativă
Cred că unul dintre beneficiile timpului petrecut de un clinician stagiar în laborator este recunoașterea faptului că multe teste de laborator sunt deschise la variații. Foarte multe, foarte multe studii au încercat să evalueze importanța titrului, a clasei de imunoglobuline, tripla sau dubla pozitivitate, relevanța „altor” aPL, cum ar fi anti-fosfatidil-serină etc.43,44
În general, toate acestea au relevanță, dar în clinică, unele nu se potrivesc, cum ar fi acei pacienți cu toate caracteristicile clinice ale APS ale căror teste aPL rămân încăpățânat negative.
Cu câțiva ani în urmă, am scris o lucrare în care am introdus termenul de APS seronegativ, atrăgând atenția asupra pacienților cu caracteristici clinice puternice de APS, dar cu teste negative.45 Conceptul se întoarce la începuturile AR seronegative și lupus seronegativ – ambele etichete, deși bazate doar pe observația clinică, au avut consecințe terapeutice și prognostice importante.
Trei explicații posibile pentru APS seronegativ sunt: 1) Diagnosticul este incorect (puțin probabil în toate cazurile); 2) testele anterior pozitive au devenit negative în timp (neobișnuit în experiența mea); sau 3) sunt necesare noi teste.46
Poate că cel mai puternic motiv pentru a fi deschiși cu privire la APS seronegativ provine din studiile familiale. Cu câteva săptămâni în urmă, am văzut o pereche de gemeni identici – primul cu APS clasic seropozitiv, care mai târziu a adus-o și pe sora sa geamănă (absolut) identică. Cea de-a doua geamănă avea seturi identice de simptome, dar, spre deosebire de prima geamănă, avea teste aPL negative. Ambii pacienți au răspuns la tratament.
O dată pe an, organizăm o întâlnire a pacienților la spitalul nostru. La ultima întâlnire, am aranjat un chestionar anonim simplu cu două întrebări: Sunteți un pacient cu APS sau un prieten/soț/soție? Aveți vreo rudă apropiată de sex feminin (soră, mamă, mătușă) cu boală autoimună (de exemplu, lupus, AR, tiroidă, scleroză multiplă, APS)? Rezultatul: Șaizeci la sută dintre pacienți aveau un istoric pozitiv de boli autoimune la rudele apropiate. Mai puțin de 20% dintre prieteni/soți au răspuns pozitiv.
Se poate ca propria mea experiență să fie distorsionată de prejudecata de trimitere din partea familiilor pacienților cu APS – dar seropozitivi sau nu, majoritatea pacienților cu APS seronegativ răspund la fel de bine la tratament.
Dacă unele dintre aceste persoane din studiul familial au avut, de fapt, APS seronegativ și totuși au fost potențial receptive la tratament, atunci posibilitățile sunt intrigante. Poate că un procent mai mare dintre pacienții noștri cu migrenă, cu accident vascular cerebral tânăr, cu angină pectorală tânără ar putea beneficia de o privire mai atentă pentru mai multe indicii ale APS – Schirmer uscat, livedo, istoricul familial de boală autoimună – de exemplu.
Aspecte terapeutice
În multe privințe, este dezamăgitor să mărturisim că, după 30 de ani, există puține tratamente noi. Introducerea noilor anticoagulante orale în tratamentul APS a fost, în mod previzibil, prudentă și este prea devreme pentru a generaliza.47
Statinele, IVIG și hidroxiclorchina au fost aruncate în amestec și, bineînțeles, terapia cu celule anti-B a primit anecdote favorabile. Un studiu recent de la Paris a sugerat că sirolimusul, utilizat în transplantul renal, ar putea avea un efect protector asupra vasculopatiei induse de aPL.48
Atunci, în 2016, tratamentul actual al APS este încă în mare parte limitat la aspirină, clopidogrel, heparină și warfarină.
Aspirina în doze mici, în ciuda detractorilor săi, este, desigur, prima alegere la mulți pacienți cu APS. Cu toate acestea, clopidogrelul rămâne o alternativă utilă la pacienții cu gastrită sau la astmatici. Dar există un al treilea rol pentru clopidogrel – important în lumea reală a medicinei practice – și anume, la acei pacienți care, indiferent de motiv, au încercat aspirina, fără un beneficiu clar.
Heparina-Heparina cu greutate moleculară mică a înlocuit, în majoritatea țărilor, în mare parte vechea heparină și, odată cu ea, temerile legate de trombocitopenie și osteoporoză au dispărut în mare parte. Acesta este un aspect important de subliniat, deoarece mulți practicieni sunt reticenți în a prelungi utilizarea heparinei.
Două observații: În primul rând, un număr de pacienți se ameliorează dramatic cu heparină, doar pentru a se simți mai puțin bine cu warfarină.
Unde să mergem în continuare? Atunci când problemele de dozare, rezistența la warfarină și complianța sunt (sperăm) excluse, o opțiune imediată este revenirea temporară la heparină. În unele cazuri, temporară s-a transformat în semi-lungă durată. În clinica noastră de APS avem câteva duzini de astfel de pacienți care, prin alegere, au rămas pe heparină subcutanată timp de doi ani sau mai mult. Da, au avut vânătăi, dar până acum nu am observat o înrăutățire a scanărilor DEXA.
A doua observație (și foarte clinică) se referă la un studiu cu heparină. Este o observație obișnuită că pacientele cu aPL/APS care iau heparină în timpul sarcinii nu au adesea dureri de cap timp de opt sau nouă luni. Acest lucru ne-a determinat să dezvoltăm un instrument clinic – un studiu terapeutic care ne-a fost de mare ajutor. Încercarea este o cură de trei sau patru săptămâni de heparină LMW.49
Dați-mi voie să dau un exemplu de utilizare a acesteia: La pacientul cu aPL/APS cu dureri de cap din ce în ce mai severe în ciuda aspirinei/clopidogrelului (și cu un RMN cerebral normal), un trial de 10.000 de unități de dalteparină (sau enoxaparină) timp de trei sau patru săptămâni poate obține rezultate substanțiale. În primul rând, poate oferi o indicație surprinzător de clară pentru a stabili dacă anticoagularea este calea corectă. În al doilea rând, la pacientul traumatizat care a parcurs calea familiară a multiplelor consultații de specialitate, cu un succes clinic la limită, poate fi un punct de cotitură major – primul semn palpabil de ameliorare.
Warfarină – Există puține lucruri noi de spus despre warfarină. A fost defăimată de mass-media, dar rămâne unul dintre cele mai utile medicamente din armamentariul nostru. Warfarina, ca să o spunem în termeni simpli, protejează împotriva accidentului vascular cerebral și a atacului de cord în APS.
S-a menționat necesitatea frecventă a unui INR mai mare la mulți pacienți cu APS – în special la cei cu caracteristici neurologice. Cred cu tărie în utilizarea aparatelor de autotestare a INR ori de câte ori este posibil la pacienții noștri.
Din păcate, unele clinici de anticoagulante se opun utilizării aparatelor de autotestare. Pentru mine, acest lucru este greșit. Uitați-vă la libertatea pe care a obținut-o autotestarea pentru diabeticii insulino-dependenți.
Ca medici, cred că avem datoria (până când se vor stabili anticoagulante mai bune și mai noi) să susținem warfarina ca medicament în mare parte sigur și eficient, care a salvat multe mii de vieți.
În 2015, tratamentul actual al sindromului Hughes este încă în mare parte limitat la aspirină, clopidogrel, heparină & warfarină.
Miscelaneu
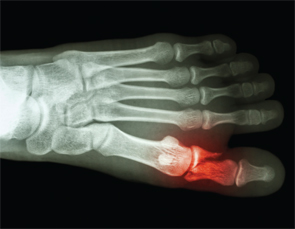
Fracturile osoase spontane încep să fie bine recunoscute în urma raportării a 27 de fracturi spontane de metatarsiene de către dr. Shirish Sangle la pacienții cu APS.
Creditul imaginii: Puwadol Jaturawutthichai/.com
Familia – Nu este o surpriză faptul că istoricul familial este un indiciu important în sindromul Hughes. Bolile autoimune (în special cele tiroidiene) apar în mod regulat ca diagnostic la rudele pacienților noștri. Dar cât de des sunt diagnosticate aceste cazuri familiale? Exemplele ar putea include fiica de 17 ani a unui pacient cu APS care suferă de dureri de cap și febră glandulară, fratele cu scleroză multiplă sau mama și mătușa unui pacient cu APS recent diagnosticat care au suferit un accident vascular cerebral la începutul vârstei de 40 de ani.
Nu este de neconceput ca APS să fi schimbat cursul istoriei, ca în cazul raportat de prietenul meu, dr. Gerald Weissmann, al reginei Ana a Angliei, care a avut 17 sarcini eșuate și a murit fără copii, aducând astfel sfârșitul domniei Stuart și începutul familiei Hanovra – cu George al III-lea, taxele coloniilor americane, revoluția și nașterea SUA50.
Progenitura – Până în prezent, majoritatea studiilor au sugerat că descendenții mamelor aPL-pozitive nu au efecte adverse majore (altele decât, poate, caracteristicile APS moștenite care se dezvoltă mai târziu la unii). Cu toate acestea, unele rapoarte de caz îngrijorătoare de probleme fetale și neonatale indică necesitatea unor studii suplimentare. Studiile în curs de desfășurare ale doctorilor Anne Parke, Angela Tincani, Maria Claire Boffa și alții vor furniza, în timp, unele dintre aceste date lipsă.51,52
Clasificare vs. diagnostic-
Dragă doctor, v-aș fi recunoscător dacă m-ați putea sfătui cu privire la acest pacient. Ea a dezvoltat o tromboză în timpul administrării pilulei contraceptive orale. Ea a avut un test pozitiv pentru aPL, dar nu a făcut un test repetat 12 săptămâni mai târziu.
Ca și în cazul lupusului, criteriile de clasificare se confundă uneori cu diagnosticul. Mulți pacienți nu vin înarmați cu teste „la 12 săptămâni distanță” (acest criteriu a fost introdus pentru a acoperi riscul ca o infecție intercurentă să fi dus la un test aPL pozitiv tranzitoriu – nu un factor major în evaluarea noastră a acestui pacient).
Există, de asemenea, considerente financiare, cum ar fi în următorul studiu din Beirut, Liban.
„Doar 50,5% au avut atât aCL cât și LA testate. … Costul fiecărui test a fost de aproximativ 50 USD pentru pacient. … Rămâne de văzut dacă nu cumva costurile testelor ar putea explica parțial procentul foarte mic de pacienți care au fost supuși unui test de confirmare de urmărire.”
Pasarea timpului a relevat, de asemenea, o constatare pozitivă: Este foarte neobișnuit ca pacienții cu APS primar să dezvolte lupus în anii următori.
Recunoașterea numeroaselor manifestări non-trombotice ale APS a sporit importanța separării diagnosticului de clasificare. Poate că progresele de laborator în măsurarea markerilor potențiali de risc ne vor veni, în timp, în ajutor.44
Frica de zbor – Această anecdotă clinică apare în mod regulat în clinica mea. Atât de mult încât cred că trebuie studiată în continuare. Un număr de pacienți ai mei cu APS, în special înainte de începerea tratamentului, suferă grav de un decalaj orar prelungit după un zbor de lungă distanță, cu oboseală, dureri de cap și confuzie, care durează uneori zile întregi.
În mod interesant, odată ce tratamentul cu heparină sau warfarină este început cu succes, acest fenomen dispare. Nu se știe dacă aceste simptome sunt legate de o ușoară hipoxie cerebrală secundară unei presiuni ușor reduse în cabină. Cu toate acestea, unii dintre pacienții mei cu APS își vor suplimenta tratamentul cu aspirină înainte de un zbor pe distanțe lungi cu o injecție de heparină LMW. Deși efectul placebo poate fi considerabil, sunt suficient de impresionat de experiența clinică a acestor pacienți (observatori) pentru a crede că fenomenul de decalaj de fus orar prelungit la mulți dintre pacienții noștri este foarte real.
Viitorul – La cel de-al 14-lea Congres internațional privind anticorpii antifosfolipidici, care a avut loc la Rio de Janeiro în 2013, am fost întrebat de predicțiile mele privind viitorul APS.23 Pe scurt, eu cred că:
- Testarea aPL va deveni mondială și de rutină;
- Kiturile de testare aPL fără prescripție medicală vor deveni disponibile;
- Un subset substanțial de bolnavi de migrenă va avea o nouă speranță;
- APS va fi recunoscută ca fiind legătura majoră între migrenă și accidentul vascular cerebral;
- Se vor reduce atacurile de cord la femeile tinere (în special la cele sub 45 de ani);
- Se vor reduce accidentele vasculare cerebrale la cele sub 45 de ani;
- Câteva cazuri de boală arterială accelerată vor fi recunoscute ca fiind asociate cu aPL (netratată);
- Câteva cazuri de pierdere a memoriei sunt tratabile;
- APS va continua să aibă un efect profund asupra evaluării noastre clinice și a tratamentului lupusului; și
- În cele din urmă, pentru a reveni la tema de deschidere, incidența nașterilor de copii morți va fi redusă, datorită, în parte, unei abordări mai proactive a testării aPL în timpul sarcinii.
Pentru a repeta o frază preluată din lucrarea din 1983:1
Pentru aceia dintre noi împietriți în nihilism de ani de zile de studiu al diverșilor autoanticorpi în LES, există un rar sentiment de entuziasm față de implicațiile asociațiilor care sunt acum raportate.
Treizeci de ani mai târziu, acest entuziasm clinic rămâne nedisimulat.
 Graham R.V. Hughes, MD, FRCP, este reumatolog consultant și șef al London Lupus Centre. S-a format la The London Hospital și a petrecut doi ani la New York, lucrând la introducerea testului de legare a ADN-ului, sub conducerea doctorului Charles Christian. În 1971, a deschis o clinică specializată în Londra, care se ocupă exclusiv de lupus și de bolile conexe. Este fondator și editor al revistei internaționale Lupus. În 1983, a descris sindromul antifosfolipidic și, în 1991, a primit premiul ILAR (cercetare mondială) pentru această lucrare. Alte distincții includ titlul de Doctor Honoris Causa în universitățile din Marsilia și Barcelona, și Master al ACR.
Graham R.V. Hughes, MD, FRCP, este reumatolog consultant și șef al London Lupus Centre. S-a format la The London Hospital și a petrecut doi ani la New York, lucrând la introducerea testului de legare a ADN-ului, sub conducerea doctorului Charles Christian. În 1971, a deschis o clinică specializată în Londra, care se ocupă exclusiv de lupus și de bolile conexe. Este fondator și editor al revistei internaționale Lupus. În 1983, a descris sindromul antifosfolipidic și, în 1991, a primit premiul ILAR (cercetare mondială) pentru această lucrare. Alte distincții includ titlul de Doctor Honoris Causa în universitățile din Marsilia și Barcelona, și Master al ACR.
- Hughes GR. Tromboza, avortul, boala cerebrală și anticoagulantul lupic. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipină în anticorpi: Detectarea prin radioimunoanaliză și asocierea cu tromboza în LES. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE: Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. Orația Prosser White 1983: Boala țesutului conjunctiv și pielea. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Hipertensiunea pulmonară în lupusul eritematos sistemic. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Asocierea cu anticorpii anticardiolipină. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Sindromul anticardiolipină. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Sindromul lui Hughes: Sindromul anticardiolipină. O viziune istorică. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revizuirea mecanismului molecular în sindromul antifosfolipidic: Dincolo de leziunile vasculare. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Anticorpii limfocitotoxici reactivi la creier în serul pacienților cu LES. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Reactivitatea cerebrală a aniticorpilor limfocitotoxici în lupusul eritematos sistemic cu și fără afectare cerebrală. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Relația dintre specificitățile anticorpilor limfocitelor și boala clinică. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Asocierea cu anticorpii anticardiolipină. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. „Cerebral disease in the antiphospholipid syndrome” în Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, ed. Springer, Londra: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Reumatologie (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Riscul de accident vascular cerebral ischemic la persoanele cu migrenă: Revizuire sistemică și meta-analiză a studiilor observaționale. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus anticoagulant și anticorpi anticardiolipină la adulții tineri cu ischemie cerebrală. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Sindromul antifosfolipidic, migrena și accidentul vascular cerebral. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsie: Un simptom precoce al lupusului eritematos sistemic. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsia ca parte a lupusului eritematos sistemic și a sindromului antifosfolipidic sistemic (sindrom Hughes). Lupus. 2006;15(4):191-194.
- Hughes GR. „Diplomatic epilepsy” în Understanding Hughes Syndrome. Springer-Verlag, Londra: 2009.
- Hughes GR. Sindromul Hughes/APS. După 30 de ani, ce am învățat? Discurs de deschidere la cel de-al 14-lea Congres internațional privind anticorpii antifosfolipidici. Rio de Janeiro, octombrie 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Pot fi distinse manifestările neurologice ale sindromului Hughes (antifosfolipidic) de scleroza multiplă? Analiza a 27 de pacienți și revizuirea literaturii de specialitate. Medicină (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migrena, pierderea memoriei și „scleroza multiplă”. Caracteristici neurologice ale sindromului antifosfolipidic (Hughes’). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes syndrome and multiple sclerosis. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea în sindromul antifosfolipidic. Caracteristici clinice, radiologice și imunologice la 50 de pacienți din clinicile noastre și din literatura recentă. Medicină (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Tulburări de mișcare în lupusul eritematos sistemic și în sindromul antifosfolipidic. J Neural Transm (Viena). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Antiphospholipid antibodies, systemic lupus erythematosus, and non-traumatic metatarsal fratures. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr., et al. Anticorpii antifosfolipidici mai noi prezic rezultate adverse la pacienții cu sindrom coronarian acut. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: Un studiu caz-control. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Sindromul X și sindromul Hughes. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Stenoza arterei celiace și sindromul antifosfolipidic (Hughes)/anticorpii antifosfolipidici. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. Posibilul rol patogenetic al anticorpilor antifosfolipidici. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Sindromul antifosfolipidic catastrofal și sarcina: O experiență de 13 cazuri. Reumatologie (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Stenoza arterei renale în sindromul antifosfolipidic (Hughes) și hipertensiune arterială. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: O enigmă. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. The challenge of pregnancy for patients with SLE. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. Scandalul nașterilor moarte. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies (the so-called ‘seronegative APS’). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid syndrome in 2014: Mai multe manifestări clinice, noi actori patogeni și biomarkeri emergenți. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Sindromul antifosfolipidic seronegativ. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Manifestări clinice ale sindromului antifosfolipidic (APS) cu și fără anticorpi antifosfolipidici. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibition of the mTORC pathway in the antiphospholipid syndrome. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparina, anticorpii antifosfolipidici și creierul. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s lupus: Fosfolipidele și evoluția imperiului. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Children born to SLE and APS mothers. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Modele de practică a sindromului antifosfolipidic la un spital universitar terțiar din Liban. Lupus. 2002;11(11):759–764.