Electroni de nucleu și de valență
Pe măsură ce continuăm să parcurgem tabelul periodic în acest fel, scriind configurațiile electronice ale unor atomi din ce în ce mai mari, devine plictisitor să continuăm să copiem configurațiile subshell-urilor interioare pline. În practică, chimiștii simplifică notația prin utilizarea unui simbol de gaz nobil între paranteze pentru a reprezenta configurația gazului nobil din rândul precedent, deoarece toți orbitalii dintr-un gaz nobil sunt plini. De exemplu, reprezintă configurația electronică 1s2 2s2 2p6 a neonului (Z = 10), deci configurația electronică a sodiului, cu Z = 11, care este 1s2 2s2 2s2 2p6 3s1, se scrie ca 3s1
| Configurația electronică completă | Corectitudinea gazului Nobel | |||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 | |
| Sodiu | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Electronii din orbitalii interiori plini sunt mai aproape de nucleu și mai strâns legați de acesta și, prin urmare, sunt rareori implicați în reacții chimice. Vom numi acești electroni de nucleu. Pentru elementele reprezentative (coloanele 1, 2 și 13-18 din tabelul periodic), electronii de nucleu sunt toți electronii cu o valoare n mai mică decât valoarea n maximă din configurația electronică. De exemplu, în atomul de sodiu, cea mai mare valoare n este 3. Astfel, electronii de nucleu sunt cei din orbitalii atomici cu n < 3, și anume cei din orbitalii 1s, 2s și 2p. Așadar, sodiul are 10 electroni de nucleu. Vom reveni mai târziu asupra acestei definiții a electronilor de nucleu pentru metalele de tranziție.
Aceasta înseamnă că chimia unui atom depinde în principal de electronii din învelișul său cel mai exterior, cei cu cea mai mare valoare n, care se numesc electroni de valență. Notația simplificată ne permite să vedem mai ușor configurația electronilor de valență. Folosind această notație pentru a compara configurațiile electronice ale sodiului și litiului, avem:
| Sodiu | 1s2 2s2 2p6 3s1 | 3s1 |
| Litiu | 1s2 2s1 | 2s1 |
Este ușor de observat că atât sodiul cât și litiul au câte un electron s în învelișul de valență. Prin urmare, am putea prezice că sodiul și litiul au o chimie foarte asemănătoare, ceea ce este într-adevăr cazul.
Pe măsură ce continuăm să construim cele opt elemente din perioada 3, orbitalii 3s și 3p sunt completați, câte un electron pe rând. Acest rând se încheie cu gazul nobil argon, care are configurația electronică 3s2 3p6, corespunzând unui înveliș de valență plin.
Exemplu 2.2.2
Desenați o diagramă orbitală și folosiți-o pentru a obține configurația electronică a fosforului, Z = 15. Care este configurația electronică de valență a acestuia?
Dat: numărul atomic
Se cere: diagrama orbitală și configurația electronică de valență pentru fosfor
Strategie:
- Localizați cel mai apropiat gaz nobil care precede fosforul în tabelul periodic. Apoi scădeți numărul său de electroni din cei din fosfor pentru a obține numărul de electroni de valență din fosfor.
- Referindu-vă la figura 2.1.1, desenați o diagramă orbitală pentru a reprezenta acești orbitali de valență. Urmând regula lui Hund, plasați electronii de valență în orbitalii disponibili, începând cu orbitalul care are cea mai mică energie. Scrieți configurația electronică din diagrama orbitală.
- Ignorați orbitalii interiori (cei care corespund configurației electronice a celui mai apropiat gaz nobil) și scrieți configurația electronică de valență pentru fosfor.
Soluție:
A Deoarece fosforul se află în al treilea rând al tabelului periodic, știm că are un înveliș închis cu 10 electroni. Începem prin a scădea 10 electroni din cei 15 din fosfor.
B Cei cinci electroni suplimentari sunt plasați în următorii orbitali disponibili, care Figura 2.1.1 ne spune că sunt orbitalii 3s și 3p:
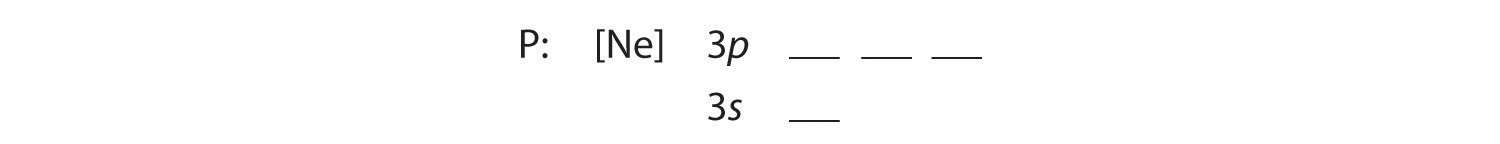
Pentru că orbitalul 3s are o energie mai mică decât orbitalii 3p, îl umplem primul:
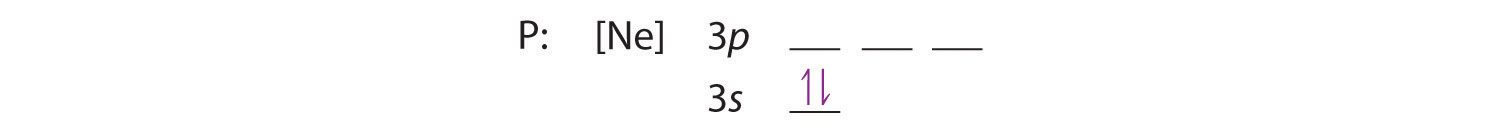
Regula lui Hund ne spune că cei trei electroni rămași vor ocupa orbitalii 3p degerați separat, dar cu spinii lor aliniați:
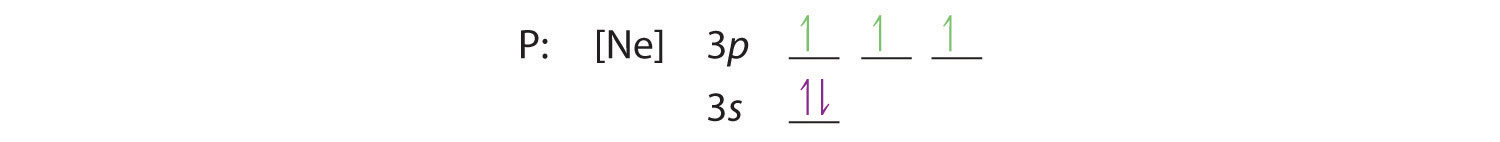
Configurația electronică este 3s2 3p3.
C Obținem configurația electronilor de valență prin ignorarea orbitalilor interni, ceea ce pentru fosfor înseamnă că ignorăm învelișul închis. Astfel se obține o configurație a electronilor de valență de 3s2 3p3.
Exercițiu 2.2.2
Desenați o diagramă orbitală și folosiți-o pentru a obține configurația electronică a clorului, Z = 17. Care este configurația electronilor săi de valență?
Răspuns: : 3s2 3p5
Configurația electronilor de valență: 3s23p5
Ordinea generală în care sunt ocupați orbitalii este reprezentată în figura 2.2.1. Subînvelișurile corespunzătoare fiecărei valori a lui n sunt scrise de la stânga la dreapta pe linii orizontale succesive, unde fiecare rând reprezintă un rând din tabelul periodic. Ordinea în care sunt ocupați orbitalii este indicată de liniile diagonale care merg din dreapta sus spre stânga jos. În consecință, orbitalul 4s este umplut înaintea orbitalului 3d din cauza efectelor de ecranare și penetrare. În consecință, configurația electronică a potasiului, care începe a patra perioadă, este 4s1, iar configurația calciului este 4s2. Cinci orbitali 3d sunt ocupați de următoarele 10 elemente, metalele de tranziție, urmate de trei orbitali 4p. Observați că ultimul membru al acestui rând este gazul nobil kripton (Z = 36), Kr: 4s2 3d10 4p6, care are orbitalii 4s, 3d și 4p plini. Al cincilea rând al tabelului periodic este, în esență, la fel ca al patrulea, cu excepția faptului că orbitalii 5s, 4d și 5p sunt ocupați secvențial.
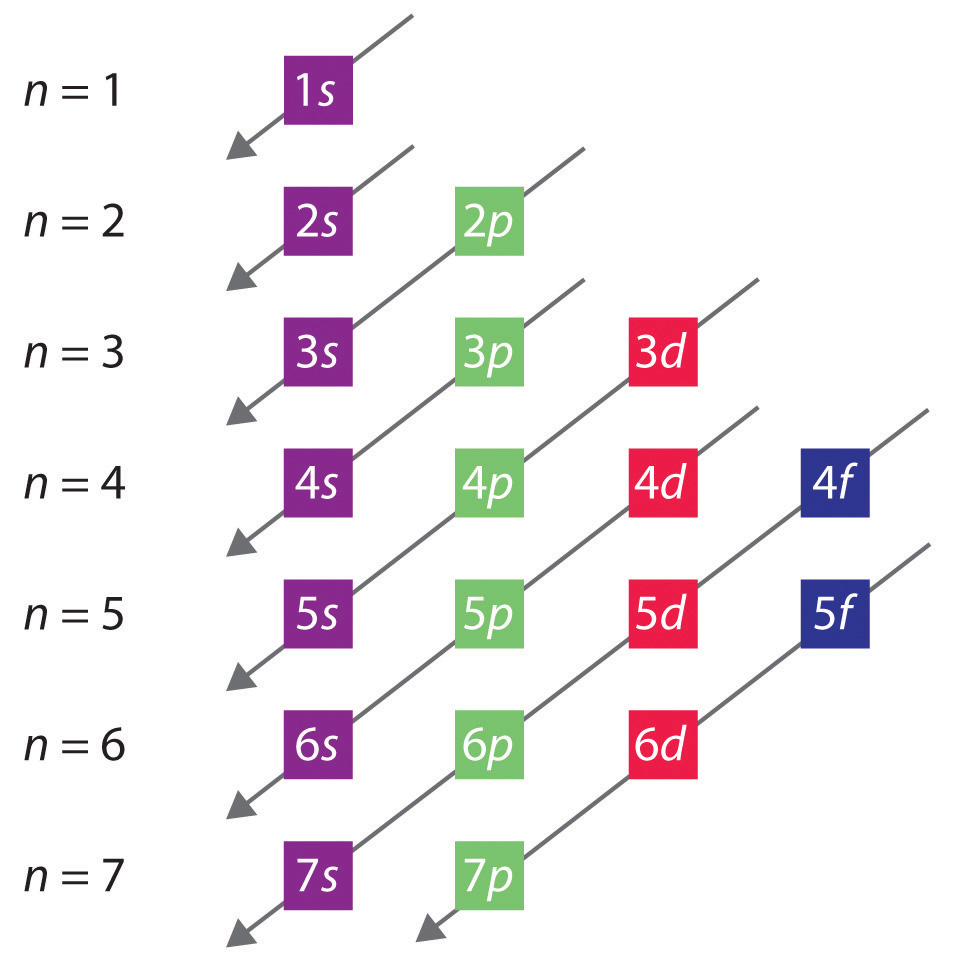
Figura 2.2.1 Predicția ordinii în care sunt ocupați orbitalii în atomii multielectronici. Dacă scrieți subshell-urile pentru fiecare valoare a numărului cuantic principal pe linii succesive, ordinea observată în care acestea sunt umplute este indicată de o serie de linii diagonale care merg din dreapta sus spre stânga jos.
Cel de-al șaselea rând al tabelului periodic va fi diferit de cele două anterioare deoarece orbitalii 4f, care pot conține 14 electroni, sunt plini între orbitalii 6s și 5d. Elementele care conțin orbitali 4f în învelișul de valență sunt lantanidele. Când orbitalii 6p sunt în sfârșit ocupați, am ajuns la următorul (și ultimul) gaz nobil cunoscut, radonul (Z = 86), Rn: 6s2 4f14 5d10 6p6. În ultimul rând, orbitalii 5f sunt ocupați între orbitalii 7s și 6d, ceea ce dă cele 14 elemente actinide. Deoarece numărul mare de protoni face ca nucleele lor să fie instabile, toate actinidele sunt radioactive.
Exemplu 2.2.3
Scrieți configurația electronică a mercurului (Z = 80), arătând toți orbitalii interiori.
Dat: număr atomic
Se cere: configurația electronică completă
Strategie:
Utilizând diagrama orbitală din figura 2.2.1 și tabelul periodic ca ghid, completați orbitalii până când toți cei 80 de electroni au fost plasați.
Soluție:
Prin plasarea electronilor în orbitali urmând ordinea prezentată în figura 2.2.1.1 și folosind tabelul periodic ca ghid, obținem
| 1s2 | fila 1 | 2 electroni |
| 2s22p6 | fila 2 | 8 electroni |
| 3s23p6 | fila 3 | 8 electroni |
| 4s23d104p6 | fila 4 | 18 electroni |
| 5s24d105p6 | fila 5 | 18 electroni |
| rândurile 1-5 | 54 electroni |
După completarea primelor cinci rânduri, mai avem încă 80 – 54 = 26 de electroni de acomodat. Conform figurii 2.2.2.2, trebuie să umplem orbitalii 6s (2 electroni), 4f (14 electroni) și 5d (10 electroni). Rezultatul este configurația electronică a mercurului:
Hg: 1s2 2s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
cu un subshell 5d plin, o configurație a învelișului de valență 6s2 4f14 5d10 și un total de 80 de electroni. (Trebuie să verificați întotdeauna pentru a vă asigura că numărul total de electroni este egal cu numărul atomic.)
Exercițiu 2.2.3
Deși elementul 114 nu este suficient de stabil pentru a apărea în natură, doi izotopi ai elementului 114 au fost creați pentru prima dată într-un reactor nuclear în 1999 de către o echipă de oameni de știință ruși și americani. Scrieți configurația electronică completă pentru elementul 114.
Răspuns: : 1s2 2s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Configurațiile electronice ale elementelor sunt prezentate în figura 2.2.3, care enumeră orbitalii în ordinea în care sunt ocupați. În mai multe cazuri, configurațiile electronice ale stării fundamentale sunt diferite de cele prezise de figura 2.2.1. Unele dintre aceste anomalii apar pe măsură ce orbitalii 3d sunt ocupați. De exemplu, configurația electronică observată a stării fundamentale a cromului este 4s1 3d5, mai degrabă decât cea prezisă 4s2 3d4. În mod similar, configurația electronică observată a cuprului este 4s1 3d10 în loc de s2 3d9. Configurația reală a electronilor poate fi raționalizată în termenii unei stabilități suplimentare asociate cu un subshell semiumplut (ns1, np3, nd5, nf7) sau plin (ns2, np6, nd10, nf14). Având în vedere diferențele mici dintre nivelurile energetice superioare, această stabilitate suplimentară este suficientă pentru a muta un electron de pe un orbital pe altul. În cazul elementelor mai grele, alte efecte mai complexe pot fi, de asemenea, importante, conducând la unele dintre anomaliile suplimentare indicate în figura 2.2.3. De exemplu, ceriul are o configurație electronică de 6s2 4f1 5d1, care este imposibil de raționalizat în termeni simpli. Cu toate acestea, în majoritatea cazurilor, aceste anomalii aparente nu au consecințe chimice importante.
Nota
Stabilitatea suplimentară este asociată cu subshell-uri pline pe jumătate sau pline.
.