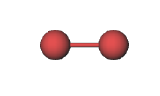
Am prezentat o vedere microscopică a reacției chimice dintre mercur și brom. Ecuația
| \ | \ | \ | |
 |
 |
_Bromide_Rotated.png?revision=1&size=bestfit&width=136&height=94) |
|
 |
 |
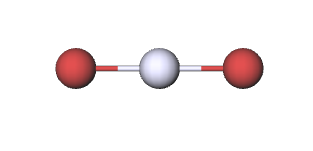 |
reprezintă același eveniment în termeni de simboluri și formule chimice, în timp ce imaginile de mai jos reprezintă vederea macroscopică. Dar cum poate un chimist practicant să afle ce se întâmplă la scară microscopică? Atunci când o reacție este efectuată pentru prima dată, se cunosc puține lucruri despre natura microscopică a produselor. Prin urmare, este necesar să se determine experimental compoziția și formula unei substanțe nou sintetizate.
Primul pas într-o astfel de procedură este, de obicei, separarea și purificarea produselor unei reacții. De exemplu, deși combinarea mercurului cu bromul produce în principal bromură mercurică, deseori se formează și puțină bromură mercuroasă. Un amestec de bromură mercuroasă cu bromură mercurică are proprietăți diferite față de o mostră pură de HgBr2 și, prin urmare, Hg2Br2 trebuie eliminată. Solubilitatea scăzută a Hg2Br2 în apă ar permite purificarea prin recristalizare. Produsul ar putea fi dizolvat într-o cantitate mică de apă fierbinte și filtrat pentru a elimina Hg2Br2 nedizolvat. După răcirea și evaporarea parțială a apei, s-ar forma cristale de HgBr2 relativ pur.
După ce s-a obținut un produs pur, ar putea fi posibilă identificarea substanței prin intermediul proprietăților sale fizice și chimice. Prin reacția mercurului cu bromul se obțin cristale albe care se topesc la 236°C. Lichidul care se formează fierbe la 322°C. Deoarece este obținut prin combinarea a două elemente, produsul este un compus. Compararea proprietăților sale cu un manual sau cu un tabel de date duce la concluzia că este bromură de mercur.
Să presupunem însă că ați fi prima persoană care a preparat bromură de mercur. Atunci nu existau tabele care să enumere proprietățile sale și, prin urmare, cum ați putea determina că formula ar trebui să fie HgBr2? Un răspuns implică analiza cantitativă – determinarea procentului în masă al fiecărui element din compus. Astfel de date sunt de obicei raportate ca și compoziție procentuală.
Exemplu \(\PageIndex{1}\): Compoziție procentuală
Când 10,0 g de mercur reacționează cu o cantitate suficientă de brom, se formează 18,0 g de compus pur. Calculați compoziția procentuală pornind de la aceste date experimentale.
Soluția:
Procentul de mercur este masa de mercur împărțită la masa totală a compusului înmulțită cu 100 la sută:
\
Rămășița de compus (18.0 g – 10 g = 8,0 g) este brom:
\
Ca o verificare, verificați dacă procentele se adună la 100:
\
Pentru a obține formula din datele de compoziție procentuală, trebuie să aflăm câți atomi de brom există la fiecare atom de mercur. La scară macroscopică, acest lucru corespunde raportului dintre cantitatea de brom și cantitatea de mercur. Dacă formula este HgBr2, aceasta nu numai că indică faptul că există doi atomi de brom la fiecare atom de mercur, ci și că există 2 moli de atomi de brom pentru fiecare 1 mol de atomi de mercur. Altfel spus, cantitatea de brom este de două ori mai mare decât cea de mercur. Cifrele din raportul dintre cantitatea de brom și cantitatea de mercur (2:1) sunt indicele bromului și al mercurului din formulă.
Exemplu \(\PageIndex{2}\) : Formula
Determinați formula pentru compusul a cărui compoziție procentuală a fost calculată în exemplul anterior.
Soluție:
Pentru comoditate, să presupunem că avem 100 g de compus. Dintre acestea, 55,6 g (55,6%) sunt mercur și 44,4 g sunt brom. Fiecare masă poate fi convertită într-o cantitate de substanță
\(\begin{align} & n_{{\text{Hg}}=\text{55.6 g}\cdot \dfrac{\text{1 mol Hg}}{\text{200.59 g}} =\text{0.277 mol Hg} \\ { } \\\ & n_{{\text{Hg}}=\text{44.4 g}\cdot \dfrac{\text{\ text{1 mol Br}}{\text{79.90 g}} =\text{0.556 mol Br} \end{align}\)
Divizând cantitatea cea mai mare la cea mai mică, avem
\
Raportul 2,01 mol Br la 1 mol Hg implică și faptul că există 2,01 atomi de Br la 1 atom de Hg. Dacă teoria atomică este corectă, nu există 0,01 atom de Br; în plus, numerele noastre sunt bune doar până la trei cifre semnificative. Prin urmare, rotunjim 2,01 la 2 și scriem formula ca HgBr2.
Exemplu \(\PageIndex{3}\): Calculul formulei
Un bromură de mercur are compoziția 71,5% Hg, 28,5% Br. Găsiți formula sa.
Soluție:
Să presupunem din nou o probă de 100 g și să calculăm cantitatea fiecărui element:
\(\begin{align} & n_{{\text{Hg}}=\text{71}\text{.5 g}\cdot \dfrac{\text{1 mol Hg}}{\text{200.59 g}} = \text{0.356 mol Hg} \\ { } \\\ & n_{{\text{Hg}}=\text{28.5 g}\cdot \dfrac{\text{\ text{1 mol Br}}{\text{79.90 g}} =\text{0.357 mol Br} \end{align}\)
Raportul este
\
În consecință, vom atribui formula HgBr.
Formula obținută în Exemplul \(\PageIndex{3}\) nu corespunde nici uneia dintre cele două bromuri de mercur pe care le-am discutat deja. Este vorba de o a treia? Răspunsul este nu, deoarece metoda noastră poate determina doar raportul dintre Br și Hg. Raportul 1:1 este același cu 2:2 și, prin urmare, metoda noastră va da același rezultat pentru HgBr sau Hg2Br2 (sau Hg7Br7, în cazul în care ar exista). Formula determinată prin această metodă se numește formula empirică sau formula cea mai simplă. Ocazional, ca în cazul bromurii mercuroase, formula empirică diferă de compoziția moleculară reală sau de formula moleculară. Determinarea experimentală a greutății moleculare în plus față de compoziția procentuală permite calcularea formulei moleculare.
Exemplu \(\PageIndex{4}\):
Un compus a cărui greutate moleculară este 28 conține 85,6% C și 14,4% H. Determinați formulele empirică și moleculară ale acestuia.
Soluție:
\(\begin{align}) & n_{{\text{C}}=\text{85.6 g}\cdot \dfrac{\text{1 mol C}}{\text{12.01 g}} =\text{7.13 mol C} \\ { } \\\ & n_{\text{H}}=\text{14.4 g}\cdot \dfrac{{text{1 mol H}}{\text{1.008 g}} =\text{14.3 mol H} \end{align}\)
\
Formula empirică este deci CH2. Greutatea moleculară corespunzătoare formulei empirice este
\
Din moment ce greutatea moleculară experimentală este de două ori mai mare, toți indicele trebuie să fie dublat și formula moleculară este C2H4.
Ocazional raportul dintre cantități nu este un număr întreg.
Exemplu \(\PageIndex{5}\): Formula empirică
Aspirina conține 60,0% C, 4,48% H și 35,5% O. Care este formula sa empirică?
Soluție:
\(\begin{align} & n_{{\text{H}}=\text{14.4 g}\cdot \dfrac{\text{1 mol H}}{\text{1.008 g}} =\text{14.3 mol H} \\ { } \\& n_{{\text{C}}=\text{85.6 g}\cdot \dfrac{{text{1 mol C}}{\text{12.01 g}} =\text{7.13 mol C} \\ { } \\\ & n_{\text{O}}=\text{35.5 g}\cdot \dfrac{\text{1 mol O}}{\text{16.00 g}} =\text{2.22 mol O} \end{align}\)
Divideți toate trei la cea mai mică cantitate de substanță
\(\begin{align} & \dfrac{n_{{\text{C}}}{n_{\text{O}}} = \dfrac{\text{5.00 mol C}}{\text{2.22 mol O}} =\dfrac{\text{\text{2.25 mol H}}{\text{1 mol O}} \\ { } \\ & \dfrac{n_{\text{H}}}{n_{\text{O}}}=\dfrac{\text{\text{4.44 mol H}}{\text{2.22 mol O}}= \dfrac{\text{\text{2.00 mol H}}{\text{1 mol O}} \end{align}\)
Este clar că există de două ori mai mulți atomi de H decât atomi de O, dar raportul dintre C și O nu este atât de evident. Trebuie să convertim 2,25 într-un raport de numere întregi mici. Acest lucru se poate face prin schimbarea cifrelor de după virgulă într-o fracție. În acest caz, 0,25 devine \(\small \dfrac{1}{4}\). Astfel \( 2.25 = 2 \small\dfrac{1}{4} \normalsize = \tfrac{\text{9}}}{\text{4}}\), și
\
Potem scrie de asemenea
\
Deci formula empirică este C9H8O4.
După ce cineva a determinat o formulă – empirică sau moleculară – este posibil ca altcineva să facă calculul invers. Găsirea compoziției în procente de greutate din formulă se dovedește adesea destul de informativă, după cum arată următorul exemplu.
Exemplu \(\PageIndex{6}\): Procentul de azot
Pentru a reface azotul eliminat din sol atunci când plantele sunt recoltate, compușii NaNO3 (nitrat de sodiu), NH4NO3 (nitrat de amoniu) și NH3 (amoniac) sunt utilizați ca îngrășăminte. Dacă un fermier ar putea cumpăra fiecare dintre aceștia la același cost pe gram, care ar fi cea mai bună afacere? Cu alte cuvinte, care compus conține cel mai mare procent de azot?
Soluție
Vom prezenta calculul detaliat doar pentru cazul NH4NO3.
1 mol de NH4NO3 conține 2 moli de N, 4 moli de H și 3 moli de O. Masa molară este astfel
\
Un eșantion de 1 mol ar cântări 80.05 g. Masa de 2 moli de N pe care o conține este
\
Din acest motiv, procentul de N este
\
Procentajele de H și O sunt ușor de calculat astfel
\(\begin{align} m_{\text{H}}& = \text{4 mol H }\cdot\dfrac{\text{1.008 g}}}{\text{1 mol H}}\text{ = 4,032 g} \\ { } \ \ \text{ }\%\text{ H } & = \dfrac{\text{4.032 g}}{\text{80.05 g}} \cdot \text{ 100 }\%\text{ = 5.04 }\%\ \%\ \\ { } \\\ m_{\text{O}}& = \text{3 mol O }\cdot \dfrac{\text{\16.00 g}}{\text{1 mol O}} \text{ = 48.00 g} \\ { } \\\ \%\text{ O } & = \dfrac{\text{48.00 g}}{\text{80.05 g}}\text{ }\cdot \text{ 100 }\%\text{ = 59.96 }\%\text{} } \end{align}\)
Deși nu sunt strict necesare pentru a răspunde la problemă, ultimele două procente oferă o verificare a rezultatelor. Totalul \(35.00 + 5.04\% + 59.96\% = 100.00\%\%\) așa cum ar trebui. Calcule similare pentru NaNO3 și NH3 dau 16,48% și, respectiv, 82,24% azot. Fermierul care se pricepe la chimie alege amoniacul!
Contribuitori și atribuții
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff și Adam Hahn.