Eine mikrobielle Biorealm-Seite über die Gattung Rhodospirillum rubrum
Klassifikation
Taxa höherer Ordnung
Kingdom: Bacteria
Stamm: Proteobacteria
Klasse: Alphaproteobacteria
Ordnung: Rhodospirillales
Familie: Rhodospirillaceae
Gattung: Rhodospirillum
Spezies
Rhodospirillum rubrum
Beschreibung und Bedeutung
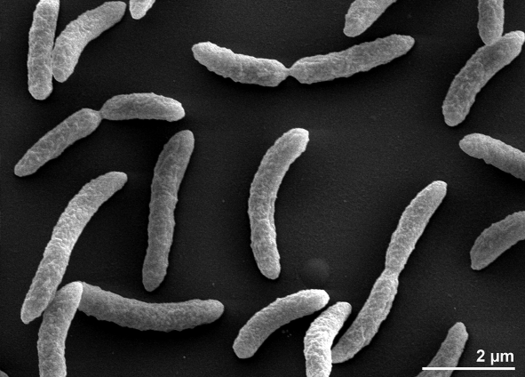
Rhodospirillum rubrum ist eine gramnegative, mesophile Proteobakterie. Seine optimale Wachstumstemperatur liegt bei 25-30 Grad Celsius. Es hat mehrschichtige äußere Hüllen, die hauptsächlich ungesättigte, aber auch einige gesättigte Fette in seiner Zellwand enthalten. R. rubrum ist eine Spirille, das heißt, sie hat eine spiralförmige Gestalt. Sie ist polar gegeißelt und daher beweglich. Seine Länge beträgt 3-10 um, mit einer Breite von 0,8-1,0 um.
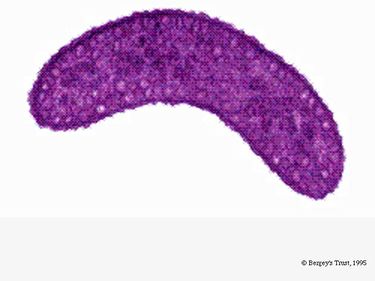
R. rubrum ist ein fakultativer Anaerobier. Je nach Vorhandensein von Sauerstoff kann er alkoholische Gärung oder aerobe Atmung betreiben. Sie ist auch zur Photosynthese fähig und enthält Carotinoide und Bateriochlorophyll in ihren Chromatophoren. Diese Moleküle tragen dazu bei, Licht zu absorbieren und in Energie umzuwandeln, und verleihen ihm auch unter anaeroben Bedingungen seine ausgeprägte purpurrote Farbe. Unter aeroben Bedingungen ist R. rubrum farblos.
Obwohl die Photosynthese unter aeroben Bedingungen aktiv ist, wird sie im Allgemeinen in Gegenwart von O2 unterdrückt. Schwefel ist ein Hauptnebenprodukt der Photosynthese, nicht O2. R. rubrum kann heterotroph oder autotroph wachsen, wenn sie photosynthetisch ist. Anders als viele Pflanzen enthält R. rubrum kein Chlorophyll a (Absorptionsspektren 430-662 nm). Es enthält jedoch Chlorophyll b (Absorptionsspektren 660-680 nm) und Bakteriochlorophylle (800-925 nm). Dadurch kann sie mehr Energie aus den elektromagnetischen Spektren nutzen. R. rubrum oxidiert auch Kohlenmonoxid (CO) mit Wasserstoffgas als Endprodukt des Weges und kann Sulfid in niedrigen Konzentrationen als Elektronendonator bei der Kohlendioxidreduktion verwenden. Darüber hinaus ist es ein stickstofffixierendes Bakterium; es verwendet Nitrogenase, um atmosphärisches Stickstoffgas in Ammoniak umzuwandeln (Munk et al., 2011).
Es gibt mehrere Anwendungen von R. rubrum auf dem Gebiet der Biotechnologie. Es ist ein Modellsystem für die Umwandlung von Licht in chemische Energie und für seine Stickstofffixierungswege. Sie ist auch Gegenstand von Studien zur Strahlenresistenz. Sie kann auch auf verschiedene Weise für den Verbrauch genutzt werden. Die Proteobakterien können eine Quelle für Tierfutter und landwirtschaftliche Düngemittel sein. Eine weitere wichtige Rolle in der Forschung spielt die Produktion von Vitaminen. Sie wird auch für die Produktion von biologischem Kunststoff aus Vorläufern von Polyhydroxybuttersäure erforscht. R. rubrum kann auch zur Herstellung von biologischem Wasserstoff beitragen, hauptsächlich durch die Entwicklung des Enzyms Nitrogenase.
Genomstruktur
Die Sequenzierung des Genoms ist abgeschlossen. Es besteht aus einem zirkulären Chromosom mit 4.352.825 Basenpaaren, von denen 65% Guanin-Cystosin-Paare sind. Außerdem gibt es ein Plasmid mit 53.732 Basenpaaren mit 60 % Guanin-Cytosin. Insgesamt gibt es 3.850 proteinkodierende Gene und 83 RNA-Gene. Von diesen Genen sind 6,9 % mit der Transkription verbunden; 4,6 % mit Translation, Ribosomenstruktur und Biosynthese; 4,0 % mit Replikation, Rekombination und Reparatur; 7,9 % mit Signaltransduktionsmechanismen; 5,9 % mit Zellwand- und Membranbiogenese; 6,6 % mit Energieproduktion und -umwandlung; 5,0 % mit Kohlenhydrattransport und -stoffwechsel; 9.9% Aminosäuretransport und -metabolismus; 4,7% Coenzymtransport und -metabolismus; 3,7% Lipidtransport und -metabolismus; und 6,5% Transport und Metabolismus anorganischer Ionen (Munk et al, 2011).
Ökologie
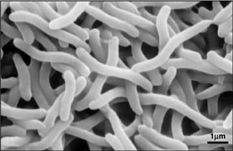
Da Rhodospirillum rubrum sowohl aerob als auch anaerob wachsen kann, ist es in der Lage, eine breite Palette von Bedingungen zu bewohnen. R. rubrum kommt in vielen natürlichen aquatischen Umgebungen wie Teichen, Seen, Bächen und stehenden Gewässern vor (Reslewic et. al, 2005). R. rubrum wird auch häufig im Schlamm und in Abwässern gefunden (Brock et al., 2000). Studien haben gezeigt, dass R. rubrum seine chemische Zusammensetzung stark verändern kann, um sich an verschiedene Umgebungen anzupassen (Cohen-Bazire und Kunisawa, 1963). R. rubrum zieht es vor, in Lebensräumen mit einem pH-Wert von 6,8-7,2 zu wachsen (Bergey und Holt, 1994). Studien haben auch gezeigt, dass R. rubrum eine optimale Wachstumstemperatur von 22-35 Grad Celsius hat (Weaver, 1971).
Zellstruktur und Stoffwechsel
R. rubrum ist ein vielseitiger Organismus, der Energie durch eine Vielzahl von Mechanismen gewinnen kann. Respirations- und Photosynthesemechanismen existieren gemeinsam und ihre Aktivität hängt von der Anwesenheit von Licht und Energie ab. R. rubrum kann in dunklen, chemisch-tropischen Umgebungen mit Sauerstoff oder in einer phototropischen Umgebung ohne Sauerstoff wachsen.
Die Photosynthese in R. rubrum beginnt mit der Spende von Wasserstoff aus einem organischen Substrat an ein oxidierendes Substrat. Bakteriochlorophyll und Cartenoide, die photoreaktiven Pigmente in der Zellmembran, sind an Chromatophoren gebunden (Schachman, Pardee und Stanier, 1952). Chromatophoren sind abgeflachte Scheiben, die Cholinphospholipide, Cardiolipin und Galaktosyldiglyceride enthalten (Benson, Wintermans und Wiser, 1959; Benson 1961). Darüber hinaus enthalten die Chromatophoren eine vollständige Elektronentransportkette mit verschiedenen Cytochromen, Flavin und Pyridinnukleotiden (Newton und Newton, 1957; Hulcher und Conti, 1960; Kamen, 1961). Die Zellmembran enthält auch eine Maschinerie für die ATP-Synthese, einschließlich einer ATP-Synthetase.
In Gegenwart von Sauerstoff ist R. rubrum in der Lage, unter Verwendung einer traditionellen Elektronentransportkette mit NAD+/NADH als primärem Elektronenträger aerob zu atmen (Keister und Minton, 1969). Zu den Elektronentransportproteinen gehört das Cytochrom C428 (Chance und Smith, 1955). Die aerobe Atmung wird jedoch durch die Photosynthese gehemmt (Oelze und Weaver, 1971).
R. rubrum ist auch zur anaeroben Atmung fähig. Seine nicht-sauerstoffhaltigen terminalen Elektronenakzeptoren können Dimethylsulfoxid und Trimethylaminoxid umfassen. Das Vorhandensein dieser Elektronenakzeptoren macht es möglich, dass Substrate wie Succinat, Malat und Acetat das Wachstum von R. rubrum unterstützen. Diese Akzeptoren sind jedoch in Bezug auf die Energieerhaltung nur etwa 33-41% so effizient wie Sauerstoff (Schultz und Weaver, 1982).
Zusätzlich hat R. rubrum die einzigartige Fähigkeit, Kohlenmonoxid mit Hilfe von Kohlenmonoxid-Dehydrogenase zu oxidieren. Dieser Oxidationsweg endet mit der Reduktion von Wasserstoff und der Produktion von Wasserstoffgas.
Ohne einen terminalen Elektronenakzeptor führt R. rubrum die Mischsäuregärung durch. Die Hauptprodukte der Pyruvatgärung sind Acetat, Formiat, Kohlendioxid und Wasserstoff. In Gegenwart von Bicarbonat-Ionen kann auch Fructose vergoren werden. Die Endprodukte dieses Weges sind die gleichen wie die von Pyruvat, aber mit dem Zusatz von Succinat und Propionat (Schultz und Weaver 1982).
Neben der Fähigkeit, Kohlendioxid zu fixieren (Schon und Biedermann, 1972), ist eine identifizierende anabole Eigenschaft von R. rubrum seine Fähigkeit, Stickstoff zu fixieren. Unter dunklen Bedingungen und in Anwesenheit von Fruktose setzt R. rubrum Stickstoffase ein, um Stickstoffgas in Ammonium zu fixieren. Es enthält sowohl Fe-Mo als auch Fe-only-Stickstoffasen.
Pathologie
R. rubrum hat weder Menschen noch Tiere infiziert.
Aktuelle Forschung
Strahlenresistenz
Rhodospirillum rubrum hat kürzlich Einblicke in die Strahlenresistenz gegeben. Felice Mastroleo et al. haben in Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010) die Strahlungstoleranz von R. rubrum charakterisiert.
Indem sie das Bakterium subletalen Dosen von Kobalt-60-Gammastrahlen, einer Art ionisierender Strahlung, aussetzten, wurden die für ionisierende Strahlung spezifischen R. rubrum-Markergene im Organismus charakterisiert. Die Expression dieser Gene nahm mit der „Erholungszeit“ nach einer bestimmten Gammastrahlenbehandlung zu. Die Analyse der Genexpression von R. rubrum nach Gammastrahlung schafft das Potenzial für weitere mikrobiologische Forschung, die in Zukunft zu Fortschritten bei der angewandten Strahlenresistenz führen kann.
Biologisch abbaubare Kunststoffe
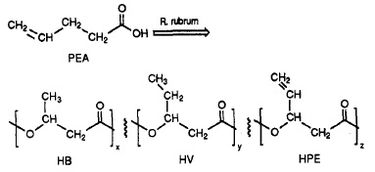
R. rubrum produziert eine Klasse biologisch abbaubarer Kunststoffe, Poly-beta-hydroxyalkanoate (PHA). Die Anwendungen dieser Forschung können viele Probleme lösen, die durch synthetische, nicht abbaubare Kunststoffe verursacht werden, die sich nachteilig auf die Umwelt ausgewirkt haben. Ein Forschungsexperiment, durchgeführt von Herbert. W. Ulmer et al. wurde die Herstellung von PHAs mit 3HV-Einheiten durch Rhodospriillum rubrum beschrieben (1993). Ulmer verwendete 4-Pentensäure (PEA) als Wachstumsmedium für R. rubrum. Wenn das Bakterium unter „PHA-produzierende Bedingungen“ gesetzt wurde, wurden PHAs synthetisiert, die 3 sich wiederholende Untereinheiten enthielten (Anmerkung: R = Substituentengruppe): HB (R = Methyl), HV (R = Ethyl), HPE (R = Vinyl) (siehe Abbildung 1).
Die Synthese funktioneller, biologisch abbaubarer Kunststoffe durch Bakterien hat das Potenzial, die globale Umweltverschmutzung und die Treibstoffkosten von Plastikfabriken zu reduzieren. R. rubrum kann als mikrobiologisches Werkzeug zur Herstellung umweltfreundlicher Biopolymere eingesetzt werden.
Erneuerbare Energie
Die zunehmende Besorgnis über die Umweltverschmutzung durch die Verbrennung fossiler Brennstoffe hat zu einem Anstieg der Forschung an Rhodospirillum rubrum geführt. Die Verwendung von R. rubrum als Quelle für Wasserstoff, der in erneuerbaren Wasserstoffkraftstoffen verwendet werden soll, löst mehrere Probleme, die durch den Verbrauch fossiler Brennstoffe entstehen. Wasserstoff oxidiert zu Wasser als Verbrennungsprodukt, im Gegensatz zu fossilen Brennstoffen, die Schadstoffe wie CO, CO2, SOx und NOx erzeugen. R. rubrum kann durch die folgende „Wasser-Gas-Verschiebungsreaktion“ (Najafpour et al., 2004) Wasserstoff erzeugen:
CO + H2O → H2 + CO2
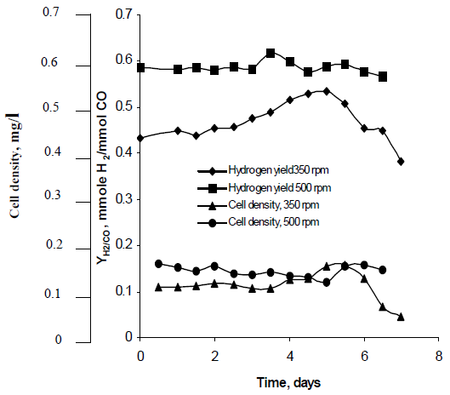
Najafpours Forschungsmethode beobachtete, wie die Rührgeschwindigkeit, die durch Turbinenlaufräder mit einer Geschwindigkeit von 350 U/min und 500 U/min erzeugt wurde, die Wasserstoffproduktionsraten von R. rubrum beeinflusste. Seine Untersuchungen ergaben, dass Wasserstoff als Kraftstoff das Potenzial hat, die globale Erwärmung einzudämmen und eine umweltfreundliche technologische Lösung für die Kraftstoffproduktion und den Kraftstoffverbrauch zu bieten. Seine Studie ergab, dass eine höhere Umdrehungszahl zu einer höheren Wasserstoffproduktion und Zelldichte von R. rubrum führte (siehe Abbildung 2).
In einer anderen mikrobiologischen Studie, die von Matthew Ross Melnicki durchgeführt wurde, wurde festgestellt, dass R. rubrum das Potenzial für erneuerbare Energien, wie z. B. Wasserstoffkraftstoff, durch Wasserstoffsynthese bietet. Seine biologischen Wege können hohe Wasserstoffmengen produzieren, wenn es zusammen mit Chlamydomonas reinhardtii kultiviert wird, einer Algenart, mit der R. rubrum harmonisch wachsen kann. Melnicki schlug einen unkonventionellen Co-Kultivierungsansatz für die Wasserstoffsynthese vor, der zu einer erhöhten Wasserstoffsynthese führt, die bei einer entkoppelten Co-Kultivierung nicht erreicht werden kann. C. reinhardtii wurde bei höheren Lichtintensitäten begünstigt, während R. rubrum bei niedrigeren Lichtintensitäten produktiver war, was die Vorteile ihrer Co-Kultivierung hervorhebt.
Bei der Kultivierung von R. rubrum mit einer Fed-Batch-Technik wurde festgestellt, dass beimpfte Kulturen während der exponentiellen Wachstumsphase Wasserstoff produzierten, und die Wasserstoffsynthese florierte 70 Stunden lang kontinuierlich weiter. Als das Wachstum aufhörte, fügte Melnicki Succinat hinzu, das als Elektronendonator im Stoffwechselweg fungiert, und die Wasserstoffentwicklung wurde wieder aufgenommen, obwohl die Bakterien nun nicht mehr wuchsen. Es ist jedoch wichtig zu wissen, dass bei kontinuierlicher Zugabe von Succinat die Wasserstoffentwicklungsraten sanken. Sobald zusätzliches Wachstumsmedium zugegeben wurde, stiegen die Wasserstoffproduktionsraten wieder an.
Melnicki erklärte außerdem: „Obwohl Wachstum für die Wasserstoffproduktion nicht erforderlich ist, belegt diese Arbeit die Notwendigkeit von Zellwachstum, um maximale Raten aufrechtzuerhalten, was auf die industrielle Eignung einer halbkontinuierlichen Kulturstrategie hindeutet“ (Melnicki, 2009).
Cool Factor
Die Genomsequenz von Rhodospirillum rubrum ist nach R. centenum erst die zweite der Gattung Rhodospirillum, die veröffentlicht wurde (Munk et al, 2011).

Ein interessanter Aspekt von Rhodospirillum rubrum ist seine Fähigkeit, unter verschiedenen Bedingungen die Farbe zu wechseln. Es ist ein anoxygenes Phototroph, produziert aber keinen extrazellulären Sauerstoff. Stattdessen produziert es bei der Lichtsammlung elementaren Schwefel. Dies ist darauf zurückzuführen, dass R. rubrum der Lichtsammelkomplex 2 fehlt (Munk et al., 2011). Das Bakterium verwendet Bakteriochlorophyll, das es ihm ermöglicht, Wellenlängen des Lichts zu absorbieren, die Pflanzen nicht nutzen. Bakteriochlorophyll absorbiert Wellenlängen von 800-925 nm.
Unter aeroben Bedingungen ist die photosynthetische Aktivität von R. rubrum genetisch unterdrückt, und das Bakterium wird farblos. Unter anaeroben Bedingungen wird die Photosynthese jedoch aktiviert und das Bakterium nimmt eine deutlich violett-rote Farbe an (siehe Abbildung 5). Der Grund dafür ist die Aktivität der Chromatophoren, die sich in der Membran befinden (Munk et al., 2011). Die Chromatophoren enthalten die Bakteriochlorophyll-Pigmente des Bakteriums und verändern ihre Absorption während der Aktivierung der Photosynthese.
Benson, A. „Chloroplast lipid metabolism.“ In Symposium no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (In the Press.)
Benson, A., Wintermans, J. und Wiser, R. „Chloroplast lipids as carbohydrate reservoirs.“ Plant Physiology. 1959. Volume 34. p. 815.
Bergey, D. and Holt, J. Bergey’s manual of determinative bacteriology. Ninth edition. Baltimore. Lippincott Williams and Wilkins. 1994. S. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, and J Parker. Biologie der Mikroorganismen. 9th Edition. Upper Saddle River: Prentice Hall, 2000. p. 459.
Chance, B. and Smith, L. „Atmungspigmente von Rhodospirillum rubrum“. Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. und Kunisawa, R. „The Fine Structure of Rhodospirillum Rubrum .“ Journal of Cell Biology. 1963. Volume 16. p. 401-419.
Hulcher, M. and Conti, S. „Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum.“ Biochemistry and Biophysics Research Communications. 1960. Volume 3. p. 497.
Kamen, M. „The Haem Proteins of Photosynthetic Tissues.“ In Symposium no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (In the Press.)
Keister, D. und Minton, N. „Energy-linked reactions in photosynthetic bacteria. 3. Further studies on energy-linked nicotinamide-adenine dinucleotide reduction by Rhodospirillum rubrum chromatophores.“ Biochemistry. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. „Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods“. COSPAR Scientific Assembly. 2010. S. 4.
Melnicki, M. R. „Modes of hydrogen production in the photosynthetic bacterium, Rhodosphirillum rubrum“. University of California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. „Complete genome sequence of Rhodospirillum rubrum type strain (S1T)“. Standards in Genomic Sciences. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. „Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum“. Afrikanische Zeitschrift für Biotechnologie. 2004. Volume 3. pp. 503-507.
Newton, J. and Newton, G. „Composition of the photoactive subcellular particles from Chromatium.“ The Archives of Biochemistry and Biophysics. 1957. Volume 71. p. 250.
Oelze, J. and Weaver, P. „The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions.“ The Archives of Microbiology. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., and Schwartz, D. „Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .“ Angewandte und Umweltmikrobiologie. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., und Stanier, R. „Studies on the macromolecular organization of microbial cells.“ The Archives of Biochemistry and Biophysics. 1952. Volume 38. p. 245-260.
Schön, G. and Biedermann, M. „Synthesis of volatile acids by fermentation of pyruvate and fructose in anaerobic dark cultures of Rhodospirillum rubrum.“ Archiv für Mikrobiologie.1972. Band 85. S. 77-90.
Schultz, J. und Weaver, P. „Fermentation and anaerobic respiration by Rhodospirillum rubrum and Rhodopseudomonas capsulate.“ The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., and Lenz, R. „Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum“. Macromolecules. 1994. Volume 27. p. 1675-1679.
Weaver, P. „Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum.“ Proceedings of the National Academy of Sciences of the United States of America. 1971. Band 68. S. 136-138.
Bearbeitet von Studenten von Dr. Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen, und Jessica Wong.
NEUF2011