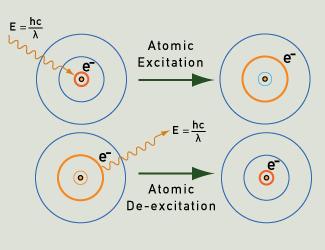
Fotões de luz são emitidos enquanto um electrão cai de volta ao seu estado de terra após ser excitado.
Testes de chama
Testes de chama são úteis porque as excitações de gás produzem um espectro de emissão de linha de assinatura para um elemento. Em comparação, a incandescência produz uma faixa contínua de luz com um pico dependente da temperatura do objecto quente.
Quando os átomos de um gás ou vapor são excitados, por exemplo através do aquecimento ou da aplicação de um campo eléctrico, os seus electrões são capazes de passar do seu estado de terra para níveis de energia mais elevados. Ao retornarem ao seu estado de terra, seguindo caminhos claramente definidos de acordo com probabilidades quânticas, eles emitem fótons de energia muito específica. Esta energia corresponde a comprimentos de onda de luz particulares, e assim produz cores de luz particulares. Cada elemento tem uma “impressão digital” em termos do seu espectro de emissão de linhas, como ilustrado pelos exemplos abaixo.

Espectro de linha para hidrogênio.

Espectro de linha para hélio.

Espectro da linha para néon.
Porque cada elemento tem um espectro de emissão de linha exactamente definido, os cientistas são capazes de os identificar pela cor da chama que produzem. Por exemplo, cobre produz uma chama azul, lítio e estrôncio uma chama vermelha, cálcio uma chama laranja, sódio uma chama amarela e bário uma chama verde.

Esta imagem ilustra as cores distintas produzidas pela queima de elementos particulares.

Uma chama de uma tocha de oxiacetileno queima a mais de 3000?C, quente o suficiente para ser usada em soldadura subaquática.
Chama
Cor nos informa sobre a temperatura de uma chama de vela. O núcleo interior da chama da vela é azul claro, com uma temperatura de cerca de 1670 K (1400 °C). Essa é a parte mais quente da chama. A cor no interior da chama torna-se amarela, laranja e finalmente vermelha. Quanto mais longe se chegar do centro da chama, mais baixa será a temperatura. A parte vermelha fica em torno de 1070 K (800 °C).
As cores laranja, amarelo e vermelho em uma chama não se relacionam apenas com a temperatura da cor. As excitações de gás também desempenham um papel importante na cor da chama. Um dos principais constituintes de uma chama ardente é a fuligem, que tem uma composição complexa e diversificada de compostos de carbono. A variedade destes compostos cria uma gama praticamente contínua de possíveis estados quânticos para os quais os electrões podem ser excitados. A cor da luz emitida depende da energia emitida por cada elétron retornando ao seu estado original.