Foi realizado um programa de pesquisa para melhorar a tecnologia de processamento para extração de alumina de não-bauxíticos. O sucesso desse programa forneceu a tecnologia necessária para produzir um suprimento adequado de alumina de alta qualidade de fontes domésticas, atendendo assim às necessidades econômicas e estratégicas nacionais relativas à produção de alumínio. O processo de ácido clorídrico para a recuperação de alumina a partir de minérios de baixa qualidade é um dos processos em estudo no programa de pesquisa.
Uma fase deste processo utiliza o efeito da concentração de íon clorídrico na solubilidade do íon de alumínio em solução. A 25° C, a solubilidade do AlCl3 em água pura é de aproximadamente 31 pct por peso, e diminui com o aumento da concentração de ácido clorídrico (HCl), tornando-se 0,1 pct quando a concentração de HCl é aumentada para 37 pct. Este comportamento tem sido objeto de inúmeras investigações, processos e patentes. Assim é possível lixiviar um minério não-báuxitico com HCl, decantar e filtrar o licor, e adicionar HCl gasoso para precipitar o AlCl3-6H2O. A solução ácida restante pode então ser utilizada para lixiviar minério adicional e o AlCl3-6H2O precipitado pode ser calcinado para obter o Al2O3 . Uma extensa discussão e avaliação deste processo é apresentada por Peters, Johnson e Kirby. Os dados termodinâmicos, como as atividades iônicas e as solubilidades, necessários para a análise completa, interpretação e melhoria deste processo são escassos, e os dados de solubilidades existentes são limitados a uma estreita faixa de temperatura. Portanto, os objetivos desta investigação foram (1) determinar a solubilidade do AlCl3, em uma faixa de temperatura de 25° a 85° C com concentração de HCl de 0,0 a 37.2 pct; (2) calcular as atividades de AlCl3 e de H2O em soluções contendo diversos eletrólitos, e a constante de equilíbrio para a dissolução de AlCl3-6H2O; e (3) sugerir áreas de pesquisa para geração de dados úteis.
- Aparatus
- Procedimento experimental
- Análise
- Resultados
- Comparação com outros dados
- Termodinâmica Tratamento
- Solubilidade Produto e Atividades no Sistema AlCl3-6H2O-H2O
- Estimativa de atividades no sistema AlCl3-6H2O-H2O
- Produto e atividades de solubilidade no sistema AlCl3-6H2O-HCl-H2O
- Estimativa de Atividades no Sistema AlCl3-6H2O-HCl-H2O
- AlCl3-FeCl3-KCl-NaCl-HCl-H2O Sistema
- Areas Recomendadas para Pesquisa
- Cloreto de alumínio em soluções aquosas de ácido clorídrico
Aparatus
O aparelho utilizado para medições de solubilidades é mostrado na figura 1. Um frasco de 100 ml, A, contém uma solução de eletrólitos e algum excesso de sal. Um filtro de vidro frito, B, fundido num tubo de pirex de 6 mm de diâmetro é unido a um tubo externo ligado a duas torneiras de teflon, D e E. O conjunto superior é ligado a A em C por um encaixe de compressão de nylon roscado com um anel 0 de neoprene. Um tubo de polietileno de 6 mm-OD, F-L, entrega uma amostra da solução filtrada em B no segundo frasco, K, quando A é pressurizado através da torneira D, e E é aberto. O encaixe em J é semelhante ao de C. Os frascos são fixados em uma barra, G, que é ligada a um mecanismo de balanço, com H como eixo de balanço para agitar os frascos, A e K, alternadamente para cima e para baixo. Um termostato coberto, 0, é controlado a ±0,2° C. Um controle de temperatura mais próximo é desnecessário, pois a solubilidade é uma função muito fraca da temperatura.
Procedimento experimental
Medições de solubilidades a 25°, 45°, 65° e 85° C foram feitas sob condições de equilíbrio de fase com materiais analíticos de grau de reagent-grade. Quantidades apropriadas de AlCl3-6H2O, solução de HCl 37-pct e água destilada foram colocadas no frasco A para formar aproximadamente 90 ml de solução com uma pequena quantidade de cristais de sal em excesso (doravante “sal” refere-se ao cloreto de alumínio hexaidrato). As quantidades de materiais foram estimadas a partir dos dados de solubilidade existentes no sistema ternário AlCl3-6H2O-HCl-H2O. Depois que a solução foi formada no frasco A e o aparelho foi montado, ele foi imerso na água até o nível N, e o termostato foi ajustado para a temperatura desejada. Uma agitação mecânica contínua dos frascos foi utilizada durante cada rodada com duração de 2 a 3 dias. Periodicamente, também foi utilizada uma vigorosa agitação manual para garantir
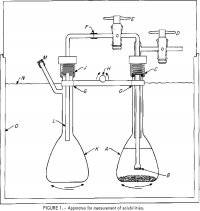
equilíbrio, particularmente se o sal pudesse formar um sal sólido complexo com HCl. No final do período de equilíbrio, os frascos foram deixados sem movimento na posição vertical durante 1 hora para assegurar o assentamento das partículas sólidas. As torneiras D e E foram então abertas para transferir aproximadamente metade da solução para o frasco de amostragem, K. O nível de B abaixo do líquido em A normalmente determinou a quantidade de solução transferida para K. O peso da solução em K foi determinado pela pesagem do frasco antes da montagem e após a admissão da solução e desmontagem. Uma quantidade conhecida de água destilada foi injetada no frasco através de L para diluir a amostra e dissolver qualquer vapor na fase gasosa. A pressão parcial de HCl em água pura excede 1 torr a 25° C em molidades superiores a 8 m (m após um número em uma frase denota molal); portanto, em concentrações inferiores a 8 m, é duvidoso que qualquer perda de HCl possa ocorrer durante a amostragem. Por essa razão, algumas das análises a 25° C, contendo menos de 4 m de HCl, foram feitas com um único frasco rompido e, após o equilíbrio, uma porção da solução foi cuidadosamente decantada e filtrada para amostragem.
Análise
As soluções foram analisadas após diluições apropriadas para as concentrações totais de clorido-íon e alumínio-íon. A concentração total de clorido-íon foi determinada por titulação potenciométrica com Ag+. A concentração de Al+++ foi determinada primeiro pela complexação com um excesso de ácido etilenodiamina-tetracético (EDTA) e depois pela titulação posterior do excesso de EDTA com Cu++ a um pH de 3,8,
O teor de AlCl3 foi calculado a partir da análise de Al++++. A subtração do íon clorido-ion na quantidade calculada de AlCl3 da concentração total de íon clorido-ion permitiu o cálculo da concentração de HCl nas soluções saturadas.
Este método de cálculo foi utilizado para todas as análises, exceto aquelas em que a concentração de HCl era conhecida como sendo zero, ou seja, quando AlCl3 era o único eletrólito em água pura. Para essas análises, a concentração de AlCl3 foi simplesmente calculada a partir da análise clorido-ion, que foi a mais precisa das duas análises, embora ambas as análises Al+++ e Cl- ainda tenham sido concluídas para essas amostras.
A diferença na análise Cl- calculada a partir da análise Cl- total e Cl- da análise Al++++ para experimentos sem adição de HCl foi de ±0,2 wt-pct Cl-. Isso indica que, em média, a análise de Al+++ estava sujeita a +0,05 wt-pct de erro, uma vez que a análise Cl era conhecida por ser consideravelmente mais precisa do que a análise Al+++. Em soluções contendo HCl, um erro de ±0,05 por cento no conteúdo de Al+++ foi refletido como ±0,20 pct no conteúdo de HCl; isto porque, enquanto o conteúdo total de Cl foi muito preciso, o Cl contribuiu com HCl adicionado e, portanto a molalidade do HCl, foi computado por diferença como mencionado anteriormente.
Resultados
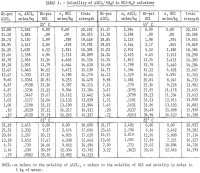
Os resultados estão resumidos na tabela 1 e mostrados na figura 2. A concentração máxima de HCl para os dados apresentados na tabela 1 para 85° C é de aproximadamente 30 wt-pct. As medições foram interrompidas nesta concentração devido às pressões excessivas de equilíbrio no sistema em concentrações mais elevadas. Deve-se notar também que foram realizadas menos determinações a 65° e 85° C do que a 25° e 45° C. As réplicas foram realizadas nas duas temperaturas mais baixas para dar uma indicação de repetibilidade satisfatória dos resultados. A Figura 2 mostra que a solubilidade do sal de alumínio diminui drasticamente com o aumento da concentração de HCl. Portanto, a lixiviação de minérios não-bauxíticos com solução de HCl e a precipitação do sal puro para extração do alumínio pela adição de HCl é um processo viável; tal processo tem sido objeto de várias patentes. Os resultados mostram que a solubilidade não muda muito com a temperatura, e para um aumento de temperatura de 60° C (25° a 85° C), a solubilidade do sal puro sozinho em água aumenta apenas 2,2 pct em relação à solubilidade a 25° C.
Comparação com outros dados
A solubilidade do sal puro em água a 25° C foi encontrada concordando exatamente com os dados de Palitzch e com Ehret e Frere. Os resultados dados por Malquori são cerca de 10 pct mais altos. A solubilidade obtida por Tanaka é cerca de 3,3 pct maior do que na presente investigação a 45° e a 65° C.
O efeito do HCl na água na solubilidade do sal foi investigado por Seidel e Fisher a 0° C e por Malquori a 25° C. Os resultados dos primeiros investigadores a 0° C concordam muito com os dados da tabela 1, extrapolados para 0° C, enquanto que os do último investigador a 25° C dispersam um pouco e discordam aproximadamente por 3 pet em baixas concentrações de HCl; entretanto, a concordância na faixa de 5 a 30 wt-pct de HCl está dentro de 1 pct.
Termodinâmica Tratamento
Solubilidade Produto e Atividades no Sistema AlCl3-6H2O-H2O
O coeficiente Y12 de atividade iônica do AlCl3 na água foi medido até 1,8 m por Mason, e os valores recalculados são dados por Robinson e Stokes. Como o coeficiente de atividade de 1,8 m até o valor de saturação de 3,3835 m deve aumentar mais de cinco vezes, o valor de saturação é usado para cálculo pelo método descrito em detalhes em um relatório anterior (1 m = 1 mole em 1 kg de solvente). O método, com sua aplicação nova apropriada, é resumido brevemente neste relatório. A atividade iônica média de AlCl3, designada como a12, é expressa pela seguinte série de potências em termos de molalidade m:
 >
>
A equação correspondente para a atividade da água aw, é obtida pela aplicação da relação Gibbs-Duhem; o resultado é
![]()
Nota que os expoentes de m com os mesmos coeficientes de C, D, etc, são 1 maior na equação 2 do que na equação 1, e o coeficiente de m na equação 2 tem origem na teoria de Debye-Huckel como discutido por Gokcen.
A reação para dissolução do sal é
AlCl3-6H2O (S) = Al++++ + 3Cl- + 6H2O (l),………………………….(3)
onde (s) significa sólido e (l) líquido.
A constante de equilíbrio correspondente é
![]()
onde o denominador, a atividade do sólido, é tomado como unidade, já que sua composição permanece inalterada quando outros eletrólitos são adicionados em solução. Substituímos a12 em 1n Kp diretamente da equação 1 e por aw da equação 2 após multiplicar a equação 2 por 0,108093 para fazer com que o coeficiente de 1n aw seja igual a 6. Como Kp é independente da composição, fica evidente que
![]()
Após as substituições necessárias das equações 1 e 2 e depois a substituição do valor médio m = 3.3835 das duas primeiras corridas da tabela 1, obtém-se uma equação para resolver os seis coeficientes desconhecidos da equação 1, e as cinco equações restantes são obtidas pela substituição de cada um dos cinco valores experimentais do coeficiente de atividade iônica média de AlCl3 , y12 da tabela 2, por
![]()
e depois pela substituição de cada resultado da equação 1. Seis equações simultâneas obtidas desta forma são então resolvidas por computador. Os resultados são os seguintes:
C = -57.5723,
D = +142.0288,
E = -202.5581,
F = +161.1919,
G = -67.7831,
e H = +11.6880.
Substituição destes valores nas equações 1, 2, e 4 produz os valores de Y12, aw, e Kp. Os resultados estão listados na tabela 3 sob o título “Resultados do Bureau:”. Deve-se notar que a atividade da água pode agora ser calculada a partir da equação 2, e a pressão de vapor da água sobre a solução, P, de
aw = P/P°,……………………………….(7)
onde P° é a pressão de vapor da água pura à mesma temperatura. Note que a pressão de vapor da água sobre a solução saturada é um pouco mais da metade da pressão sobre a água pura desde aw = 0,509. Os resultados anteriores constituem o primeiro conjunto de dados sobre atividades baseadas na solubilidade do sal.
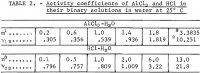
Nota.- Nesta tabela, m refere-se à molalidade de AlCl3, n refere-se à molalidade de HCl, e molalidade é moles em 1 kg de água.
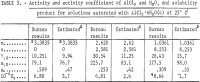
Nota.-Nesta tabela, m refere-se à molalidade de AlCl3, n refere-se à molalidade de HCl, e molalidade é moles em 1 kg de água.
Estimativa de atividades no sistema AlCl3-6H2O-H2O
Dois métodos confiáveis de estimativa existentes são usados para obter as atividades no sistema AlCl3-6H2O-H2O além dos dados experimentais diretos existentes em m = 1,8. O primeiro método, como descrito por Kusik e Meissner, dá um valor estimado de γ12 = 9,94 a 3,3835 m. Este valor estimado está de acordo com 10,251, o valor obtido na presente investigação. O valor estimado correspondente da actividade da água, aw, é de 0,47, novamente de acordo com o valor de 0,509 encontrado na presente investigação. A constante de equilíbrio Kp calculada a partir destes valores não está longe de 6,8 x 10 5, considerando o fato de que a quarta potência de a12 e a sexta potência de aw são multiplicadas para obter Kp.
O segundo método de estimação devido a Bromley rende 10,42 para γ12, um valor mais próximo do obtido pelo método anterior. O coeficiente de atividade da água foi obtido pelos autores atuais, integrando a equação de Gibbs-Duhem na qual foram utilizados os valores de a12 estimados pelo método de Bromley. O resultado é aw = 0,540. A média de ambos os métodos é 0,505, o que está em muito boa concordância com o valor de 0,509 do Bureau. O método de Bromley, entretanto, não contém um método conveniente para determinação de aw incluído no método Kusik-Meissner.
A concordância dos valores estimados com os valores dos dados de solubilidade nem sempre é tão boa quanto mostrado aqui para cada eletrólito em cada composição. Por exemplo, mesmo para AlCl3 a 1 m, as duas estimativas de γ12 diferem apenas 13% uma da outra.
Produto e atividades de solubilidade no sistema AlCl3-6H2O-HCl-H2O
O efeito do aumento da concentração de HCl na solubilidade do sal é em grande parte devido ao aumento da concentração dos íons cloreto. A constante de equilíbrio neste caso com as atividades a1 e a2 de íons individuais é
![]()
onde γ12 = γ1γ2 por definição de γ12 das atividades iônicas individuais γ1 (para Al+++) e γ2 (para Cl-), e n é a molalidade do HCl. O valor de Kp é o mesmo da equação 4, mas o lado direito da equação 8 é diferente do da equação 4. Pode-se notar que conforme n aumenta, m, a concentração de Al+++, deve diminuir, desde que γ12 e aw não diminuam muito; portanto, o sal precipita para fora, o que é conhecido como efeito salinizador.
O cálculo das atividades na solução ternária requer uma equação semelhante à equação 1 para HCl. Como os dados para HCl são conhecidos com precisão em uma ampla faixa de concentração, é possível tomar uma equação com tantas variáveis quanto desejado. A seguinte equação dá uma representação precisa dos dados para o coeficiente de atividade do HCl, γ32 onde o subscrito 3 é para H+ e 2 para Cl-:
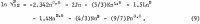
Os dados selecionados para este fim de Haase, Naas e Thutnm estão listados na terceira e quarta linhas da tabela 2. Os valores dos coeficientes calculados a partir destes dados são os seguintes:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
e P = +0,02634.
As equações para as atividades de AlCl3 e de H2O contêm estes coeficientes assim como os coeficientes dos produtos cruzados (m h/2)(n k/2), onde h e k são números inteiros, e estas equações são as seguintes:
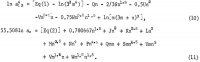
Os cinco coeficientes adicionais nestas equações são determinados pela adição das equações 10 e 6 1n aw da equação 11 para obter 1n Kp e usando os seguintes dados de solubilidade selecionados da tabela 1:
m: 2.620, 2.016, 1.333, 0.953, e 0.535.
n: 2.581, 4.460, 6.780, 8.397, e 10.063.
Os cálculos resultantes produzem os seguintes valores dos coeficientes nas equações 10 e 11:
Q = +23.27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
e W = +4,60246,
Os resultados para γ12, a12, aw, e Kp calculados a partir das equações anteriores estão listados na tabela 3. Os valores de γ12 da equação 9 estão de acordo com os de Harned e Gary em concentrações muito baixas de HCl e AlCl3.
A pressão parcial de HCl(g), P32, sobre uma solução pode ser calculada a partir da seguinte equação (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
onde Kp(HCl) é a constante de equilíbrio a 25° C para H+ + Cl- = HCl(g), e a32 é a atividade iônica média de HCl em solução. Para isso, é necessário escrever uma equação para a32, semelhante à equação 10, usando os parâmetros da equação 11, como mostrado em detalhe.
O efeito da temperatura sobre a solubilidade do sal é pequeno, como mostrado na tabela 1. O efeito sobre as atividades iônicas é, portanto, pequeno, pois todos os parâmetros da equação 11 poderiam ter sido obtidos a partir dos dados de solubilidade se o erro experimental fosse menor que ±0,01 wt-pct para análise do alumínio. Em geral, para uma faixa de temperatura até aproximadamente 80° C, cada parâmetro é uma função linear de temperatura, e esta dependência pode ser determinada se a equação 11 fosse conhecida em outra temperatura pelo menos 50° C superior a 25° C.
Estimativa de Atividades no Sistema AlCl3-6H2O-HCl-H2O
Os valores das atividades, coeficiente de atividade e produto de solubilidade estimado no presente relatório de acordo com o método desenvolvido por Kusik e Meissner, estão listados na tabela 3. O coeficiente de atividade γ12 para AlCl3 é aproximadamente o dobro do valor estimado para as soluções selecionadas contendo HCl. A atividade da água, aw, entretanto, concorda bem com os valores estimados, exceto para m = 2,620. É evidente que os cálculos teriam sido consideravelmente mais confiáveis se a pressão de vapor da água, aw, fosse medida porque aw entra em Kp como aw, de modo que pequenos erros em aw causam grandes erros em γ12 e Kp . Para este propósito, um número limitado de medições de pressão de vapor é recomendado para testar a precisão dos cálculos atuais e os métodos de estimação.
A dependência da temperatura das propriedades termodinâmicas listadas na tabela 3 pode ser estimada como descrito por Kusik e Meissner. Contudo, é provável que a estimativa produza um maior grau de dependência da temperatura do que o indicado pela fraca dependência da solubilidade da temperatura. Nenhuma tentativa poderia ser feita para calcular o efeito da temperatura pelo método do Bureau porque (1) a12 em baixas concentrações de AlCl3 não é conhecido em várias temperaturas, (2) a solubilidade de AlCl3 não pôde ser determinada com uma precisão próxima de 0,01 pct em Al+++, e (3) a faixa de concentração de HCl a 65° e 85° C é muito pequena para selecionar um número suficiente de dados de solubilidade muito diferentes para AlCl3 para determinar com precisão os parâmetros nas equações 10 e 11.
AlCl3-FeCl3-KCl-NaCl-HCl-H2O Sistema
Dados preliminares sobre solubilidades de AlCl3, FeCl3 , KCl e NaCl em soluções aquosas contendo 24 a 31 wt-pct de HCl a 25° C foram obtidos para avaliar a contaminação de AlCl3-6H2O extraível de minérios não-bauxíticos. Para este fim, 2 litros de uma solução contendo quantidades conhecidas de sais foram preparados, 90 ml desta solução foram colocados em um frasco para cada série e então uma quantidade conhecida de HCl gasoso foi admitida para atingir 24 a 31 ppm de HCl dissolvido. Nesta faixa de HCl em solução, cristais anisotrópicos incolores de AlCl3-6H2O, cristais anisotrópicos brilhantes de FeCl3-2KCl-H2O, e cristais transparentes isotrópicos cúbicos de KCl e NaCl foram precipitados e identificados por exame microscópico. O procedimento e as análises para as concentrações de alumínio-ion e clorido-ion foram os mesmos utilizados para o sistema AlCl3-6H2O-HCl-H2O apresentado anteriormente neste relatório. Além disso, a concentração de íon férrico foi determinada pela titulação padrão de K2Cr2O7, a concentração de íon sódio foi determinada por técnicas de absorção atômica e a concentração de íon potássio foi determinada por subtração da concentração de íon sódio a partir da determinação da concentração combinada de íon potássio mais íon sódio após a separação por troca iônica. Os resultados estão listados na tabela 4 e plotados na figura 3. Resultados semelhantes por Miles também são plotados na figura 3 para mostrar que a concordância é excelente. Dados publicados para sistemas mais simples relacionados contendo menos componentes foram compilados por Linke.
No processo de cristalização evaporativa ou de gás HCl sparging para produzir cloreto de alumínio hexa-hidratado puro, a contaminação por outros cloretos metálicos torna-se um problema à medida que os níveis de impureza se acumulam em soluções de lixiviação. A Figura 3 mostra os níveis de concentração que impurezas como NaCl, KCl e FeCl2-2KCl-H2O também se cristalizam a partir da solução como fases separadas distintas, causando assim a contaminação dos cristais de AlCl3-6H2O. Por exemplo, a menos de 2,4 wt-pct FeCl3 na presença de 1,6 wt-pct KCl a 25° C, a concentração de HCl deve ser inferior a 28 wt-pct para evitar a contaminação de AlCl3-6H2O pelo sal duplo, FeCl3-2KCl-H2O. A figura 3 também é útil na redissolução da recristalização fracionada precipitada para purificar o sal de alumínio. Além disso, alguns dos sais dos elementos de transição, como o FeCl3, podem ser minimizados por eletrólise parcial para aplacar uma quantidade suficiente de ferro antes da acidificação com HCl.
Um tratamento termodinâmico do sistema com o erro usual de ±0,05 wt-pct na concentração de íons cloreto não é viável, particularmente na ausência de dados de pressão de vapor para H2O(g) e HCl(g). Entretanto, estimativas aproximadas das atividades podem ser feitas pelo método de Kusik-Meissner. Espera-se que tais estimativas possam dar apenas valores aproximados das atividades para os sais hidratados e complexos e para a água.

Areas Recomendadas para Pesquisa
As medições das atividades são úteis na interpretação da termodinâmica e cinética da lixiviação, precipitação e purificação dos componentes desejados de vários minérios. Existem duas razões para que as actividades possam ser determinadas com precisão a partir das medições da pressão de vapor da água: (1) A pressão de vapor pode ser medida com um alto grau de precisão por transdutores de pressão diferencial para obter aw pela equação 7 e depois calcular os valores dos parâmetros da equação 11 para que todas as propriedades relacionadas possam ser computadas como discutido anteriormente em detalhes (2) O produto de solubilidade e as atividades podem ser ambos determinados com precisão para sais multivalentes que contêm um grande número de moléculas de água em seus cristais hidratados. A segunda razão surge do fato de que o expoente da atividade da água na equação 4 é igual aos moles de água no cristal hidratado.
Cloreto de alumínio em soluções aquosas de ácido clorídrico
Outro tipo interessante de experimento para o sistema ternário discutido aqui é a medição da pressão parcial de HCl(g) sobre várias soluções contendo quantidades suficientemente grandes de HCl dissolvido. O procedimento experimental para este fim é descrito em outra parte. O Grupo IIA, IIIA e os sais metálicos de transição são excelentes candidatos para estes tipos de investigações, uma vez que eletrólitos com valências superiores a 1:1 geralmente formam sais hidratados.
A solubilidade e a atividade do cloreto de alumínio hexa-hidratado, AlCl3-6H2O, em soluções aquosas foram determinadas como parte da pesquisa do Bureau of Mines, Departamento do Interior dos Estados Unidos, para melhorar a tecnologia de processamento mineral para recuperação de alumina de recursos domésticos de baixo grau. A solubilidade do AlCl3 em água pura foi encontrada em 31,09 e 31,77 wt-pct a 25° e 85° C, respectivamente, e diminuiu drasticamente para 10 e 0,1 wt-pct quando as respectivas quantidades de 20,3 e 37 wt-pct de ácido clorídrico (HCl) foram adicionadas em solução. A constante de equilíbrio para a solubilidade do hexa-hidrato, atividades e coeficientes de atividade de AlCl3 e H2O foram calculados e comparados com os resultados dos métodos de estimação disponíveis. Os resultados demonstraram ser úteis na lixiviação de minérios não-báuxicos para extração de alumina, alterando as solubilidades dos sais componentes após adição de HCl.
Solubilidades simultâneas de AlCl3 , FeCl3, KCl e NaCl em soluções de HCl-H2O também foram determinadas e seus efeitos na pureza de AlCl3-6H2O cristalizado a partir de soluções mistas de sal são brevemente discutidos.