Uma página de Bioreal Microbial sobre o gênero Rhodospirillum rubrum
Classificação
Taxas de ordem superior
Reino: Bactérias
Filo: Proteobactérias
Classe: Alfaproteobactérias
Ordem: Rhodospirillales
Família: Rhodospirillaceae
Génus: Rhodospirillum
Espécie
Rhodospirillum rubrum
Descrição e significado
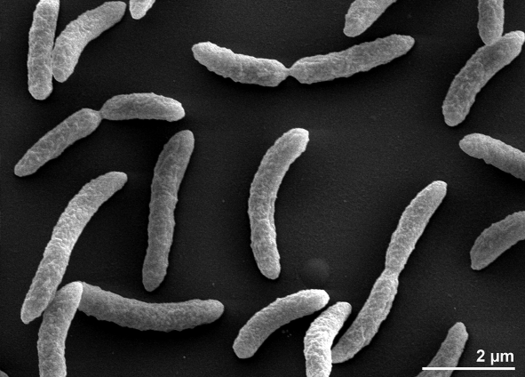
Rhodospirillum rubrum é um Gram-negativo, mesofilicproteobactérias. Sua temperatura ótima de crescimento é de 25-30 graus Celsius. Possui envoltórios externos multicamadas, que contêm principalmente gorduras insaturadas, mas algumas saturadas em sua parede celular. R. rubrum é uma espiral, o que significa que tem uma forma espiralada. Ele é polarmente flagelado e, portanto, motilado. Seu comprimento é de 3-10 um, com uma largura de 0.8-1.0 um.
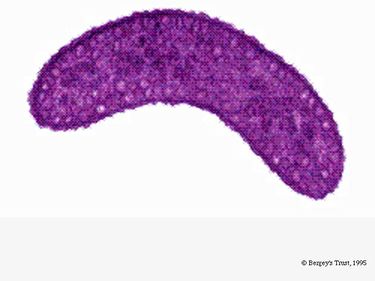
R. rubrum é um anaerobe facultativo. Dependendo da presença de oxigénio, pode ser submetido a fermentação alcoólica ou respiração aeróbica. Também é capaz de fotossíntese e contém carotenóide e baterioclorofila nas suas partículas cromatóforas. Estas moléculas ajudam a absorver a luz e a convertê-la em energia e também lhe conferem a sua cor vermelho-púrpura distinta em condições anaeróbias. R. rubrum é incolor em condições aeróbicas.
Apesar de a fotossíntese ser ativa em condições aeróbicas, ela é geralmente suprimida na presença de O2. O enxofre é um subproduto importante da fotossíntese, e não do O2. O R. rubrum pode crescer heterotroficamente ou autotroficamente quando fotossintético. Ao contrário de muitas plantas, o R. rubrum não contém clorofila a (espectros de absorção 430-662 nm). No entanto, contém clorofila b (espectros de absorção 660-680 nm) e bacterioclorofilas (800-925 nm). Isto permite-lhe utilizar mais energia dos espectros electromagnéticos. O R. rubrum também oxida o monóxido de carbono (CO) com gás hidrogênio como produto final da via, e pode utilizar o sulfeto em baixas concentrações como doador de elétrons na redução do dióxido de carbono. Além disso, é uma bactéria fixadora de nitrogênio; utiliza nitrogenase para converter o gás nitrogênio atmosférico em amônia (Munk et al, 2011).
Existem várias aplicações do R. rubrum no campo da biotecnologia. É um sistema modelo de conversão da luz em energia química e pelas suas vias de fixação do nitrogénio. É também objecto de estudos de resistência à radiação. Também pode ser utilizado de diversas formas para consumo. As proteobactérias podem ser uma fonte de alimento animal e fertilizante agrícola. Outro papel importante na pesquisa inclui a produção de vitaminas. Também está sendo pesquisada para sua produção de plástico biológico a partir de precursores de poli-hidroxi-ácidos-ácidos. R. rubrum também pode ser um contribuinte em combustíveis biológicos hidrogênio, principalmente através de sua evolução da enzima nitrogenase.
Estrutura do genoma
O sequenciamento do genoma está terminado. Consiste em um cromossomo circular com 4.352.825 pares de bases, dos quais 65% são pares de guanina-cistosina. Há também um plasmídeo com 53.732 pares de bases com 60% de guanina-citosina. No total, há 3.850 genes codificadores de proteínas e 83 genes de RNA. Destes genes, 6,9% estão relacionados à transcrição; 4,6% tradução, estrutura do ribossomo e biossíntese; 4,0% replicação, recombinação e reparo; 7,9% mecanismos de transdução de sinal; 5,9% biogênese da parede celular e membrana; 6,6% produção e conversão de energia; 5,0% transporte e metabolismo de carboidratos; 9.9% transporte e metabolismo de aminoácidos; 4,7% transporte e metabolismo de coenzimas; 3,7% transporte e metabolismo de lipídios; e 6,5% transporte e metabolismo de íons inorgânicos(Munk et al, 2011).
Ecologia
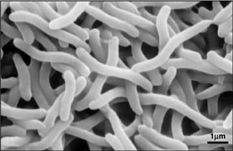
Devido ao facto de o Rhodospirillum rubrum poder crescer tanto aeróbica como anaeróbicamente, é capaz de habitar uma grande variedade de condições. O R. rubrum é encontrado em muitos ambientes aquáticos naturais, tais como lagoas, lagos, riachos e água parada (Reslewic et. al, 2005). R. rubrum também é frequentemente encontrado em lama e esgoto (Brock et al, 2000). Estudos mostraram que o R. rubrum pode fazer grandes mudanças na sua composição química para se adaptar a diferentes ambientes (Cohen-Bazire e Kunisawa, 1963). R. rubrum prefere crescer em habitats com um pH de 6,8-7,2 (Bergey e Holt, 1994). Estudos também mostraram que R. rubrum tem uma temperatura ótima de crescimento de 22-35 graus Celcius (Weaver, 1971).
Estrutura celular e metabolismo
R. rubrum é um organismo versátil que pode obter energia através de uma variedade de mecanismos. Os mecanismos respiratórios e fotossintéticos existem juntos e a sua actividade depende da presença de luz e energia. R. rubrum pode crescer em ambientes quimio-tropicais escuros com a presença de oxigênio ou pode crescer em um ambiente foto tropical sem oxigênio.
Fotossíntese em R. rubrum começa com a doação de um hidrogênio de um substrato orgânico para um substrato oxidante. Bacterioclorofila e cartenóides, os pigmentos fotorreativos encontrados na membrana celular, são ligados aos cromatóforos (Schachman, Pardee e Stanier, 1952). Os cromatóforos são discos achatados que contêm fosfolípidos de colina, cardio lipina e diglicéridos de galactosilo (Benson, Wintermans e Wiser, 1959; Benson 1961). Além disso, os cromatóforos contêm uma cadeia completa de transporte de electrões que inclui vários citocromos, flavina e nucleótidos de piridina (Newton e Newton, 1957; Hulcher e Conti, 1960; Kamen, 1961). A membrana celular também contém maquinaria para síntese de ATP, incluindo uma ATP synthetase.
Na presença de oxigênio, R. rubrum é capaz de respirar aerobicamente usando uma tradicional cadeia de transporte de elétrons com NAD+/NADH como o principal portador de elétrons (Keister e Minton, 1969). Entre as proteínas de transporte de electrões encontra-se o citocromo C428 (Chance e Smith, 1955). A respiração aeróbica, entretanto, é inibida pela fotossíntese (Oelze e Weaver, 1971).
R. rubrum também é capaz de respiração anaeróbica. Os seus aceitadores de electrões terminais não oxigenados podem incluir sulfóxido de dimetilo e óxido de trimetilamina. A presença desses aceitadores de elétrons possibilita que substratos como succinato, malato e acetato suportem o crescimento de R. rubrum. Estes aceitadores, entretanto, são apenas aproximadamente 33-41% tão eficientes quanto o oxigênio em termos de conservação de energia (Schultz e Weaver, 1982).
Adicionalmente, R. rubrum tem a habilidade única de oxidar monóxido de carbono usando monóxido de carbono desidrogenase. Esta via de oxidação termina com a redução e o hidrogénio e a produção de hidrogénio gasoso.
Sem um aceitador terminal de electrões, R. rubrum completa a fermentação ácida mista. Os principais produtos da fermentação piruvada são o acetato, o formato, o dióxido de carbono e o hidrogênio. Na presença do íon bicarbonato, a frutose é capaz de ser fermentada. Os produtos finais desta via são os mesmos do piruvato mas com a adição de succinato e propionato (Schultz e Weaver 1982).
Besides tendo a capacidade de fixar dióxido de carbono (Schon e Biedermann, 1972), uma propriedade anabólica identificável do R. rubrum é a sua capacidade de fixar nitrogénio. Em condições escuras com a presença de frutose, R. rubrum utiliza a nitrogenase para fixar o gás nitrogénio ao amónio. Ele contém tanto Fe-Mo como Fe-only nitrogenases.
Pathology
R. rubrum não foi encontrado para infectar humanos ou animais.
Current Research
Resistência à radiação
Rhodospirillum rubrum forneceu recentemente uma visão da resistência à radiação. Felice Mastroleo et al, em Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), have characterized the radiation tolerance of R. rubrum.
Após submeter as bactérias a doses subletais de raios gama Cobalt-60, um tipo de radiação ionizante, os genes marcadores de R. rubrum específicos da radiação ionizante foram caracterizados no organismo. Estes genes aumentaram de expressão à medida que o “tempo de recuperação” decorria após um determinado tratamento com radiação gama. A análise da expressão gênica pela radiação R. rubrum pós-gama cria o potencial para novas pesquisas microbiológicas que podem levar a avanços na resistência à radiação aplicada no futuro.
Plásticos biodegradáveis
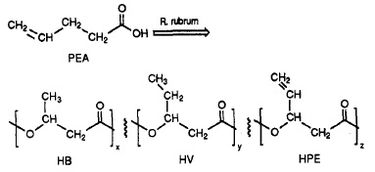
R. rubrum é encontrado para produzir uma classe de plásticos biodegradáveis, poli beta-hidroxialcanoatos (PHAs). As aplicações desta pesquisa podem resolver muitos problemas causados por plásticos sintéticos, não degradáveis, que têm impactado negativamente o meio ambiente. Um experimento de pesquisa realizado por Herbert. W. Ulmer et al relataram a produção de PHAs contendo unidades 3HV por Rhodospriillum rubrum (1993). Ulmer utilizou ácido 4-pentenóico (PEA) como meio de crescimento para o R. rubrum. Quando as bactérias foram colocadas sob “condições de produção de PHA”, PHAs foram sintetizadas contendo 3 subunidades de repetição (nota: R = grupo substituto): HB (R = metílico), HV (R = etílico), HPE (R = vinil) (Ver Figura 1).
A síntese de plásticos funcionais e biodegradáveis por bactérias tem o potencial de reduzir a poluição global e o gasto de combustível das fábricas de plásticos. O R. rubrum pode ser usado como uma ferramenta microbiológica para produzir biopolímeros ecológicos.
Energia renovável
A crescente preocupação com a poluição ambiental causada pela queima de combustíveis fósseis levou a um aumento na pesquisa do Rhodospirillum rubrum. O uso de R. rubrum como fonte de hidrogênio a ser usado em combustíveis de hidrogênio renováveis resolve vários problemas criados pelo consumo de combustíveis fósseis. O hidrogênio oxida a água como um produto de combustão, ao contrário dos combustíveis fósseis que criam poluentes como o CO, CO2, SOx e NOx. R. rubrum pode produzir hidrogênio utilizando a seguinte “reação de deslocamento água-gás” (Najafpour et al, 2004):
CO + H2O → H2 + CO2
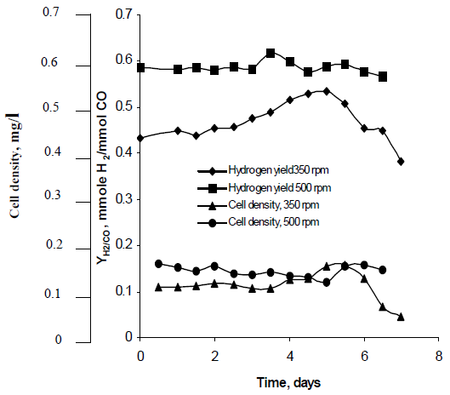
O método de pesquisa de Najafpour observou como a agitação, criada por conjuntos de turbinas impulsoras a taxas de 350 rpm assim como 500 rpm, afetou as taxas de produção de hidrogênio do R. rubrum. Sua pesquisa descobriu que o combustível hidrogênio tem potencial para conter o aquecimento global e fornecer uma solução tecnológica ecologicamente correta para a produção e consumo de combustível. Seu estudo revelou “uma maior taxa de agitação produziu maior hidrogênio, bem como a densidade celular” do R. rubrum (Ver Figura 2).
Em outro estudo microbiológico, realizado por Matthew Ross Melnicki, descobriu-se que o R. rubrum fornece o potencial de energia renovável, como o combustível hidrogênio, via síntese de hidrogênio. Suas vias biológicas podem produzir níveis elevados de hidrogênio quando co-cultivadas com Chlamydomonas reinhardtii, uma espécie de algas com a qual o R. rubrum pode crescer harmoniosamente. Melnicki propôs uma abordagem não convencional de co-culturação para sintetizar o hidrogênio que produziu níveis elevados de síntese de hidrogênio que podem não ser alcançados se a co-cultura for desacoplada. C. reinhardtii foi favorecido em maiores intensidades de luz, enquanto R. ruburm foi mais produtivo em menores intensidades de luz, destacando as vantagens de sua co-cultura.
Usando uma técnica fed-batch para o cultivo de R. rubrum, verificou-se que culturas inoculadas produziram hidrogênio durante sua fase de crescimento exponencial, e a síntese de hidrogênio continuou a florescer continuamente por 70 horas. Quando o crescimento cessou, Melnicki adicionou succinato, que atua como um doador de elétrons na via metabólica, e a evolução do hidrogênio recomeçou mesmo que as bactérias agora crescessem por mais tempo. Entretanto, é importante notar que com a adição contínua de succinato, foram encontradas taxas reduzidas de evolução do hidrogênio. Uma vez adicionados meios de crescimento adicionais, as taxas de produção de hidrogênio aumentaram novamente.
Melnicki também afirmou, “enquanto o crescimento não é necessário para a produção de hidrogênio, este trabalho estabelece a necessidade do crescimento celular para manter as taxas máximas, sugerindo a adequação industrial de uma estratégia de cultura semi-contínua” (Melnicki, 2009).
Cool Factor
A sequência genómica do Rhodospirillum rubrum é apenas a segunda do género Rhodospirillum que foi publicada, após R. centenum (Munk et al, 2011).

Um aspecto interessante do Rhodospirillum rubrum é a sua capacidade de mudar de cor sob diferentes condições. É um fototrófico anóxico, mas não produz oxigénio extracelular. Em vez disso, ele produz enxofre elementar durante a colheita da luz. Isto se deve ao fato de que o R. rubrum não possui complexo de coleta de luz 2 (Munk et al, 2011). A bactéria utiliza bacterioclorofila, permitindo-lhe absorver comprimentos de onda de luz que as plantas não utilizam. A bacterioclorofila absorve comprimentos de onda de 800-925 nm.
Em condições aeróbicas, a actividade fotossintética do R. rubrum é geneticamente suprimida, e a bactéria torna-se incolor. Sob condições anaeróbias, porém, a fotossíntese é ativada e a bactéria adquire uma cor vermelho-púrpura distinta (ver Imagem 5). Isto é devido à actividade nos cromatóforos, encontrada na membrana (Munk et al, 2011). Os cromatóforos contêm pigmentos bacterioclorofóricos da bactéria e sofrem alterações de absorção durante a ativação da fotossíntese.
Benson, A. “Chloroplast lipid metabolism”. No Simpósio não. VI. 5º Congresso Internacional de Bioquímica. 1961. Oxford: Pergamon Press. (In the Press.)
Benson, A., Wintermans, J. e Wiser, R. “Chloroplast lipids as carbohydrate reservoirs.” Fisiologia Vegetal. 1959. Volume 34. p. 815.
Bergey, D. e Holt, manual de bacteriologia determinante de J. Bergey. Nona edição. Baltimore. Lippincott Williams e Wilkins. 1994. p. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, e J. Parker. Biologia dos microrganismos. 9ª Edição. Upper Saddle River: Prentice Hall, 2000. p. 459.
Chance, B. e Smith, L. “Pigmentos respiratórios de Rhodospirillum rubrum.” A natureza. Volume 174. p. 803-806.
Cohen-Bazire, G. e Kunisawa, R. “The Fine Structure of Rhodospirillum Rubrum”. Journal of Cell Biology. 1963. Volume 16. p. 401-419.
Hulcher, M. e Conti, S. “Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum”. Comunicações de Pesquisa Bioquímica e Biofísica. 1960. Volume 3. p. 497.
Kamen, M. “The Haem Proteins of Photosynthetic Tissues”. Em Symposium no. VI. 5º Congresso Internacional de Bioquímica. 1961. Oxford: pergamon Press. (In the Press.)
Keister, D. e Minton, N. “Reacções ligadas à energia em bactérias fotossintéticas”. 3. Outros estudos sobre a redução de nicotinamida-adenina dinucleotídeos ligada à energia por Rhodospirillum rubrum chromatophores”. Bioquímica. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., e Leys, N. “Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods”. COSPAR Scientific Assembly. 2010. p. 4.
Melnicki, M. R. “Modos de produção de hidrogênio na bactéria fotossintética, Rhodosphirillum rubrum”. Universidade da Califórnia, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. “Sequência completa do genoma da estirpe tipo Rhodospirillum rubrum (S1T)”. Padrões em Ciências Genômicas. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., e Kamaruddin, A. H. “Hidrogênio como combustível limpo via fermentação contínua por bactérias fotossintéticas anaeróbias, Rhodospirillum rubrum”. African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. e Newton, G. “Composition of the photoactive subcellular particles from Chromatium”. Os Arquivos de Bioquímica e Biofísica. 1957. Volume 71. p. 250.
Oelze, J. e Weaver, P. “O ajuste das células fotossinteticamente cultivadas de Rhodospirillum rubrum às condições de luz aeróbica”. Os Arquivos de Microbiologia. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., e Schwartz, D. “Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .” Microbiologia Aplicada e Ambiental. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., e Stanier, R. “Estudos sobre a organização macromolecular de células microbianas”. Os Arquivos de Bioquímica e Biofísica. 1952. Volume 38. p. 245-260.
Schön, G. e Biedermann, M. “Síntese de ácidos voláteis por fermentação de piruvato e frutose em culturas negras anaeróbias de Rhodospirillum rubrum”. Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. e Weaver, P. “Fermentação e respiração anaeróbica por Rhodospirillum rubrum e Rhodopseudomonas capsulado”. The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., e Lenz, R. “Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum”. Macromoléculas. 1994. Volume 27. p. 1675-1679.
Weaver, P. “Mutações sensíveis à temperatura dos Aparelhos Fotosintéticos de Rhodospirillum rubrum”. Anais da Academia Nacional de Ciências dos Estados Unidos da América. 1971. Volume 68. p. 136-138.
Edited by students of Dr. Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen, e Jessica Wong.
NEUF2011