J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Papel de pesquisa
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Departamento de Oncologia de Radiação, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Departamento de Bioestatística, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Departamento de Oncologia Cirúrgica, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Resultados após tratamento de Metaplastic Versus Other Breast Cancer Subtypes. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Disponível de https://www.jcancer.org/v11p1341.htm
Propósito: O câncer de mama metaplásico (BC) é um subtipo histológico de BC incomum, porém agressivo. Procuramos identificar fatores associados ao seu diagnóstico e comparar o manejo e resultados da BC metaplásica com os de outras BC e triplo carcinoma ductal invasivo negativo em particular, dada a freqüência com que tem um fenótipo triplo negativo.
Patientes e Métodos: Identificamos mulheres diagnosticadas com BC invasiva em 2010-2014 na Base Nacional de Dados sobre Câncer, e usamos análise univariada para comparar as características do paciente de base e do tumor por subtipo de BC. Sobrevida geral (SO) foi estimada com o método de Kaplan-Meier, e modelos multivariados de risco proporcional de Cox foram usados para identificar preditores independentes de SO.
Resultados: De 247.355 casos, 2.084 (0,8%) foram BC metaplásica, 55.998 (23%) BC triplásica negativa, e 77% outras BC. Em relação à BC não metaplásica, as mulheres com BC metaplásica tinham maior probabilidade de serem mais velhas no momento do diagnóstico (mediana da idade, 62 vs. 59 anos), têm ≥1 condições comorbitárias (22% vs. 18%), e estão no Medicare (41% vs. 33%; P<0,001). A BC metaplásica tendeu a ser basal (77%), e em relação à BC tri-negativa ou outra BC, a BC metaplásica foi associada a um estado T clínico mais elevado (cT3-4, 18% vs. 11%, 8%), sem envolvimento nodal clínico (cN0, 86%, 77%, 80%), sem invasão linfovascular (72%, 65%, 62%), e tumores de alto grau (71%, 77%, 35%) (P<0,001). A maioria das BCs metaplásicas foi tratada com mastectomia (58%), dissecção dos linfonodos sentinela (65%), irradiação da parede torácica ou mama (74%) e quimioterapia (75%) como terapia adjuvante (60%). Em um tempo médio de seguimento de 44,5 meses, as taxas de OS foram menores para a BC metaplásica do que para a BC tri-negativa ou outra BC em todos os estágios clínicos aos 5 anos (estágio I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) e aos 3 anos (estágio IV, 15%, 22%, 64%; P<0,001). Na análise multivariada, idade crescente, estágio clínico avançado, invasão linfovascular, dissecção do nó axilar (vs. sentinela), e nenhuma radiação ou quimioterapia foram associadas com piores resultados na BC metaplásica. A extensão da cirurgia afetou a sobrevida para BC tri-negativa e outras BC mas não para BC metaplásica.
Conclusão: Os resultados para a BC metaplásica continuam a ser piores do que os de outros subtipos de BC, apesar dos tratamentos modernos. A otimização das opções de terapia sistêmica, que foi um preditor significativo de sobrevivência, deve ser uma prioridade no gerenciamento da BC metaplásica.
Palavras-chave: câncer de mama metaplásica, câncer de mama triplo negativo, resultados do câncer de mama, radioterapia, quimioterapia.
Introdução
Embora o câncer de mama seja o diagnóstico de câncer mais comum em mulheres, com mais de 268.000 casos documentados anualmente, o câncer metaplásico de mama (BC) constitui menos de 1%-2% de todos os casos de câncer de mama. Clinicamente, a BC metaplásica manifesta-se como uma massa mamária em rápido crescimento com ecogenicidade complexa (ou seja, componentes sólidos e císticos) na ultra-sonografia e uma massa de alta densidade na mamografia. Histologicamente, a BC metaplásica é composta de uma população heterogênea de tumores que podem ser classificados pela presença de tipos de células não glandulares ou mesenquimais ou por categorização adicional em subtipos, dependendo da presença de várias características como células gigantes osteoclásticas ou células fusiformes.
Na apresentação, a taxa de envolvimento linfonodal clínico na BC metaplásica é tipicamente baixa. Entretanto, a BC metaplásica é mais frequentemente diagnosticada em estágios clínicos avançados devido a tumores primários maiores em comparação com outras BC e está associada a maiores taxas de quimiorresistência, metástase distante e pior sobrevivência geral (SO). A BC metaplásica tem uma prevalência particularmente alta do estado receptor tri-negativo ou da ausência de receptor de estrogênio, receptor de progesterona e amplificação do receptor 2 (HER2) do fator de crescimento epidérmico humano. Sem as proteínas de carga, a BC metaplásica continua sendo um desafio para o tratamento. Os dados prospectivos são limitados para escolher o melhor tratamento para a BC metaplásica, dada a raridade do diagnóstico. Ao invés disso, muito do padrão atual de tratamento da BC metaplásica foi extrapolado a partir de descobertas de pequenas séries de uma única instituição ou relatos de casos. Portanto, utilizamos a Base de Dados Nacional de Câncer (NCDB), que captura aproximadamente 70% de todos os casos de câncer diagnosticados nos Estados Unidos, para avaliar as características, o tratamento e os resultados com base no tratamento e nas características tumorais de pacientes com BC metaplásica em comparação com aqueles com BC tri-negativa e todos os outros subtipos de BC. Também usamos análise multivariada para identificar preditores independentes de sobrevivência para mulheres com BC metaplásica.
Data Source and Cohort Selection
Um projeto conjunto estabelecido em 1989 pela Commission on Cancer do American College of Surgeons e da American Cancer Society, a NCDB coletou dados oncológicos de aproximadamente 1.500 instalações credenciadas nos Estados Unidos, totalizando mais de 34 milhões de registros. As informações disponíveis sobre pacientes são desidentificadas e, portanto, isentas da supervisão da proteção humana pelo conselho de revisão institucional.
Os critérios de seleção utilizados para este estudo estão delineados na Figura 1. Foram incluídas mulheres com 18 anos ou mais que foram diagnosticadas com cancro da mama invasivo de 2010 a 2014. Foram excluídas as pacientes com estado receptor de hormônio desconhecido (estrogênio e progesterona) (FC). Outros motivos de exclusão foram a falta de informações sobre cirurgia, quimioterapia ou estadiamento clínico de acordo com a 6ª ou 7ª edição do American Joint Committee On Cancer (AJCC). Os pacientes foram estratificados em três grupos: 1-metaplastic BC (com os códigos histológicos 8575 ou 8573), 2 triple-negative BC (TNBC, que incluía apenas histologias não-metaplásicas), e 3- todos os outros tipos restantes de BC. O termo “BC não-metaplástica” foi utilizado para se referir à BC tripla-negativa e outras BC combinadas.
Digrama de CORT. BC, câncer de mama.
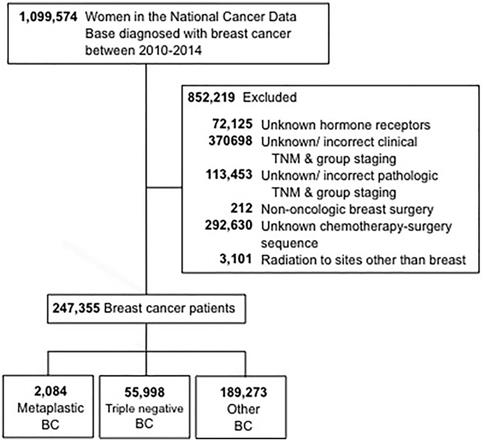 (Clique na imagem para ampliar.)
(Clique na imagem para ampliar.)
Variáveis
Informações obtidas e analisadas da BC não-metaplásica incluem idade da paciente no momento do diagnóstico, ano do diagnóstico, raça, índice de comorbidade Charlson/Deyo, estado do seguro médico, renda familiar mediana e tipo de instalação de tratamento (dicotomizada em pesquisa acadêmica versus não acadêmica). As características clínico-patológicas incluíram a designação clínica AJCC T e N (nodal), grupo geral de estágio clínico AJCC, status da FC, status do receptor HER2, grau do tumor e invasão linfovascular (LVSI). Os subtipos moleculares foram definidos como sendo HR(+)/HER2(-), HER2(+), tri-negativo (receptor de estrogênio(-), receptor de progesterona (-), HER2(-)), ou desconhecido. Pacientes com BC metaplásica com status receptor tri-negativo foram rotulados como BC tn-metaplásica para distingui-los da não-metaplásica TNBC. O tratamento primário incluiu cirurgia (ou conservação de mama, mastectomia ou nenhuma), radioterapia com ou sem inclusão de irradiação nodal regional, uso de quimioterapia (neoadjuvante, adjuvante ou nenhuma), e terapia hormonal. O manejo cirúrgico da axila foi definido como uma dissecção dos gânglios axilares (ALND), com 10 linfonodos ou mais removidos, ou uma dissecção dos linfonodos sentinela (SLND), quando <10 linfonodos foram removidos.
Análise estatística
Análise univariada foi utilizada para avaliar potenciais associações entre características demográficas, tumorais e clínicas e um diagnóstico de BC metaplásica, utilizando testes qui-quadrado para variáveis categóricas e teste t/análise de variância ou suas contrapartidas das abordagens não paramétricas (Wilcoxon rank-sum ou Kruskal-Wallis) para variáveis contínuas. O SO foi definido desde o momento do diagnóstico até o momento do óbito. O tempo de OS para os pacientes sobreviventes foi corretamente censurado no momento do último contato. A distribuição da OS foi estimada pelo método de Kaplan-Meier. O teste de log-rank foi usado para testar a diferença de sobrevida entre os grupos. Análises de regressão dos dados de sobrevida baseadas no modelo de risco proporcional de Cox foram realizadas em OS. Um modelo multivariado de riscos proporcionais de Cox foi obtido pela inclusão de um conjunto inicial de variáveis preditoras candidatas com valor de P < 0,05 na análise univariada. Em seguida, foi utilizada a eliminação gradual para trás, com 0,05 para o nível de significância do qui-quadrado de Wald para um efeito de permanência no modelo.
Análises de sobrevivência foram realizadas dentro de cada um dos tipos de câncer separadamente.
Localização e tipo da facilidade não foram incluídos no processo de seleção do modelo metaplásico BC porque nenhum dos fatores foi estatisticamente significativo para este grupo no cenário univariado e os dados não estavam totalmente disponíveis para pacientes com menos de 40 anos. Para explorar se os detalhes da terapia sistêmica e do fornecimento de radiação afetaram os resultados entre os pacientes com BC metaplásica, realizamos análises de subconjuntos nesta coorte para avaliar a potencial influência do seqüenciamento da quimioterapia e a extensão dos alvos de radiação na OS. Todos os testes foram bicaudais, e a significância estatística foi definida como um valor de P <0,05. Palo Alto, CA) foram usadas para realizar os cálculos para todas as análises.
Cohort e Tumor Characteristics
Identificamos 247.355 mulheres com diagnóstico de câncer de mama invasivo em 2010-2014, das quais 0,8% (n=2.084) tinham BC metaplásica, 23% (n=55.998) TNBC, e 77% (n=189.273) tinham outra BC. As características sociodemográficas, clínicas e patológicas do tumor e as características de tratamento por tipo de BC são mostradas na Tabela 1. A mediana da idade foi de 63 anos (variação 22-90) para mulheres com CB metaplásica e 59 anos (variação 18-90) para ambas as CB TNBC e outras CB. Mulheres com BC metaplásica tinham uma pontuação de comorbidade de ≥1 (22% vs. 18% TNBC vs. 16% outra BC) e tinham seguro público (50% vs. 42% TNBC vs. 41% outra BC) (todos P<0,001). O diagnóstico de CB metaplásica ou TNBC foi mais comumente associado com a raça negra do que com outras CB (18% vs. 21% vs. 11%, P<0,001).
Diferenças significativas no estágio clínico da doença e características tumorais foram vistas por tipo de câncer. A BC metaplásica foi frequentemente diagnosticada em estágios mais avançados, com apenas 31% dos pacientes com BC metaplásica tendo doença em estágio clínico I contra 46% de TNBC e 54% de outras BC (P<0,001). Esse padrão parecia estar correlacionado com maiores taxas de tumores maiores no grupo da CB metaplásica (cT3-4, 18% versus 11% versus 8%, respectivamente), mas a presença de envolvimento nodal clínico foi a menor para a CB metaplásica (cN1-3, 14% versus 23% versus 20%, respectivamente) (todos P<0,001). Em contraste com o estado clínico nodal, as taxas de envolvimento nodal patológico foram ligeiramente menores para a CB metaplásica e a CB TN, mas dobraram para outras CB (pN1-3, 18% vs. 26% vs. 40%, respectivamente, P<0,001). Com relação ao estado receptor, 77% do grupo da CB metaplásica tinha CB tn-metaplásica, que é 3,4 vezes maior do que o grupo da CB não metaplásica (23%), dos quais HR(+)/HER2(-) foi o subtipo molecular mais comum com 59% (P<0,001). Além disso, apenas 5% da CB metaplásica foi HER2(+) em comparação com 16% da CB não-metaplásica. Tanto a CB metaplástica quanto a CBTN tinham quase o dobro da proporção de tumores de grau 3 em relação à outra CB (71%, 77% e 35%, respectivamente, P<0,001), e a CB metaplástica tinha taxas menores de LVSI em relação à CBTN e outra CB (13%, 20% e 24%, respectivamente, P<0,001).
Características do paciente e do tratamento.
| Característica | Metaplastic BC, No. (%) | Triplo Negativo BC, No. (%) | Outra BC, No. (%) | Valor P | |
|---|---|---|---|---|---|
| Idade média, anos (intervalo) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | |
| Raça | |||||
| Branco | 1623 (77,9) | 41791 (74,6) | 158406 (83.7) | <0,001 | |
| Preto | 368 (17,7) | 11771 (21) | 20722 (10,9) | ||
| Outros | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | ||
| Desconhecido | 13 (0.6) | 395 (0.7) | 1638 (0.9) | ||
| Partitura de comorbidade | |||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | ||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | ||
| Rendimento médio | |||||
| <$30.000 | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | ||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | ||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | ||
| Desconhecido | 63 (3) | 1673 (3) | 6165 (3.3) | ||
| Seguro médico | |||||
| Privado | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | ||
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | ||
| Outros | 19 (0.9) | 665 (1.2) | 2212 (1.2) | ||
| Não segurado | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | ||
| Desconhecido | 31 (1.5) | 577 (1) | 2257 (1.2) | ||
| Tipo de país | |||||
| Metropolitano | 1720 (82.5) | 46252 (82,6) | 157058 (83) | 0,152 | |
| Urbano | 271 (13) | 7456 (13,3) | 24367 (12.9) | ||
| Rural | 43 (2.1) | 951 (1.7) | 3219 (1.7) | ||
| Desconhecido | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | ||
| Facilidade tipo | |||||
| Académica | 668 (32.1) | 16117 (28.8) | 52120 (27.5) | <0.001 | |
| Não Académico | 1318 (63.2) | 35472 (63.3) | 126101 (66.6) | ||
| Desconhecido | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Facility location | |||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | |
| Nordeste | 410 (19.7) | 10411 (18.6) | 37787 (20) | ||
| Sul | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | ||
| Oeste | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | ||
| Desconhecido | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Fase da doença clínica | |||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0.001 | |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | ||
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | ||
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | ||
| Clínica T status | |||||
| cT0 | 5 (0.2) | 131 (0,2) | 341 (0,2) | <0,001 | |
| cT1 | 674 (32,3) | 28452 (50,8) | 113113 (59.8) | ||
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | ||
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | ||
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | ||
| Clínico N status | |||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0,001 | |
| cN1 | 224 (10,7) | 9659 (17,2) | 30427 (16,1) | ||
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | ||
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | ||
| Pathologic stage | |||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | ||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | ||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | ||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | ||
| Pathologic T status | |||||
| pTis | 7 (0.3) | 432 (0,8) | 1862 (1) | <0,001 | |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | ||
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | ||
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | ||
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | ||
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | ||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | ||
| Pathologic N status | |||||
| pN0 | 1705 (81.9) | 41587 (74.3) | 113787 (60.2) | <0.001 | |
| pN1 | 284 (13.6) | 9725 (17,4) | 51483 (27,2) | ||
| pN2 | 66 (3,2) | 3031 (5.4) | 16111 (8.5) | ||
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | ||
| GrupamentoReceptor | |||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | |
| Triplo negativo | 1604 (77) | 55998 (100) | 0 (0) | ||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | ||
| Desconhecido | 49 (2.4) | 0 (0) | 6860 (3.6) | ||
| Tumor grade | |||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | ||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | ||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | ||
| Desconhecido | 284 (13.6) | 303030 (5.4) | 11186 (5.9) | ||
| LVSI | |||||
| Não presente | 1505 (72.2) | 36400 (65) | 118082 (62,4) | <0,001 | |
| Presente | 263 (12,6) | 11091 (19,8) | 45681 (24.1) | ||
| Desconhecido | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | ||
| Tipo de cirurgia | |||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | |
| Mastectomia | 1200 (57,6) | 26561 (47,4) | 95910 (50.7) | ||
| Sem cirurgia | 8 (0,4) | 295 (0.5) | 1341 (0,7) | ||
| Axilar cirurgia | |||||
| Sem cirurgia | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 | |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | ||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38,7) | ||
| Desconhecido | 18 (0,9) | 855 (1.5) | 1941 (1) | ||
| Terapia de radiação | |||||
| Sim | 1087 (52.2) | 33938 (60,6) | 109268 (57,7) | <.001 | |
| Não | 989 (47,5) | 21860 (39) | 79375 (41.9) | ||
| Desconhecido | 8 (0,4) | 200 (0,4) | 630 (0.3) | ||
| Pontos de radiação | |||||
| Apenas Peito/PR | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | |
| Peito/CW + Nós regionais | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | ||
| Quimioterapia | |||||
| Sim | 1571 (75.4) | 44321 (79.1) | 133965 (70.8) | <0.001 | |
| Não | 499 (23.9) | 11195 (20) | 53062 (28) | ||
| Desconhecido | 14 (0,7) | 482 (0,9) | 2246 (1.2) | ||
| Sequência quimioterápica para cirurgia | |||||
| Adjuvante | 1241 (59,5) | 31519 (56.3) | 116645 (61,6) | <0,001 | |
| Neoadjuvante | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | ||
| Nenhum | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | ||
| Terapia hormonal | |||||
| Sim | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 | |
| Não | 1798 (86.3) | 53274 (95.1) | 76820 (40,6) | ||
| Desconhecido | 66 (3,2) | 1546 (2,8) | 8547 (4.5) | ||
| Ano de diagnóstico | |||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | ||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | ||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | ||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19.3) |
A abreviaturas: BC, câncer de mama; ALND, dissecção dos linfonodos axilares; BCS, cirurgia de conservação da mama; CW, parede torácica; HER2, receptor do fator de crescimento epidérmico humano; HR, receptor hormonal; LVSI, invasão linfovascular; SLND, dissecção dos linfonodos sentinela.
Tratamento por tipo de câncer de mama
A maioria das pacientes (99%) foi submetida a cirurgia oncológica de mama, incluindo avaliação cirúrgica da axila (97%). A mastectomia foi mais comumente usada no grupo da BC metaplásica (58% vs. 47% TNBC vs. 51% outra BC, P<0,001), assim como a SLND (65% vs. 62% TNBC vs. 58% outra BC; P<0,001). A irradiação nodal regional foi mais frequentemente usada como parte do tratamento para outra CB que para a CB metaplásica e para a TNBC (26%, 27% e 34%; P<0,001), respectivamente.
No que diz respeito à terapia sistêmica, a quimioterapia neoadjuvante foi usada quase duas vezes mais frequentemente para a CB metaplásica e a TNBC do que para outras CB (16%, 23%, 9%; P<0,001), e aproximadamente um quarto de todas as mulheres não recebeu quimioterapia. A terapia hormonal foi a menos utilizada para a hemoglobina TN (2%), mas fez parte do paradigma de tratamento para 11% da CB metaplásica e 55% dos outros casos de CB.
Análise de sobrevivência
A mediana do tempo de seguimento foi de 44,5 meses. Pacientes com BC metaplásica tinham SO significativamente pior não ajustado, independentemente do estágio clínico (Fig. 2). As estimativas de OS de 5 anos para os pacientes com BC metaplásica, TNBC e outros pacientes com BC estágio I foram 85%, 87% e 91%; as do estágio II foram 73%, 77% e 87%; e as do estágio III foram 43%, 53% e 75% (P<0,001). As taxas de OS de 3 anos para pacientes com doença metastática foram 2-4 vezes maiores para o TNBC e outros grupos de BC em 30% e 64%, contra 15% para BC metaplásica (P<0,001). A sobrevivência por subtipo molecular também foi analisada (Fig. 3). Entre os pacientes com BC metaplásica, nenhuma diferença no SO foi aparente por subtipo molecular (HR(+)/HER2(-), HER2(+), ou tn-metaplásica BC) (P=0,778). Em contraste, para a BC não-metaplástica, o subtipo tri-negativo foi associado a SO pior que os subtipos HER+ e HR(+)/HER2(-) (P<0,001). A raça também não parecia estar associada com a sobrevida entre pacientes com BC metaplásica (taxas de OS de 5 anos 73% para brancos contra 74% para negros, P=0,876), enquanto a raça estava associada com OS tanto no TNBC (P<0,001) quanto em outros grupos de BC (P<0,001; Fig. 4).
Curvas de sobrevida totais dos tipos de câncer de mama por estágio clínico, examinando metaplásicos, triplos negativos e outros cânceres de mama. Abreviatura: MBC, câncer de mama metaplásico.
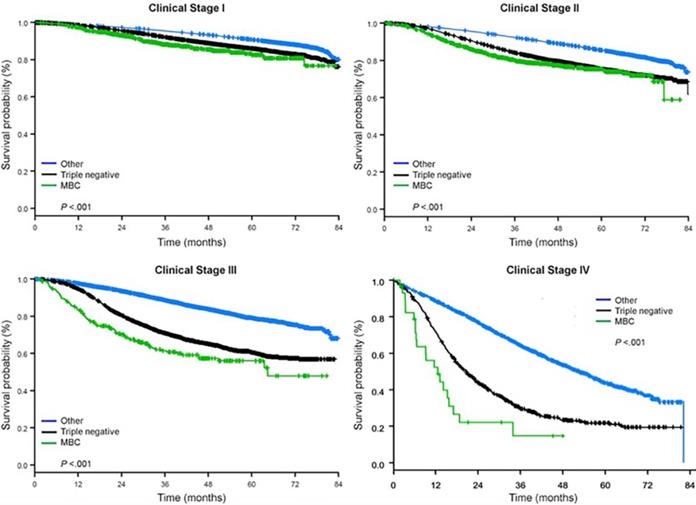 (Clique na imagem para ampliar.)
(Clique na imagem para ampliar.)
Curvas de sobrevivência totais para pacientes com câncer de mama metaplásico e não metaplásico estratificado pelo estado receptor. Abreviaturas: HER2, receptor 2 do fator de crescimento epidérmico humano; FC, receptor hormonal; MBC, câncer de mama metaplásico.
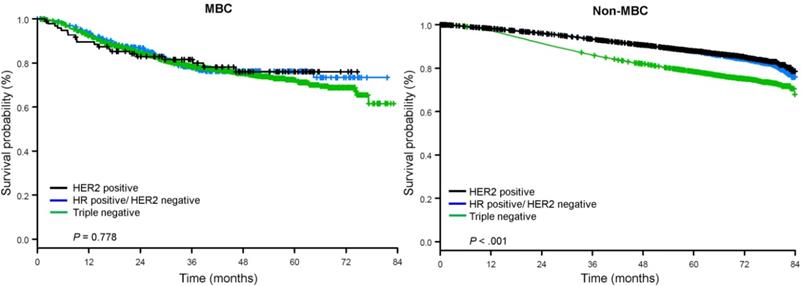 (Clique na imagem para ampliá-la.)
(Clique na imagem para ampliá-la.)
Curvas de sobrevivência totais para pacientes com metaplásicos, triplos negativos e outros cânceres de mama estratificados por raça. Abreviaturas: BC, câncer de mama.
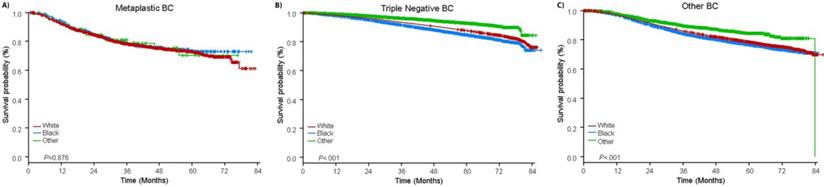 (Clique na imagem para ampliar.)
(Clique na imagem para ampliar.)
Análise multivariável dos fatores associados à sobrevida global para pacientes com BC metaplásica.
| Factores associados à sobrevivência global em metaplásicos BC | |||
|---|---|---|---|
| Variável (Referência) | Rácio de Perigo (95% Intervalo de Confiança) | Valor P | |
| Idade | Aumento anual | 1.024 (1.015-1.033) | <0.0001 |
| Invasão Linfovascular (Nenhuma) | Agora | 1.307 (1.017-1.679) | 0.0364 |
| Clinical N Status (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 |
| Clinical T Status (cT1) | cT0 | 2,226 (0,301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3.029 (2.183-4.204) | ||
| cT4 | >3.145 (2.124-4.657) | ||
| Clínico M Status (cM0) | cM1 | 3.330 (2.020-5.488) | <0.0001 |
| Cirurgiaxilar (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 |
| Sem Cirurgia | 1.538 (0.884-2.675) | ||
| Radiação (Não) | Sim | 0.709 (0.572-0.878) | 0.0016 |
| Quimioterapia (Não) | Sim | 0.579 (0.446-0.752) | <0.0001 |
A abreviaturas: ALND, dissecção dos linfonodos axilares; BC, cancro da mama; SLND, dissecção dos linfonodos sentinela.
>
Em análise multivariada, aumento da idade, maior classificação clínica T, presença de doença nodal clínica ou LVSI, e tratamento com ALND todos correlacionados com piores resultados para pacientes com BC metaplásica, TNBC e outras BC (Tabela Suplementar 1). A adição de quimioterapia e radioterapia tanto melhorou independentemente do tipo de câncer de mama. Outras características da paciente e do tumor associadas com a sobrevida na CBT e outras CB, incluindo raça, comorbidades e grau do tumor, não foram associadas com os resultados de sobrevida para CB metaplásica na análise multivariada.
Dados os resultados relativamente pobres entre pacientes com CB metaplásica, análises de subgrupos foram feitas no grupo da CB metaplásica para avaliar se alguma modalidade de tratamento estava associada com resultados melhores. Após o ajuste para o estado nodal (cN0 vs. N+), o tratamento com cirurgia axilar mais agressiva (ALND vs. SLND foi associado a piores resultados, um fenômeno que também foi observado entre TNBC e outras BC (Tabela 2). Entre aqueles que receberam radioterapia, o tratamento com irradiação nodal regional vs. radiação de mama ou parede torácica não influenciou significativamente os resultados entre pacientes com CB metaplásica (P=0,077 e 0,200 para N0 e N+ clínicos, respectivamente). A recepção de quimioterapia neoadjuvante foi associada a piores resultados do que a quimioterapia adjuvante entre pacientes com BC metaplásica clinicamente negativa (FC 1,9, IC 95% 1,3-2,6, P<0.001), mas não para aquelas com BC metaplásica clinicamente nodo-positiva (P=0,43).
Discussão
Câncer de mama metaplásica é uma forma rara mas particularmente agressiva de câncer de mama, especialmente quando comparada com outros subtipos de tumor de mama. Esta entidade da doença tem sido relativamente subrepresentada na literatura. Uma extensa pesquisa por Rayson et al. de publicações de 1966 a 1997 resultou em um total de apenas 27 casos. Grandes bases de dados nacionais, como a NCDB, são vantajosas para o estudo de cancros raros, como a BC metaplásica. Entretanto, a incidência de diagnóstico de BC metaplásicos nos Estados Unidos, de acordo com essas bases de dados, ainda é baixa, com menos de 500 casos por ano. Em nosso estudo, descobrimos que a BC metaplásica foi mais comumente diagnosticada como um grande tumor com características de risco adversas, como grau de tumor mal diferenciado e estado receptor tri-negativo. Os pacientes com BC metaplásica tiveram sobrevida significativamente pior, independentemente do estágio de apresentação, em comparação com a BC tríplice negativa e outras BC. A recepção de quimioterapia e radioterapia foram preditores independentes de melhor OS, mas a sequência da quimioterapia parecia afetar os resultados, particularmente para pacientes com BC metaplásica sem envolvimento nodal clínico, reconhecendo que alguns desses pacientes tinham envolvimento nodal patológico. Entretanto, nossos achados podem refletir uma potencial heterogeneidade nos mecanismos biológicos subjacentes que impulsionam as respostas aos tratamentos neste grupo particular de pacientes com BC e destacar a necessidade de melhor estratificação de risco e opções terapêuticas sistêmicas para melhorar os resultados.
Embora a maioria das BC metaplásicas tenha um fenótipo tri-negativo, o comportamento da BC metaplásica parece ser único em comparação com outras CBT. A NBCT tende a ter um prognóstico pior do que outros tipos de BC, e a noção de que a BC metaplásica é mais agressiva do que a NBCT tem sido corroborada por várias investigações retrospectivas menores. Tais estudos têm mostrado padrões semelhantes de diagnóstico em estágios avançados para a CB metaplásica versus a CBTN, devido a maiores taxas de doença cT3-4 ao invés de envolvimento nodal, e em uma revisão de 46 casos de CB metaplásica em uma única instituição, pacientes com CB metaplásica tiveram um risco significativamente maior de recorrência de doença local (30% vs. 15%; P=0,004). Essas características acabaram se correlacionando com taxas inferiores de sobrevida livre de doença de 5 anos (30% vs. 90%; P<0,001) e taxas de OS (65% vs. 87%; P=0,002) para pacientes com BC metaplásica em relação à CBTN. Um estudo de Epidemiologia de Vigilância e Resultados Finais de 1.1112 pacientes com BC metaplásica também mostrou piores taxas de sobrevida específica do câncer em 3 anos para a BC metaplásica do que para a TNBC (78% vs. 84%). Ao examinar tn-metaplastic BC, Li et al. encontraram pior sobrevida livre de doença (FC 1,48, IC 95% 1,19-1,84, P<0,01) e SO (FC 1,42 ; P<,01) para tn-metaplastic BC em comparação com a TNBC. Nosso estudo, que incluiu um dos maiores grupos de pacientes com BC metaplásica até o momento (n=2.084), reforça esses achados e destaca que o estado receptor não é um preditor independente de sobrevida para a BC metaplásica (P=0.778) como para a BC não metaplásica.
Um componente terapêutico crítico associado à melhora dos resultados para todos os pacientes com BC metaplásica em nosso estudo foi o uso de quimioterapia (FC 0,58, IC 95% 0,45-0,75, P<0,001). Nosso relato é o primeiro ao nosso conhecimento a relatar resultados em metaplásicos de BC baseados no seqüenciamento da quimioterapia. De forma impressionante, nossa subanálise constatou que para pacientes com BC metaplásica cN0 em particular, a quimioterapia neoadjuvante foi associada a pior OS em comparação com a quimioterapia adjuvante (FC 1,88, IC 95% 1,34-2,64, P<0,001), enquanto que o sequenciamento da quimioterapia não teve efeito sobre a BC metaplásica clinicamente nodoso positivo. Uma possível explicação para isso pode ser que nossos pacientes com BC metaplásica tiveram um status clínico T mais alto, o que em outros relatos tem sido associado com menores taxas de resposta completa patológica e piores resultados de sobrevida subseqüentes. Além disso, os métodos de estadiamento clínico (isto é, exame físico sozinho, incorporação da ultrassonografia) podem introduzir heterogeneidade em uma população clínica de N0, faltando uma verdadeira carga de doença nodal, que por si só pode estar associada a desfechos inferiores. Em geral, a resposta metaplásica da CB à quimioterapia neoadjuvante tem sido relatada como sendo tão baixa quanto 18%, o que é muito menor do que as taxas de resposta conhecidas para TNBC a regimes quimioterápicos baseados em antraciclinas e taxanos.
Baseado na sobrevivência mais pobre e no desenvolvimento relativamente rápido da disseminação metastática distante em comparação com outros subtipos de câncer de mama observados em nosso estudo e em outros relatos, a necessidade de melhores opções de terapia sistêmica é claramente evidente para a CB metaplásica. O perfil transcricional mostrou que este subtipo de câncer apresenta uma assinatura tumorigênica com características semelhantes às células-tronco, aberrações frequentes na via PI3K/AKT/mTOR e superexpressão do fator de crescimento endotelial vascular (VEGF). Essas características são semelhantes às encontradas nos TNBCs mesenquimais. Esforços promissores estão em andamento para identificar regimes terapêuticos sistêmicos alternativos para esses pacientes, incluindo um estudo recente da fase I que mostrou melhores taxas de resposta objetiva à doxorrubicina lipossômica, bevacizumab (anticorpo monoclonal para VEGF-A) e everolimus (inibidor de mTOR) em pacientes com TNBC metaplásica com aberração da via PI3K.
Em relação aos tratamentos locais, a mastectomia foi mais comumente utilizada em nosso estudo para a CB metaplásica, mas não foi associada à melhora da sobrevida em relação à cirurgia de conservação da mama. Além disso, não foi encontrado benefício de sobrevivência do tratamento que incorporou ALND versus SLND. A radioterapia, entretanto, foi um preditor significativo de sobrevida, com pacientes de BC metaplásica tratados com radioterapia adjuvante sendo 30% menos propensos a morrer do que aqueles que não receberam radiação. As limitações relevantes em nossa análise de radioterapia incluem detalhes desconhecidos sobre o planejamento do tratamento, modalidade selecionada, garantia de qualidade, ou se técnicas como a retenção de inspiração profunda foram utilizadas. Embora a recidiva local-regional não possa ser examinada na NCDB, uma série institucional de 113 pacientes com BC metaplásica (54% que receberam radioterapia) mostrou que a radiação foi o único fator que correlacionou com a redução da recorrência locorregional (risco relativo sem radiação 3.1; IC 95% 1,13-9,88, P=0,027).
Nossos resultados devem ser interpretados com cautela, dadas as principais limitações de não se saber quais regimes de quimioterapia foram utilizados, a duração dos tratamentos, ou a resposta à quimioterapia neoadjuvante, já que essa informação não está disponível na CNDB. Também reconhecemos as limitações dos fatores de risco clincopatológicos capturados no NCDB, sem os quais pode não ser possível caracterizar completamente as diferenças clínicas que impulsionam algumas das diferenças de resultados que encontramos, tais como piores resultados de sobrevivência com ALND mesmo quando se controla o estado dos gânglios linfáticos. Embora nosso tamanho amostral de pacientes com BC metaplásica fosse pequeno em relação aos estudos com BC não metaplásica, paradoxalmente também é provavelmente o maior estudo existente até o momento examinando esta questão, dado o número limitado de pacientes com BC metaplásica relatados em séries institucionais. Investigações adicionais são necessárias para entender a predileção biológica pela propagação metaplásica na BC metaplásica e validar nossos achados em conjuntos de dados separados de pacientes com BC metaplásica.
Nosso padrão atual de cuidados não é claramente adequado para esta população de câncer única, e a obtenção de dados randomizados sobre a BC metaplásica no futuro exigirá esforços cooperativos devido ao pequeno número de pacientes. A NCDB proporciona uma força notável, que é a capacidade de estudar padrões de tratamento e resultados associados a um diagnóstico raro. Com 2.084 indivíduos com BC metaplásica nesta coorte, esta é uma das maiores investigações de BC metaplásica relatadas na era moderna. A sobrevivência desses pacientes é pobre em relação àqueles com qualquer outro tipo de BC, e embora esse fato provavelmente provoque a incorporação de terapia agressiva, nosso estudo sugere que um tratamento local-regional mais extensivo (por exemplo, irradiação ALND ou de nós regionais) deve ser cuidadosamente considerado caso a caso. Em geral, o uso de terapia sistêmica é crucial para o manejo da BC metaplásica, independentemente da carga nodal, e o desenvolvimento de terapias direcionadas eficazes baseadas na análise de perfil genômico tumoral mostra promessa para o futuro.
Material Suplementar
![]()
Tabela Suplementar.
Agradecimentos
Especial agradecimentos a Christine Wogan pela assistência editorial.
Financiamento
Patrocinado em parte pelo Centro de Apoio ao Câncer (Núcleo de Bioestatística) Subsídio CA016672 do Instituto Nacional do Câncer, Institutos Nacionais de Saúde, para o The University of Texas MD Anderson Cancer Center.
Interesses concorrentes
Os autores declararam que não existe nenhum interesse concorrente.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Clínica de Câncer J. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Tipos de carcinoma da mama: revisão da literatura. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Pior prognóstico de pacientes com câncer de mama metaplásico do que outros pacientes com câncer de mama tri-negativo. Tratamento do cancro da mama. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Carcinomas metaplásicos da mama: V. Carcinoma metaplásico com células gigantes osteoclásticas. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Carcinomas metaplásicos da mama. I. Carcinoma produtor de matrizes. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastic carcinomas of the breast. II. Carcinoma de células fusiformes. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastic breast cancer: clinicopathological features and its prognosis. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Tratamento do Câncer de Mama. Outubro. 2018
10. National Cancer Database (Base de dados nacional de câncer).
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients (Fatores Determinantes da Adequação da Dissecção do Nó Axilar em Pacientes com Câncer de Mama). Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Dissecção de nódulos linfáticos em pacientes com câncer de mama. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Métodos Estatísticos para a Análise de Dados Biomédicos. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Estimativa não paramétrica a partir de observações incompletas ESTIMATIVA NÃO-PARAMÉTICA DE OBSERVAÇÕES INCOMPLETAS*. Fonte J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modelos de Regressão e Tabelas de Vida. Tabelas de Vida Cox. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastic breast cancer: prognosis and response to systemic therapy. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. The National Cancer Data Base: uma iniciativa poderosa para melhorar o tratamento do câncer nos Estados Unidos. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: A Retrospective Analysis of a National Oncology Database (Análise Retrospectiva de uma Base de Dados Nacional de Oncologia). Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Câncer de mama tri-negativo em mulheres afro-americanas: disparidades versus biologia. Nat Rev Câncer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Marcadores prognósticos em câncer de mama tri-negativo. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Epidemiologia do câncer de mama e fatores de risco. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. As Características Clínico-opatológicas e Resultados de Sobrevivência de Diferentes Subtipos Histológicos em Câncer de Mama Triplo-Negativo. J Câncer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastic Carcinoma of the Breast Is More Aggressive Than Triple-negative Breast Cancer: Um Estudo de uma Única Instituição e Revisão de Literatura. Clínica de Câncer de Mama. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lanceta. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Falta de eficácia à quimioterapia sistêmica para tratamento do carcinoma metaplásico da mama na era moderna. Tratamento do Res Res do câncer de mama. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Fenotípico e caracterização molecular do subtipo intrínseco claudino-baixo do câncer de mama. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identificação de subgrupos relevantes para o prognóstico em pacientes com câncer de mama tri-negativo quimiorresistente. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologista. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Inspiration Breath Hold: Techniques and Advantages for Cardiac Sparing During Breast Cancer Irradiation (Fixação Profunda da Inspiração: Técnicas e Vantagens para a Poupança Cardíaca durante a Irradiação do Câncer de Mama). Oncol frontal. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Revisão de técnicas de retenção de inspiração profunda para o tratamento do câncer de mama. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Tratamento do cancro da mama. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastic carcinoma of the breast: Prognóstico e resposta ao tratamento sistêmico na doença metastática. Mama J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant Treatment of Triple-Negative Metaplastic Breast Cancer With Weekly Paclitaxel and Platinum Chemotherapy: Retrospective Case Review From a Single Institution. Clínica de Câncer de Mama. Maio. 2019