- Tabela de Geometrias
- Objetivos de aprendizado
- KEY TAKEAWAYS
- Key Points
- Termos chave
- Modelo VSEPR
- Geometrias moleculares
- Como determinar a Geometria Molecular – YouTube: Este vídeo descreve um método para encontrar rapidamente as formas geométricas principais para moléculas simples.
- Geometrias Moleculares
- OBJETIVOS DE APRENDIZAGEM
- KEY TAKEAWAYS
- Key Points
- Key Terms
- AXE Method
- Geometrias principais (sem pares solitários de elétrons):
- Planar trigonal
- Tetraédrico
- Octaédrico
- Interactiva: Geometria Electrónica: As moléculas assumem formas diferentes devido a padrões de elétrons compartilhados e não compartilhados. Nestes exemplos todos os elétrons que afetam a forma das moléculas são compartilhados nas ligações covalentes que mantêm os átomos juntos para formar as moléculas.
- Pares Elétricos Solitários
- OBJECTIVOS DE APRENDIZAGEM
- KEY TAKEAWAYS
- Key Points
- Key Terms
- Geometrias moleculares com pares de electrões solitários
- Número de coordenação e o átomo central
- O Efeito Repulsivo dos Elétrons de Par Solitário
- Interactiva: Elétrons não partilhados e a forma “dobrada”: Use o modelo 3D para ver como os electrões não partilhados repelem aqueles que são partilhados nas ligações entre o hidrogénio e o oxigénio, fazendo com que a molécula tenha uma forma “dobrada”.
- LICENÇAS E ATRIBUIÇÕES
- CC CONTEÚDO LICENÇADO, COMPARTILHADO ANTERIORAMENTE
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tabela de Geometrias
A teoria VSEPR detremines geometrias moleculares (linear, trigonal, bipiramidal trigonal, tetraédrico, e octaédrico).
Objetivos de aprendizado
Aplique o modelo VSEPR para determinar a geometria de uma molécula que não contém pares solitários de elétrons no átomo central.
KEY TAKEAWAYS
Key Points
- Fundamentalmente, o modelo VSEPR teoriza que regiões de carga elétrica negativa se repelirão umas às outras, fazendo com que elas (e as ligações químicas que elas formam) fiquem o mais distantes possível.
- As geometrias moleculares levam em conta o número de átomos e o número de pares solitários de elétrons.
- As principais geometrias sem elétrons de par solitário são: linear, trigonal, tetraédrico, bipirâmide trigonal e octaédrico.
Termos chave
- Teoria VSEPR: um modelo químico usado para prever a forma de moléculas individuais baseado na repulsão eletrostática de pares de elétrons
Modelo VSEPR
O modelo de repulsão de pares de elétrons de concha de valência (VSEPR) foca nos pares de elétrons de ligação e não ligação presentes na concha (valência) mais externa de um átomo que se conecta com dois ou mais outros átomos.
Fundamentalmente, o modelo VSEPR teoriza que essas regiões de carga elétrica negativa se repelirão umas às outras, fazendo com que elas (e as ligações químicas que elas formam) fiquem o mais distantes possível. Portanto, as duas nuvens de elétron contidas em uma molécula triatômica simples ![]() se estenderão em direções opostas. Uma separação angular de 180° coloca as duas orbitais de ligação o mais afastadas possível uma da outra; por isso esperamos que as duas ligações químicas se estendam em direcções opostas, produzindo uma molécula linear.
se estenderão em direções opostas. Uma separação angular de 180° coloca as duas orbitais de ligação o mais afastadas possível uma da outra; por isso esperamos que as duas ligações químicas se estendam em direcções opostas, produzindo uma molécula linear.

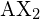 . Os dois átomos X (em branco) estão a 180° um do outro.
. Os dois átomos X (em branco) estão a 180° um do outro.Se o átomo central também contém um ou mais pares de electrões não ligados, estas regiões adicionais de carga negativa comportar-se-ão muito como as associadas aos átomos ligados. Os orbitais contendo os vários pares de ligação e não ligação na concha da valência se estenderão do átomo central em direções que minimizem suas repulsões mútuas. Se o átomo central possui d-orbitais parcialmente ocupados, ele pode ser capaz de acomodar cinco ou seis pares de elétrons, formando o que às vezes é chamado de “octeto expandido”
Geometrias moleculares
Geometrias moleculares (linear, trigonal, tetraédrico, bipiramidal trigonal e octaédrico) são determinadas pela teoria VSEPR. Uma tabela de geometrias usando a teoria VSEPR pode facilitar o desenho e a compreensão das moléculas. A tabela de geometrias moleculares pode ser encontrada na primeira figura. A segunda figura serve como um auxílio visual para a tabela.


>
Como determinar a Geometria Molecular – YouTube: Este vídeo descreve um método para encontrar rapidamente as formas geométricas principais para moléculas simples.
Geometrias Moleculares
A teoria VSEPR descreve cinco formas principais de moléculas simples: linear, planar trigonal, tetraédrico, bipiramidal trigonal, e octaédrico.
OBJETIVOS DE APRENDIZAGEM
Aplique o modelo VSEPR para determinar a geometria das moléculas onde o átomo central contém um ou mais pares solitários de elétrons.
KEY TAKEAWAYS
Key Points
- Linear: uma molécula triatómica simples do tipo
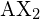 ; os seus dois orbitais de ligação estão separados por 180°.
; os seus dois orbitais de ligação estão separados por 180°. - Plano triangular: triangular e num plano, com ângulos de ligação de 120°.
- Tetraédrico: quatro ligações num átomo central com ângulos de ligação de 109,5°.
- Trigonal bipiramidal: cinco átomos em torno do átomo central; três num plano com ângulos de ligação de 120° e dois em extremidades opostas da molécula.
- Octédrico: seis átomos em torno do átomo central, todos com ângulos de ligação de 90°.
Key Terms
- Teoria VSEPR: o modelo Valence Shell Electron Pair Repulsion (VSEPR) é usado para prever a forma de moléculas individuais com base na extensão da repulsão electrostática de pares de electrões
AXE Method
Uma outra forma de ver as geometrias moleculares é através do “método AXE” da contagem de electrões. A em AXE representa o átomo central e tem sempre um subescrito implícito; X representa o número de ligações sigma entre os átomos centrais e exteriores (ligações covalentes múltiplas – duplas, triplas, etc. – contam como um X); e E representa o número de pares de electrões solitários que rodeiam o átomo central. A soma de X e E, conhecida como número esterico, também está associada ao número total de orbitais hibridizados utilizados pela teoria das ligações de valência. VSEPR utiliza o número estéreo e a distribuição de X e E para prever formas geométricas moleculares.

Nota que as geometrias são nomeadas apenas de acordo com as posições atômicas, não com o arranjo dos elétrons.

Geometrias principais (sem pares solitários de elétrons):
Em um modelo linear, os átomos são conectados em linha reta, e um ângulo de ligação é simplesmente o ângulo geométrico entre duas ligações adjacentes. Uma molécula triatómica simples do tipo ![]() tem os seus dois orbitais de ligação separados 180°. Exemplos de moléculas triatómicas para as quais a teoria VSEPR prevê uma forma linear incluem
tem os seus dois orbitais de ligação separados 180°. Exemplos de moléculas triatómicas para as quais a teoria VSEPR prevê uma forma linear incluem ![]() (que não possui electrões suficientes para se conformar com a regra do octeto) e
(que não possui electrões suficientes para se conformar com a regra do octeto) e ![]() . Ao escrever a fórmula do ponto eletrônico para o dióxido de carbono, note que as ligações C-O são duplas; isto não faz diferença para a teoria VSEPR. O átomo central de carbono ainda está unido a dois outros átomos. As nuvens de electrões que ligam os dois átomos de oxigénio estão separadas por 180°.
. Ao escrever a fórmula do ponto eletrônico para o dióxido de carbono, note que as ligações C-O são duplas; isto não faz diferença para a teoria VSEPR. O átomo central de carbono ainda está unido a dois outros átomos. As nuvens de electrões que ligam os dois átomos de oxigénio estão separadas por 180°.

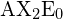 na tabela.
na tabela.Planar trigonal
Moléculas com a forma planar trigonal são triangulares e em um plano, ou superfície plana. Uma ![]() molécula como
molécula como ![]() tem três regiões de densidade de elétrons estendendo-se para fora do átomo central. A repulsão entre estas será no mínimo quando o ângulo entre quaisquer duas é 120o.
tem três regiões de densidade de elétrons estendendo-se para fora do átomo central. A repulsão entre estas será no mínimo quando o ângulo entre quaisquer duas é 120o.
Tetraédrico
Tetra- significa quatro, e -édrico relaciona-se com uma face de um sólido; “tetraédrico” significa literalmente “ter quatro faces”. “Esta forma é encontrada quando existem quatro ligações, todas num átomo central, sem pares solitários de electrões. De acordo com a teoria VSEPR, os ângulos de ligação entre as ligações de elétrons são 109,5o. Um exemplo de uma molécula tetraédrica é o metano ![]() . As quatro ligações equivalentes apontam em quatro direcções geometricamente equivalentes em três dimensões, correspondendo aos quatro cantos de um tetraedro centrado no átomo de carbono.
. As quatro ligações equivalentes apontam em quatro direcções geometricamente equivalentes em três dimensões, correspondendo aos quatro cantos de um tetraedro centrado no átomo de carbono.

Forma bipiramidal trigonal quando um átomo central é rodeado por cinco átomos numa molécula. Na geometria, três átomos estão no mesmo plano com ângulos de ligação de 120°; os outros dois átomos estão em extremidades opostas da molécula. Alguns elementos do Grupo 15 da tabela periódica formam compostos do tipo ![]() ; exemplos incluem
; exemplos incluem ![]() e
e ![]() .
.

Octaédrico
Octa- significa oito, e -édrico relaciona-se com uma face de um sólido, então “octaédrico” significa literalmente “ter oito faces”. Os ângulos de ligação são todos de 90°, e assim como quatro pares de elétrons experimentam uma repulsão mínima quando são dirigidos para os cantos de um tetraedro, seis pares de elétrons tentam apontar para os cantos de um octaedro. Um exemplo de uma molécula octaédrica (![]() ) é o hexafluoreto de enxofre (
) é o hexafluoreto de enxofre (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interactiva: Geometria Electrónica: As moléculas assumem formas diferentes devido a padrões de elétrons compartilhados e não compartilhados. Nestes exemplos todos os elétrons que afetam a forma das moléculas são compartilhados nas ligações covalentes que mantêm os átomos juntos para formar as moléculas.
Pares Elétricos Solitários
Elétrons não-ligados estão em orbitais que ocupam espaço, repelem os outros orbitais e mudam a forma de uma molécula.
OBJECTIVOS DE APRENDIZAGEM
Reconhecer o efeito dos pares de electrões solitários nas geometrias das moléculas.
KEY TAKEAWAYS
Key Points
- Orbitals contendo os vários pares de ligação e não ligação na concha da valência estender-se-ão do átomo central em direcções que minimizem as suas repulsões.
- Um orbital sem ligação não tem núcleo atómico na sua extremidade distante para atrair a nuvem de electrões na sua direcção; a carga em tal orbital será portanto concentrada mais perto do átomo central.
- Orbitais sem ligação exercem mais repulsão noutros orbitais do que os orbitais de ligação.
Key Terms
- número de coordenação: em química e cristalografia, o número de vizinhos de um átomo central em uma molécula ou cristal
- par único: um conjunto de valências de dois electrões que existe sem ligação ou partilha com outros átomos
Geometrias moleculares com pares de electrões solitários
Até agora, só discutimos geometrias sem pares de electrões solitários. Como você provavelmente notou na tabela de geometrias e no método AXE, adicionar pares solitários muda a forma de uma molécula. Mencionamos antes que se o átomo central também contém um ou mais pares de elétrons sem ligação, essas regiões adicionais de carga negativa se comportarão muito como aquelas associadas com os átomos ligados. Os orbitais contendo os vários pares de ligação e não ligação na concha da valência se estenderão do átomo central em direções que minimizem suas repulsões mútuas.

Número de coordenação e o átomo central
Número de coordenação refere-se ao número de pares de elétrons que circundam um dado átomo, frequentemente referido como o átomo central. As geometrias das moléculas com pares solitários serão diferentes daquelas sem pares solitários, porque o par solitário parece um espaço vazio numa molécula. Ambas as classes de geometria são nomeadas pelas formas das figuras geométricas imaginárias (na sua maioria polígonos sólidos regulares) que seriam centradas no átomo central e teriam um par de electrões em cada vértice.
Na molécula da água (![]() ), o átomo central é
), o átomo central é ![]() , e a fórmula do ponto de electrões de Lewis prevê que haverá dois pares de electrões sem ligação. O átomo de oxigênio será, portanto, tetrahedralmente coordenado, o que significa que ele se senta no centro do tetraedro. Duas das posições de coordenação são ocupadas pelos pares de elétrons compartilhados que constituem as ligações O-H, e as outras duas pelos pares de não-ligações. Portanto, embora o átomo de oxigênio seja tetrahedralmente coordenado, a geometria de ligação (forma) da molécula
, e a fórmula do ponto de electrões de Lewis prevê que haverá dois pares de electrões sem ligação. O átomo de oxigênio será, portanto, tetrahedralmente coordenado, o que significa que ele se senta no centro do tetraedro. Duas das posições de coordenação são ocupadas pelos pares de elétrons compartilhados que constituem as ligações O-H, e as outras duas pelos pares de não-ligações. Portanto, embora o átomo de oxigênio seja tetrahedralmente coordenado, a geometria de ligação (forma) da molécula ![]() é descrita como dobrada.
é descrita como dobrada.

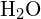 é descrita como bent.
é descrita como bent.O Efeito Repulsivo dos Elétrons de Par Solitário
Existe uma diferença importante entre orbitais de elétrons de ligação e orbitais de elétrons sem ligação. Como um orbital sem ligação não tem núcleo atômico na sua extremidade distante para atrair a nuvem de elétrons em direção a ele, a carga em tal orbital será concentrada mais próxima do átomo central; como consequência, os orbitais sem ligação exercem mais repulsão sobre outros orbitais do que os orbitais de ligação. Em ![]() , as duas orbitais sem ligação empurram as orbitais de ligação mais próximas, fazendo com que o ângulo H-O-H 104,5° em vez do ângulo tetraédrico de 109,5°.
, as duas orbitais sem ligação empurram as orbitais de ligação mais próximas, fazendo com que o ângulo H-O-H 104,5° em vez do ângulo tetraédrico de 109,5°.
A estrutura de pontos de elétron de ![]() coloque um par de elétrons sem ligação na casca de valência do átomo de nitrogênio. Isto significa que existem três átomos ligados e um par único para um número de coordenação de quatro em torno do azoto, o mesmo que ocorre em
coloque um par de elétrons sem ligação na casca de valência do átomo de nitrogênio. Isto significa que existem três átomos ligados e um par único para um número de coordenação de quatro em torno do azoto, o mesmo que ocorre em ![]() .
.

 ..: O par único ligado ao azoto central cria ângulos de ligação que diferem do tetraédrico 109,5 °,
..: O par único ligado ao azoto central cria ângulos de ligação que diferem do tetraédrico 109,5 °, Podemos, portanto, prever que os três átomos de hidrogénio estarão nos cantos de um tetraedro centrado no átomo de azoto. O par orbital único apontará para o quarto canto do tetraedro, mas como essa posição estará vazia, a ![]() molécula em si não pode ser tetraédrica; ao invés disso, ela assume uma forma piramidal, mais especificamente, a de uma pirâmide trigonal (uma pirâmide com uma base triangular). Os átomos de hidrogênio estão todos no mesmo plano, com o nitrogênio fora do plano. Os elétrons não ligantes empurram ligeiramente os orbitais de ligação, fazendo os ângulos de ligação H-N-H cerca de 107°.
molécula em si não pode ser tetraédrica; ao invés disso, ela assume uma forma piramidal, mais especificamente, a de uma pirâmide trigonal (uma pirâmide com uma base triangular). Os átomos de hidrogênio estão todos no mesmo plano, com o nitrogênio fora do plano. Os elétrons não ligantes empurram ligeiramente os orbitais de ligação, fazendo os ângulos de ligação H-N-H cerca de 107°.
Em 5 moléculas coordenadas contendo pares solitários, esses orbitais não ligantes (que estão mais próximos do átomo central e, portanto, mais propensos a serem repelidos por outros orbitais) residirão preferencialmente no plano equatorial. Isto irá colocá-las em ângulos de 90° em relação a não mais de duas orbitais de ligação axialmente orientadas. Podemos portanto prever que uma ![]() molécula (uma em que o átomo central A é coordenado a quatro outros átomos X e a um par de electrões sem ligação) tal como
molécula (uma em que o átomo central A é coordenado a quatro outros átomos X e a um par de electrões sem ligação) tal como ![]() terá uma forma de “ver-serra”.
terá uma forma de “ver-serra”.

Substituindo pares de não-ligação de átomos colados reduz a coordenação bipirâmide triangular a formas moleculares ainda mais simples.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactiva: Elétrons não partilhados e a forma “dobrada”: Use o modelo 3D para ver como os electrões não partilhados repelem aqueles que são partilhados nas ligações entre o hidrogénio e o oxigénio, fazendo com que a molécula tenha uma forma “dobrada”.
LICENÇAS E ATRIBUIÇÕES
CC CONTEÚDO LICENÇADO, COMPARTILHADO ANTERIORAMENTE
- CURAÇÃO E REVISÃO. Fornecido por: Boundless.com. Licença: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory. Licença: CC BY-SA: Attribution-ShareAlike
- Molecular geometria. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/Molecular_geometry. Licença: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licença: CC BY-SA: Attribution-ShareAlike
- Molecular geometria. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/Molecular_geometry. Licença: Domínio Público: Nenhum Copyright conhecido
- Geometrias VSEPR. Fornecido por: Wikimedia. Localizado em: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licença: CC BY-SA: Attribution-ShareAlike
- Como determinar a Geometria Molecular – YouTube. Localizado em: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licença: Domínio Público: Sem Copyright Conhecido. Termos da Licença: Licença padrão do YouTube
- Linear-3D-balls. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licença: CC BY: Atribuição
- Molecular geometria. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/Molecular_geometry. Licença: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory. Licença: CC BY-SA: Attribution-ShareAlike
- VSEPR Theory. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licença: CC BY-SA: Attribution-ShareAlike
- Molecular geometria. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/Molecular_geometry. Licença: Domínio Público: Nenhum Copyright conhecido
- Geometrias VSEPR. Fornecido por: Wikimedia. Localizado em: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licença: CC BY-SA: Attribution-ShareAlike
- Como determinar a Geometria Molecular – YouTube. Localizado em: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licença: Domínio Público: Sem Copyright Conhecido. Termos da Licença: Licença padrão do YouTube
- Linear-3D-balls. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licença: CC BY: Atribuição
- Teoria do VSEPR. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licença: Domínio Público: Não Conhecido Copyright
- Teoria VSEPR. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licença: Domínio Público: Nenhum Copyright conhecido
- número de coordenação. Fornecido por: Wiktionary. Localizado em: http://en.wiktionary.org/wiki/coordination_number. Licença: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Concept Development Studies in Chemistry. 18 de setembro de 2013. Fornecido por: OpenStax CNX. Localizado em: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licença: CC BY: Atribuição
- Sem limites. Fornecido por: Boundless Learning. Localizado em: http://www.boundless.com//chemistry/definition/lone-pair. Licença: CC BY-SA: Attribution-ShareAlike
- Molecular geometria. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/Molecular_geometry. Licença: Domínio Público: Nenhum Copyright conhecido
- Geometrias VSEPR. Fornecido por: Wikimedia. Localizado em: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licença: CC BY-SA: Attribution-ShareAlike
- Como determinar a Geometria Molecular – YouTube. Localizado em: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licença: Domínio Público: Sem Copyright Conhecido. Termos da Licença: Licença padrão do YouTube
- Linear-3D-balls. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licença: CC BY: Atribuição
- Teoria do VSEPR. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licença: Domínio Público: Não Conhecido Copyright
- Teoria VSEPR. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licença: Domínio Público: Não Conhecido Copyright
- Teoria VSEPR. Fornecido por: Wikipedia. Localizado em: http://en.wikipedia.org/wiki/VSEPR_Theory. Licença: Domínio Público: Não Conhecido Copyright
- Tetrahedral_Structure_of_Water.png. Fornecido por: Wikimedia. Localizado em: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licença: Domínio Público: Não Conhecido Copyright
um modelo químico usado para prever a forma de moléculas individuais com base no electrão…par de repulsão eletrostática
o número total de átomos que diretamente vizinham um átomo central numa molécula ou íon
dois (um par de) elétrons de valência que não são usados para formar uma ligação covalente