Propriedades da Água
Uma das coisas que torna o nosso planeta especial é a presença de água líquida. A água é fundamental para toda a vida; sem ela todos os seres vivos morreriam.
A água cobre cerca de 70% da superfície da Terra e constitui 65-75% do nosso corpo (82% do nosso sangue é água). Embora a água possa parecer aborrecida – sem cor, sabor ou cheiro – tem propriedades surpreendentes que a tornam necessária para suportar a vida.
(A nossa necessidade de água e dos animais oceânicos que vivem na água, é o que torna os derrames de óleo tão prejudiciais.)
A composição química da água é H2O – dois átomos de hidrogénio e um átomo de oxigénio. As propriedades da água são especiais devido à forma como os seus átomos se unem para formar uma molécula de água, e à forma como as moléculas interagem entre si.
>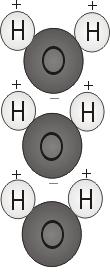
Polaridade da água
Quando os dois átomos de hidrogénio se ligam ao oxigénio, ligam-se à parte superior da molécula como as orelhas do Mickey Mouse. Esta estrutura molecular dá à molécula de água polaridade, ou uma carga eléctrica unilateral que atrai outros átomos.
A extremidade da molécula com os dois átomos de hidrogénio é carregada positivamente. A outra extremidade, com o oxigénio, é carregada negativamente. Tal como num íman, onde os pólos norte são atraídos para os pólos sul (“os opostos atraem”), a extremidade positiva da molécula da água liga-se à extremidade negativa de outras moléculas.
O que é que isto significa para nós? A polaridade da água permite a dissolução de outras substâncias polares muito facilmente. Quando uma substância polar é colocada na água, as extremidades positivas de suas moléculas são atraídas para as extremidades negativas das moléculas da água, e vice-versa. As atrações fazem com que as moléculas da nova substância sejam misturadas uniformemente com as moléculas de água.
A água dissolve mais substâncias que qualquer outro líquido – mesmo o ácido mais forte! Por causa disso, é muitas vezes chamado de ‘solvente universal’. O poder dissolvente da água é muito importante para a vida na Terra. Onde quer que a água vá, ela carrega produtos químicos dissolvidos, minerais e nutrientes que são usados para suportar seres vivos.
Por causa da sua polaridade, as moléculas de água são fortemente atraídas umas pelas outras, o que dá à água uma alta tensão superficial. As moléculas na superfície da água “colam-se” para formar um tipo de “pele” na água, forte o suficiente para suportar objectos muito leves. Os insectos que caminham sobre a água estão a tirar partido desta tensão superficial.
Tensão superficial faz com que a água se aglomere em gotas em vez de se espalhar numa camada fina.
Permite também que a água se mova através das raízes e caules das plantas, termómetros e os mais pequenos vasos sanguíneos do seu corpo. À medida que uma molécula se move para cima, ela ‘puxa’ as outras com ela.
Três estados da matéria
A água é um dos quatro elementos, e a única substância natural que pode existir nos três estados da matéria – sólida, líquida e gasosa – às temperaturas normalmente encontradas na Terra.
Muitas outras substâncias têm de ser sobreaquecidas ou -arrefecidas para mudar de estado.
O estado gasoso da água está presente continuamente na nossa atmosfera como vapor de água. O estado líquido é encontrado em toda parte em rios, lagos e oceanos.
O estado sólido da água, gelo, é único. A maioria dos líquidos contraem-se à medida que são resfriados, porque as moléculas se movem mais lentamente e têm menos energia para resistir à atração umas pelas outras. Quando congelam em sólidos, formam cristais bem compactados que são muito mais densos do que o líquido era originalmente.
A água não age desta forma. Quando congela, expande-se: as moléculas alinham para formar uma estrutura cristalina muito ‘aberta’ que é menos densa que a água líquida.
É por isso que o gelo flutua. E é uma coisa boa que ele faz! Se a água agisse como a maioria dos outros líquidos, lagos e rios congelariam sólidos e toda a vida neles morreria.
Três Outras Propriedades da Água
A água tem um alto calor específico. Ou seja, ao contrário do ar, a água pode absorver muito calor sem alterar a temperatura. É por isso que nadar é tão refrescante num dia quente.
A água também perde calor mais lentamente do que o ar. O resultado é que no verão, a água do lago e do mar é geralmente mais fria no início da estação e mais quente no final da estação (após muitos dias de absorção da energia solar).
O ponto de ebulição da água (212° F ou 100°C ao nível do mar) é afetado pela altitude. Em geral, quanto maior a altitude, mais baixo o ponto de ebulição da água. Por exemplo, em Denver, CO (5.280 pés), a água ferve a 202,4° F. No Monte Everest no Nepal (29.012 pés), a água ferve a 156° F.
Projetos de Ciências da Água:
- O Ciclo da Água
- Roda da Água
- Água Super-resfriada
- Reservatório de Água