Forma de dosagem: cápsula
Revisado medicamente por Drugs.com. Última atualização em 1º de outubro de 2020.
- Visão geral
- Efeitos secundários
- Dosagem
- Profissional
- Dicas
- Interações
- Mais
Diminuir o desenvolvimento de drogas…bactérias resistentes e manter a eficácia da nitrofurantoína (macrocristais) e de outros medicamentos antibacterianos, A nitrofurantoína (macrocristais) deve ser usada apenas para tratar ou prevenir infecções que, comprovada ou fortemente suspeita de serem causadas por bactérias.
- DESCRIÇÃO:
- FARMACOLOGIA CLÍNICA:
- MICROBIOLOGIA
- Mecanismo de Ação
- Interações com outros antibióticos
- Desenvolvimento de resistência
- INDICAÇÕES E UTILIZAÇÃO:
- CONTRAINDICAÇÕES:
- AVISOS:
- Reações pulmonares:
- Hepatotoxicidade:
- Neuropatia:
- Anemia hemolítica:
- Diarreia associada aoClostridium difficile:
- PRECAUÇÕES:
- Informação para pacientes:
- Geral:
- Interacções Drogas:
- Drug/Laboratory Test Interactions:
- Carcinogénese, Mutagénese, Desvalorização da Fertilidade:
- Gravidez:
- Gravidez Categoria B.
- Labor e parto:
- Mães amamentadoras:
- Uso Pediátrico:
- Uso Geriátrico:
- REAÇÕES PULMONARES:
- Respiratórias:
- Hepática:
- Neurológica:
- Dermatologic:
- Alérgica:
- Gastrointestinal:
- Hematologic:
- Diversos:
- Eventos adversos laboratoriais:
- Oversidade
- DOSAGEM E ADMINISTRAÇÃO:
- Adultos:
- Pacientes pediátricos:
- COMO FORNECIDO:
- PRINCIPAL DISPLAY PANEL – 50 mg
- PRINCIPAL DISPLAY PANEL – 100 mg
- Perguntas frequentes
- Mais sobre a nitrofurantoína
- Recursos do consumidor
- Recursos profissionais
- Guias de tratamento relacionadas
DESCRIÇÃO:
Nitrofurantoína, USP (macrocristais) é uma substância química sintética de tamanho cristalino controlado. É um composto estável, amarelo, cristalino. Nitrofurantoína, USP (macrocristais) é um agente antibacteriano para infecções específicas do trato urinário. Está disponível em cápsulas de 25 mg, 50 mg e 100 mg para administração oral.
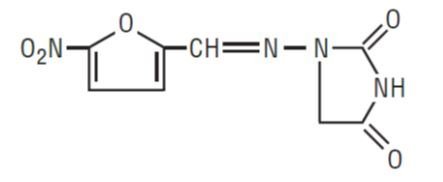
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Ingredientes inativos: Cada cápsula contém D&C Amarelo # 10, FD&C Azul # 1, FD&C Azul # 2, FD&C Vermelho # 40, gelatina, óxido de ferro preto, lactose anidra, estearato de magnésio, amido de milho pré-gelatinizado, sulfato de laurilo de sódio, talco e dióxido de titânio. As cápsulas de 50 mg e 100 mg também contêm FD&C Amarelo No. 6.
FARMACOLOGIA CLÍNICA:
Nitrofurantoína (macrocristais) é uma forma cristalina maior de nitrofurantoína. A absorção da nitrofurantoína (macrocristais) é mais lenta e a sua excreção um pouco menor quando comparada com a nitrofurantoína. As concentrações sanguíneas na dose terapêutica são geralmente baixas. É altamente solúvel na urina, à qual pode conferir uma cor marrom.
Seguindo um regime de dose de 100 mg quatro vezes ao dia durante 7 dias, a média de recuperação de drogas urinárias (0 a 24 horas) no dia 1 e dia 7 foi de 37.9% e 35,0%.
Não como muitos medicamentos, a presença de alimentos ou agentes que atrasam o esvaziamento gástrico pode aumentar a biodisponibilidade da nitrofurantoína (macrocristais), presumivelmente permitindo uma melhor dissolução em sucos gástricos.
MICROBIOLOGIA
Nitrofurantoína é um agente antimicrobiano de nitrofurantoína com atividade contra certas bactérias Gram-positivas e Gram-negativas.
Mecanismo de Ação
O mecanismo da ação antimicrobiana da nitrofurantoína é incomum entre os antibacterianos. A nitrofurantoína é reduzida pelas flavoproteínas bacterianas para intermediários reativos que inativam ou alteram as proteínas ribossômicas bacterianas e outras acromoleculas. Como resultado de tais inativações, os processos bioquímicos vitais de síntese de proteínas, metabolismo de energia aeróbica, síntese de DNA, síntese de RNA e síntese da parede celular são inibidos. A nitrofurantoína é bactericida na urina em doses terapêuticas. A natureza ampla deste modo de ação pode explicar a falta de resistência bacteriana adquirida à nitrofurantoína, pois as mutações múltiplas e simultâneas necessárias das macromoléculas alvo seriam provavelmente letais para as bactérias.
Interações com outros antibióticos
Foi demonstrado in vitro o antagonismo entre nitrofurantoína e antimicrobianos de quinolona. O significado clínico desta descoberta é desconhecido.
Desenvolvimento de resistência
Desenvolvimento de resistência à nitrofurantoína não tem sido um problema significativo desde a sua introdução em 1953. A resistência cruzada com antibióticos e sulfonamidas não tem sido observada, e a resistência transferível é, no máximo, um fenômeno muito raro.
Nitrofurantoína demonstrou ser activa contra a maioria das estirpes das seguintes bactérias tanto in vitro como em infecções clínicas (ver Indicações e Uso):
Microorganismos Gram-positivos e facultativos:
Staphylococcus aureus
Enterocococos (por exemplo Enterococcus faecalis)
Microorganismos Gram-negativos aeróbicos e facultativos:
Escherichia coli
NOTE: Enquanto a nitrofurantoína tem excelente actividade contra Enterococcus faecalis, a maioria dos isolados de Enterococcus faecium não são susceptíveis à nitrofurantoína.
Pelo menos 90% dos seguintes microrganismos apresentam uma concentração inibitória mínima (MIC) in vitro menor ou igual ao ponto de quebra susceptível para a nitrofurantoína. Contudo, a eficácia da nitrofurantoína no tratamento de infecções clínicas devido a estes microrganismos não foi estabelecida em ensaios adequados e bem controlados.
Microorganismos aeróbicos e facultativos Gram-positivos:
Estafilocococos coagulase negativos (incluindo Staphylococcus
epidermidis e Staphylococcus saprophyticus)
Streptococcus agalactiae
Estirptoptococos do grupo D
Estirptoptococos do grupo Viridans
Gramatócocos aeróbios e facultativosmicroorganismos negativos:
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTE: Algumas estirpes de Enterobacter e Klebsiella são resistentes à nitrofurantoína.
Teste de suscetibilidade:
Para informações específicas sobre critérios interpretativos de testes de suscetibilidade e métodos de teste associados e padrões de controle de qualidade reconhecidos pelo FDA para este medicamento, por favor veja: https://www.fda.gov/STIC.
INDICAÇÕES E UTILIZAÇÃO:
Nitrofurantoína em cápsulas (macrocristais) são especificamente indicadas para o tratamento de infecções do tracto urinário quando devido a estirpes susceptíveis de Escherichia coli, enterococos, Staphylococcus aureus, e certas estirpes susceptíveis de Klebsiella e Enterobacter.
Nitrofurantoína não é indicada para o tratamento de pielonefrite ou abcessos perinefríticos.
Para reduzir o desenvolvimento de bactérias resistentes a drogas e manter a eficácia das cápsulas de nitrofurantoína (macrocristais) e outros medicamentos antibacterianos, as cápsulas de nitrofurantoína (macrocristais) devem ser usadas apenas para tratar ou prevenir infecções que estão provadas ou fortemente suspeitas de serem causadas por bactérias susceptíveis. Quando a cultura e a informação de susceptibilidade estão disponíveis, devem ser consideradas na selecção ou modificação da terapia antibacteriana. Na ausência de tais dados, a epidemiologia local e padrões de susceptibilidade podem contribuir para a seleção empírica da terapia.
Nitrofurantoinas não têm a distribuição mais ampla dos tecidos de outros agentes terapêuticos aprovados para infecções do trato urinário. Consequentemente, muitos pacientes que são tratados com cápsulas de nitrofurantoína (macrocristais) são predispostos à persistência ou reaparecimento de bacteriúria. As amostras de urina para cultura e testes de susceptibilidade devem ser obtidas antes e após a conclusão da terapia. Se a persistência ou o reaparecimento de bacteriúria ocorrer após o tratamento com cápsulas de nitrofurantoína (macrocristais), devem ser selecionados outros agentes terapêuticos com distribuição tecidual mais ampla. Ao considerar o uso de cápsulas de nitrofurantoína (macrocristais), menores taxas de erradicação devem ser balanceadas contra o potencial aumentado de toxicidade sistêmica e para o desenvolvimento de resistência antimicrobiana quando agentes com distribuição tecidual mais ampla são utilizados.
CONTRAINDICAÇÕES:
Anuria, oligúria ou comprometimento significativo da função renal (clearance de creatinina abaixo de 60 ml por minuto ou creatinina sérica elevada clinicamente significativa) são contra-indicações. O tratamento deste tipo de paciente acarreta um risco aumentado de toxicidade por causa da excreção deficiente do medicamento. Devido à possibilidade de anemia hemolítica devido a sistemas de enzimas eritrocitárias imaturas (instabilidade do glutationa), a droga é contra-indicada em pacientes grávidas a termo (38 a 42 semanas de gestação), durante o trabalho de parto e parto, ou quando o início do trabalho de parto é iminente. Pela mesma razão, a droga está contra-indicada em recém-nascidos com menos de um mês de idade.
Nitrofurantoína em cápsulas (macrocristais) estão contra-indicadas em pacientes com história prévia de icterícia colestática/disfunção hepática associada à nitrofurantoína.
Nitrofurantoína em cápsulas (macrocristais) também estão contra-indicadas em pacientes com hipersensibilidade conhecida à nitrofurantoína.
AVISOS:
Reações pulmonares:
ACUTO, SUBACUTO OU REACÇÕES PULMONARES CRÔNICAS TÊM sido OBSERVADAS EM PATIENTES TRATADOS COM NITROFURANTOINA. SE ESTAS REACÇÕES OCORREREM, A NITROFURANTOÍNA (MACROCRISTAIS) DEVE SER DESCONTINUADA E DEVEM SER TOMADAS AS MEDIDAS APROPRIADAS. RELATOS TÊM CITADO REAÇÕES PULMONARES COMO UMA CAUSA CONTRIBUINTE DE MORTE.
REAÇÕES PULMONARES CRÔNICAS (PNEUMONIA INTERSTICIAL DIFUSA OU FIBROSE PULMONAR, OU AMBAS) PODEM DESENVOLVER-SE DE FORMA INSIDIOSA. ESSAS REAÇÕES OCORREM RARAMENTE E GERALMENTE EM PACIENTES QUE RECEBEM TERAPIA POR SEIS MESES OU MAIS. O ACOMPANHAMENTO PRÓXIMO DA CONDIÇÃO PULMONAR DOS PACIENTES QUE RECEBEM TERAPIA A LONGO PRAZO É GARANTIDO E REQUER QUE OS BENEFÍCIOS DA TERAPIA SEJAM PONDERADOS CONTRA RISCOS POTENCIAIS (VER REACÇÕES RESPIRATÓRIAS).
Hepatotoxicidade:
Reacções hepáticas, incluindo hepatite, icterícia colestática, hepatite crónica activa e necrose hepática, ocorrem raramente. Foram relatadas fatalidades. O início da hepatite crónica activa pode ser insidioso e os pacientes devem ser monitorizados periodicamente para detectar alterações nos testes bioquímicos que possam indicar lesões hepáticas. Se ocorrer hepatite, a droga deve ser retirada imediatamente e devem ser tomadas medidas apropriadas.
Neuropatia:
Neuropatia periférica, que pode tornar-se grave ou irreversível, já ocorreu. Foram relatadas fatalidades. Condições como comprometimento renal (clearance de creatinina abaixo de 60 ml por minuto ou creatinina sérica elevada clinicamente significativa), anemia, diabetes melito, desequilíbrio eletrolítico, deficiência de vitamina B e doença debilitante podem aumentar a ocorrência de neuropatia periférica. Pacientes que recebem terapia a longo prazo devem ser monitorados periodicamente para alterações na função renal.
Neuropatia óptica tem sido relatada raramente na experiência pós-comercialização com formulações de nitrofurantoína.
Anemia hemolítica:
Casos de anemia hemolítica do tipo primaquina-sensibilidade têm sido induzidos pela nitrofurantoína. A hemólise parece estar ligada a uma deficiência de glucose-6-fosfato desidrogenase nos glóbulos vermelhos dos pacientes afetados. Esta deficiência é encontrada em 10% dos negros e numa pequena percentagem de grupos étnicos de origem mediterrânica e do Próximo Oriente. A hemólise é uma indicação para descontinuar a nitrofurantoína (macrocristais); a hemólise cessa quando o medicamento é retirado.
Diarreia associada aoClostridium difficile:
Diarreia associada aoClostridium difficile (CDAD) tem sido relatada com o uso de quase todos os agentes antibacterianos, incluindo nitrofurantoína, e pode variar em gravidade desde a diarreia ligeira até à colite fatal. O tratamento com agentes antibacterianos altera a flora normal do cólon levando ao crescimento excessivo de C. difficile.
C. difficile produz toxinas A e B que contribuem para o desenvolvimento de CDAD. As cepas produtoras de hipertoxina de C. difficile causam aumento da morbilidade e mortalidade, uma vez que estas infecções podem ser refratárias à terapia antimicrobiana e podem requerer colectomia. O CDAD deve ser considerado em todos os pacientes que apresentam diarréia após o uso de antibióticos. A história médica cuidadosa é necessária uma vez que o CDAD tem sido relatado para ocorrer mais de dois meses após a administração de agentes antibacterianos. Se houver suspeita ou confirmação de CDAD, o uso contínuo de antibióticos não direcionados contra C. difficile pode precisar ser descontinuado. O manejo apropriado de líquidos e eletrólitos, suplementação proteica, tratamento antibiótico de C. difficile e avaliação cirúrgica devem ser instituídos como clinicamente indicado.
PRECAUÇÕES:
Informação para pacientes:
Pacientes devem ser aconselhados a tomar nitrofurantoína (macrocristais) com alimentos para aumentar ainda mais a tolerância e melhorar a absorção de medicamentos. Os pacientes devem ser instruídos a completar o curso completo da terapia; no entanto, devem ser aconselhados a contactar o seu médico se algum sintoma incomum ocorrer durante a terapia.
Muitos pacientes que não podem tolerar nitrofurantoína microcristalina são capazes de tomar nitrofurantoína (macrocristais) sem náusea.
As pacientes devem ser aconselhadas a não usar preparações antiácidas contendo trisilicato de magnésio enquanto estiverem a tomar nitrofurantoína (macrocristais).
As pacientes devem ser aconselhadas a não usar medicamentos antibacterianos incluindo nitrofurantoína (macrocristais) apenas para tratar infecções bacterianas. Eles não tratam infecções virais (por exemplo, a constipação comum). Quando a nitrofurantoína (macrocristais) é prescrita para tratar uma infecção bacteriana, os pacientes devem ser informados de que, embora seja comum sentir-se melhor no início do tratamento, o medicamento deve ser tomado exactamente como indicado. Saltar doses ou não completar o curso completo da terapia pode (1) diminuir a eficácia do tratamento imediato e (2) aumentar a probabilidade de as bactérias desenvolverem resistência e não serem tratadas com nitrofurantoína (macrocristais) ou outros medicamentos antibacterianos no futuro.
Diarreia é um problema comum causado por antibióticos que normalmente termina quando o antibiótico é descontinuado. Às vezes, após iniciar o tratamento com antibióticos, os pacientes podem desenvolver fezes aquosas e com sangue (com ou sem cólicas estomacais e febre) mesmo dois ou mais meses depois de ter tomado a última dose do antibiótico. Se isto ocorrer, os pacientes devem contactar o seu médico o mais rápido possível.
Geral:
Prescrição de nitrofurantoína (macrocristais) na ausência de uma infecção bacteriana comprovada ou fortemente suspeita ou uma indicação profilática é pouco provável que traga benefícios ao paciente e aumenta o risco do desenvolvimento de bactérias resistentes aos medicamentos.
Interacções Drogas:
Anácidos contendo trisilicato de magnésio, quando administrados concomitantemente com nitrofurantoína, reduzem tanto a taxa como a extensão da absorção. O mecanismo para esta interação provavelmente é a adsorção de nitrofurantoína na superfície do trisilicato de magnésio.
Fármacos uricosúricosúricos, como o probenecid e a sulfinpirazona, podem inibir a secreção tubular renal de nitrofurantoína. O aumento resultante nos níveis séricos de nitrofurantoína pode aumentar a toxicidade, e a diminuição dos níveis urinários pode diminuir sua eficácia como antibacteriano do trato urinário.
Drug/Laboratory Test Interactions:
Como resultado da presença de nitrofurantoína, uma falsa reação positiva para glicose na urina pode ocorrer. Isto foi observado com as soluções de Benedict e Fehling, mas não com o teste enzimático de glicose.
Carcinogénese, Mutagénese, Desvalorização da Fertilidade:
Nitrofurantoína não foi cancerígena quando administrada a ratos Holtzman fêmeas durante 44,5 semanas ou a ratos Sprague-Dawley fêmeas durante 75 semanas. Dois bioensaios roedores crônicos utilizando ratos Sprague-Dawley machos e fêmeas e dois bioensaios crônicos em ratos suíços e em ratos BDF1 não revelaram evidência de carcinogenicidade.
Nitrofurantoína apresentou evidência de atividade carcinogênica em ratos B6C3F1 fêmeas como mostrado pelo aumento da incidência de adenomas tubulares, tumores mistos benignos e tumores de células granulosas do ovário. Em ratos F344/N do sexo masculino, houve aumento na incidência de neoplasias incomuns de células tubulares renais, osteosarcomas do osso e neoplasias do tecido subcutâneo. Em um estudo envolvendo a administração subcutânea de 75 mg/kg de nitrofurantoína em ratos fêmeas grávidas, foram observados adenomas papilares pulmonares de importância desconhecida na geração F1.
Nitrofurantoína demonstrou induzir mutações pontuais em certas cepas de Salmonella typhimurium e mutações frontais em células linfoma de camundongos L5178Y. A nitrofurantoína induziu o aumento do número de trocas cromatídicas irmãs e aberrações cromossômicas nas células do ovário do hamster chinês, mas não nas células humanas em cultura. Os resultados do ensaio recessivo e letal ligado ao sexo em Drosophila foram negativos após a administração de nitrofurantoína por alimentação ou por injeção. A nitrofurantoína não induziu mutação hereditária nos modelos de roedores examinados.
O significado dos achados de carcinogenicidade e mutagenicidade relativos ao uso terapêutico da nitrofurantoína em humanos é desconhecido.
A administração de altas doses de nitrofurantoína a ratos causa parada espermatogênica temporária; isto é reversível ao descontinuar a droga. Doses de 10 mg/kg/dia ou superiores em homens humanos saudáveis podem, em certos casos imprevisíveis, produzir uma paragem espermatogénica ligeira a moderada com uma diminuição da contagem de esperma.
Gravidez:
Efeitos teratogénicos:
Gravidez Categoria B.
Estudos de reprodução animal foram realizados em coelhos e ratos em doses até seis vezes superiores à dose humana e não revelaram evidências de comprometimento da fertilidade ou danos ao feto devido à nitrofurantoína. Em um único estudo publicado realizado em ratos em 68 vezes a dose humana (baseada em mg/kg administrado à represa), foram observados retardo de crescimento e baixa incidência de malformações menores e comuns. No entanto, em 25 vezes a dose humana, não foram observadas malformações fetais; a relevância destes achados para os seres humanos é incerta. Não existem, contudo, estudos adequados e bem controlados em mulheres grávidas. Como os estudos de reprodução animal nem sempre são preditivos da resposta humana, esta droga deve ser usada durante a gravidez apenas se claramente necessária.
Efeitos Não-Teratogênicos:
Nitrofurantoína foi demonstrado em um estudo de carcinogenicidade transplacentária publicado para induzir adenomas papilares pulmonares nos ratos da geração F1 em doses 19 vezes maiores que a dose humana na base de mg/kg. A relação deste achado com a potencial carcinogênese humana é atualmente desconhecida. Devido à incerteza quanto às implicações humanas destes dados animais, esta droga deve ser usada durante a gravidez apenas se claramente necessária.
Labor e parto:
Veja CONTRAINDICAÇÕES.
Mães amamentadoras:
Nitrofurantoína foi detectada no leite materno humano em quantidades vestigiais. Devido ao potencial de reacções adversas graves da nitrofurantoína em lactentes com menos de um mês de idade, deve ser tomada a decisão de interromper a amamentação ou não, tendo em conta a importância da droga para a mãe (ver CONTRAINDICAÇÕES).
Uso Pediátrico:
Nitrofurantoína (macrocristais) está contra-indicada em lactentes com idade inferior a um mês (ver CONTRAINDICAÇÕES).
Uso Geriátrico:
Estudos clínicos de nitrofurantoína (macrocristais) não incluíram número suficiente de indivíduos com idade igual ou superior a 65 anos para determinar se eles respondem de forma diferente dos indivíduos mais jovens. Outras experiências clínicas relatadas não identificaram diferenças nas respostas entre os pacientes idosos e os mais jovens. Relatos espontâneos sugerem uma maior proporção de reações pulmonares, incluindo fatalidades, em pacientes idosos; essas diferenças parecem estar relacionadas com a maior proporção de pacientes idosos que recebem terapia com nitrofurantoína a longo prazo. Como em pacientes mais jovens, as reações pulmonares crônicas geralmente são observadas em pacientes que recebem terapia por seis meses ou mais (ver ADVERTÊNCIAS). Relatos espontâneos também sugerem uma maior proporção de reações hepáticas graves, incluindo fatalidades, em pacientes idosos (ver AVISOS).
Em geral, a maior freqüência de diminuição da função hepática, renal ou cardíaca, e de doença concomitante ou outra terapia medicamentosa deve ser considerada quando se prescreve nitrofurantoína (macrocristais). Este fármaco é conhecido por ser substancialmente excretado pelo rim, e o risco de reacções tóxicas a este fármaco pode ser maior em doentes com função renal reduzida. Anuria, oligúria ou comprometimento significativo da função renal (clearance de creatinina abaixo de 60 mL por minuto ou creatinina sérica elevada clinicamente significativa) são contra-indicações (ver CONTRAINDICAÇÕES). Como os pacientes idosos são mais propensos a ter função renal diminuída, deve-se tomar cuidado na seleção da dose, e pode ser útil monitorar a função renal.
REAÇÕES PULMONARES:
Respiratórias:
REAÇÕES PULMONARES CRÔNICAS, SUBACUTADAS OU PULMONARES ACUTADAS DE HIPERSENSITIVIDADE PODEM OBRIGATÓRIAS.
REAÇÕES PULMONARES CRÔNICAS OBRIGATÓRIAS EM PATIENTES QUE RECEBEM TRATAMENTO CONTINUADO POR SEIS MESES OU LONGARES. MAL-ESTAR, DISPNÉIA AO ESFORÇO, TOSSE E ALTERAÇÃO DA FUNÇÃO PULMONAR SÃO MANIFESTAÇÕES COMUNS QUE PODEM OCORRER DE FORMA INSIDIOSA. ACHADOS RADIOLÓGICOS E HISTOLÓGICOS DE PNEUMONITE OU FIBROSE INTERSTICIAL DIFUSA, OU AMBOS, TAMBÉM SÃO MANIFESTAÇÕES COMUNS DA REAÇÃO PULMONAR CRÔNICA. A FEBRE É RARAMENTE PROEMINENTE.
A GRAVIDADE DAS REAÇÕES PULMONARES CRÔNICAS E SEU GRAU DE RESOLUÇÃO PARECEM ESTAR RELACIONADOS À DURAÇÃO DA TERAPIA APÓS O APARECIMENTO DOS PRIMEIROS SINAIS CLÍNICOS. A FUNÇÃO PULMONAR PODE SER PREJUDICADA PERMANENTEMENTE, MESMO APÓS A INTERRUPÇÃO DA TERAPIA. O RISCO É MAIOR QUANDO AS REACÇÕES PULMONARES CRÔNICAS NÃO SÃO RECONHECIDAS A ORIENTAMENTE.
Em reações pulmonares subagudas, a febre e a eosinofilia ocorrem com menor freqüência do que na forma aguda. Após a interrupção da terapia, a recuperação pode requerer vários meses. Se os sintomas não forem reconhecidos como sendo relacionados a drogas e a terapia com nitrofurantoína não for interrompida, os sintomas podem tornar-se mais graves.
Reações pulmonares agudas são comumente manifestadas por febre, calafrios, tosse, dor torácica, dispnéia, infiltração pulmonar com consolidação ou derrame pleural na radiografia, e eosinofilia. Reações agudas geralmente ocorrem na primeira semana do tratamento e são reversíveis com a interrupção da terapia. A resolução é frequentemente dramática (ver AVISOS).
Alterações no ECG (por exemplo alterações não específicas da onda ST/T, bloqueio de ramo) têm sido relatadas em associação com reações pulmonares.
Cianose tem sido relatada raramente.
Hepática:
Reações hepáticas, incluindo hepatite, icterícia colestática, hepatite crônica ativa e necrose hepática, ocorrem raramente (ver ADVERTÊNCIAS).
Neurológica:
Neuropatia periférica, que pode tornar-se grave ou irreversível, tem ocorrido. Foram relatadas fatalidades. Condições como insuficiência renal (clearance de creatinina abaixo de 60 ml por minuto ou creatinina sérica elevada clinicamente significativa), anemia, diabetes mellitus, desequilíbrio eletrolítico, deficiência de vitamina B e doenças debilitantes podem aumentar a possibilidade de neuropatia periférica (ver ADVERTÊNCIAS).
Astenia, vertigem, nistagmo, tontura, dor de cabeça e sonolência também têm sido relatadas com o uso de nitrofurantoína.
Hipertensão intracraniana benigna (pseudotumor cerebri), confusão, depressão, neurite óptica e reações psicóticas têm sido relatadas raramente. Fontanelas búlgaras, como sinal de hipertensão intracraniana benigna em lactentes, têm sido relatadas raramente.
Dermatologic:
Dermatose esfoliante e eritema multiforme (incluindo síndrome de Stevens-Johnson) têm sido relatadas raramente. Alopécia transitória também tem sido relatada.
Alérgica:
Síndrome tipo lúpus associada a reações pulmonares à nitrofurantoína tem sido relatada. Também, angioedema; erupções maculopapulares, eritematosas ou eczematosas; prurido; urticária; anafilaxia; artralgia; mialgia; mialgia; febre medicamentosa; calafrios; e vasculite (às vezes associada a reações pulmonares) foram relatadas. Reações de hipersensibilidade representam os eventos adversos mais freqüentemente relatados espontaneamente na experiência mundial pós-comercialização com formulações de nitrofurantoína.
Gastrointestinal:
Nausea, emese e anorexia ocorrem com mais freqüência. Dor abdominal e diarréia são reações gastrointestinais menos comuns. Estas reacções relacionadas com a dose podem ser minimizadas através da redução da dose. Sialadenite e pancreatite têm sido relatadas. Tem havido relatos esporádicos de colite pseudomembranosa com o uso de nitrofurantoína. O aparecimento de sintomas de colite pseudomembranosa pode ocorrer durante ou após o tratamento antimicrobiano (ver ADVERTÊNCIAS).
Hematologic:
Cianose secundária à metemoglobinemia tem sido relatada raramente.
Diversos:
As com outros agentes antimicrobianos, superinfecções causadas por organismos resistentes, por exemplo, Pseudomonas ou espécies de Candida, podem ocorrer.
Eventos adversos laboratoriais:
Os seguintes eventos adversos laboratoriais foram relatados com o uso de nitrofurantoína: aumento da AST (SGOT), aumento da ALT (SGPT), diminuição da hemoglobina, aumento do fósforo sérico, eosinofilia, anemia por deficiência de glucose-6-fosfato desidrogenase (ver AVISOS), agranulocitose, leucopenia, granulocitopenia, anemia hemolítica, trombocitopenia, anemia megaloblástica. Na maioria dos casos, estas anomalias hematológicas são resolvidas após a interrupção do tratamento. A anemia aplástica tem sido relatada raramente.
Oversidade
Acidentes ocasionais de superdosagem aguda de nitrofurantoína (macrocristais) não resultaram em nenhum outro sintoma específico além do vômito. A indução da emese é recomendada. Não há antídoto específico, mas uma alta ingestão de líquidos deve ser mantida para promover a excreção urinária do medicamento. É dializável.
DOSAGEM E ADMINISTRAÇÃO:
Nitrofurantoína em cápsulas (macrocristais) deve ser administrada com alimentos para melhorar a absorção do medicamento e, em alguns pacientes, a tolerância.
Adultos:
50 mg a 100 mg quatro vezes por dia — o nível de dosagem mais baixo é recomendado para infecções do tracto urinário não complicadas.
Pacientes pediátricos:
5 a 7 mg/kg de peso corporal por 24 horas, dado em quatro doses divididas (contra-indicado abaixo de um mês de idade).
Terapia deve ser continuada por uma semana ou por pelo menos 3 dias após a esterilidade da urina ser obtida. Infecção contínua indica a necessidade de reavaliação.
Para terapia supressiva a longo prazo em adultos, uma redução da dosagem para 50-100 mg na hora de dormir pode ser adequada. Para terapia supressora a longo prazo em pacientes pediátricos, doses tão baixas quanto 1 mg/kg por 24 horas, administradas em dose única ou em duas doses divididas, podem ser adequadas. VER SEÇÃO DE AVISOS RISCOS ASSOCIADOS COM TERAPIA DE LONGO PRAZO.
COMO FORNECIDO:
Nitrofurantoína As cápsulas USP (macrocristais) estão disponíveis da seguinte forma:
50 mg de corpo opaco, branco e opaco, tampa amarela impressa em tinta preta com “WATSON” na tampa e “5780” no corpo.
NDC 0115-2023-10 frascos de 100
100 mg de cápsula amarela opaca impressa em tinta preta com “WATSON” na tampa e “5781” no corpo.
NDC 0115-2024-10 frascos de 100
Coloja a 20° a 25°C (68° a 77°F) .
Fabricado por:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 ÍNDIA
Distribuído por:
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Para relatar REACÇÕES ADVERSADAS SUSPECTIDAS, contacte a Amneal Pharmaceuticals pelo 1-877-835-5472 ou a FDA pelo 1-800-FDA-1088 ou www.fda.gov/medwatch.
Rev. 11-2019-00
PRINCIPAL DISPLAY PANEL – 50 mg

PRINCIPAL DISPLAY PANEL – 100 mg

| NITROFURANTOIN cápsula de nitrofurantoína |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| NITROFURANTOINA cápsula de nitrofurantoína |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Etiqueta – Amneal Pharmaceuticals of New York LLC (123797875)
>
>
Perguntas frequentes
- Que antibióticos são usados para tratar as IU?
- O que é nitrofurantoína de “dupla liberação”?
>
Mais sobre a nitrofurantoína
- Efeitos secundários
- Durante a gravidez ou amamentação
- Informações sobre a dosagem
- Dicas para doentes
- Droga Imagens
- Interações de Drogas
- Comparar Alternativas
- Grupo de Apoio
- Preço& Cupões
- En Español
- 1538 Revisões
- Classe de Drogas: urinário anti-infectantes
>
>
>
>
Recursos do consumidor
- Informação do paciente
- Nitrofurantoína (Leitura avançada)
Recursos profissionais
- Prescrição Informações
- Nitrofurantoin (Aconselhamento profissional ao paciente)
- Nitrofurantoin Capsules (FDA)
- Nitrofurantoin Oral Suspension (FDA)
Outras marcas Macrobid, Macrodantin, Furadantin
Guias de tratamento relacionadas
- Infecção urinária
- Prevenção da infecção da bexiga
- Infecção da bexiga
Relatação de responsabilidade médica