O que são enzimas e o que fazem no nosso corpo? Enzimas são basicamente proteínas que são produzidas por organismos vivos para provocar certas reacções metabólicas e bioquímicas no organismo. São catalisadores biológicos que aceleram as reacções no interior do organismo. Vamos descobrir mais sobre elas.
>
Vídeos gravados:
>
Qual é a Estrutura das Enzimas?
Enzimas, como mencionado acima, são catalisadores biológicos. Enquanto eles aceleram ou aceleram um processo, eles estão na verdade fornecendo um caminho alternativo para o processo. Mas, no processo, a estrutura ou composição das enzimas permanecem inalteradas.
Enzimas são na verdade constituídas por 1000s de aminoácidos que estão ligados de uma forma específica para formar diferentes enzimas. As cadeias enzimáticas dobram-se para formar formas únicas e são estas formas que fornecem a enzima com o seu potencial químico característico. A maioria das enzimas também contém um componente não protéico conhecido como co-factor.
- Biomacromolecules
- Bond linking Monomers
- Enzymes
- Base Metabólica para Viver
- Ácidos Nucleicos
- Polissacarídeos
- Proteínas
Tipos de Enzimas:
As reacções bioquímicas que ocorrem no corpo são basicamente de 6 tipos e as enzimas que provocam estas reacções são nomeadas de acordo:
- Oxidoreductases: Estas enzimas provocam reacções de oxidação e redução e por isso são chamadas de oxidoreductases. Nestas reacções, são transferidos electrões sob a forma de iões hidretos ou átomos de hidrogénio. Quando um substrato está sendo oxidado, estas enzimas atuam como doadoras de hidrogênio. Estas enzimas são chamadas desidrogenases ou reductases. Quando o átomo de oxigênio é o aceitador, estas enzimas são chamadas oxidases.
- Transferases: Estas enzimas são responsáveis pela transferência de grupos funcionais de uma molécula para outra. Exemplo: alanina-aminotransferase que embaralha o grupo alfa-amino entre alanina e aspartato, etc. Algumas transferases também transferem grupos de fosfato entre ATP e outros compostos, resíduos de açúcar para formar dissacarídeos como a hexoquinase em glicólise.
- Hidrolases: Estas enzimas catalisam reações que envolvem o processo de hidrólise. Elas quebram ligações únicas através da adição de água. Algumas hidrolases funcionam como enzimas digestivas porque quebram as ligações do peptídeo nas proteínas. As hidrolases também podem ser um tipo de transferases, uma vez que transferem a molécula da água de um composto para outro. Exemplo: Glucose-6-fosfátase que remove o grupo fosfato do glucose-6-fosfato, deixando glicose e H3PO4.
- Lyases: Estas enzimas catalisam reações onde grupos funcionais são adicionados para quebrar ligações duplas em moléculas ou onde ligações duplas são formadas pela remoção de grupos funcionais. Exemplo: A descarboxilase piruvada é uma lisase que remove o CO2 da piruvada. Outros exemplos incluem deaminases e desidratases.
- Isomerases: Estas enzimas catalisam as reacções em que um grupo funcional é movido para outra posição dentro da mesma molécula de tal forma que a molécula resultante é de facto um isómero da molécula anterior. Exemplo: triosefosfato isomerase e fosfoglucose isomerase para conversão de glucose 6-fosfato em frutose 6-fosfato.
- Ligases: Estas enzimas desempenham uma função oposta à das hidrolases. Quando os hidrolases rompem as ligações pela adição de água, as ligas formam ligações pela remoção do componente água. Existem diferentes subclasses de ligas que envolvem a síntese de ATP.
Como funcionam as enzimas?
Para que qualquer reacção ocorra no universo, existe uma necessidade de energia. Nos casos em que não há energia de ativação fornecida, um catalisador desempenha um papel importante para reduzir a energia de ativação e levar a reação adiante. Isto funciona também em animais e plantas. Enzimas ajudam a reduzir a energia de ativação das moléculas complexas na reação. Os passos seguintes simplificam como uma enzima funciona para acelerar uma reacção:
Passo 1: Cada enzima tem um ‘local activo’, que é onde uma das moléculas do substrato se pode ligar. Assim, um complexo enzimático- substrato é formado.
Passo 2: Esta molécula enzimática-substrato agora reage com o segundo substrato para formar o produto e a enzima é liberada como o segundo produto.
Existem muitas teorias que explicam como as enzimas funcionam. Mas, há duas teorias importantes que discutiremos aqui.
Teoria 1: Hipótese de Bloqueio e Chave
Esta é a mais aceita das teorias de ação enzimática.
>
Esta teoria afirma que o substrato se encaixa exatamente no local ativo da enzima para formar um complexo enzimático-substrato. Este modelo também descreve porque as enzimas são tão específicas em sua ação porque são específicas para as moléculas do substrato.
>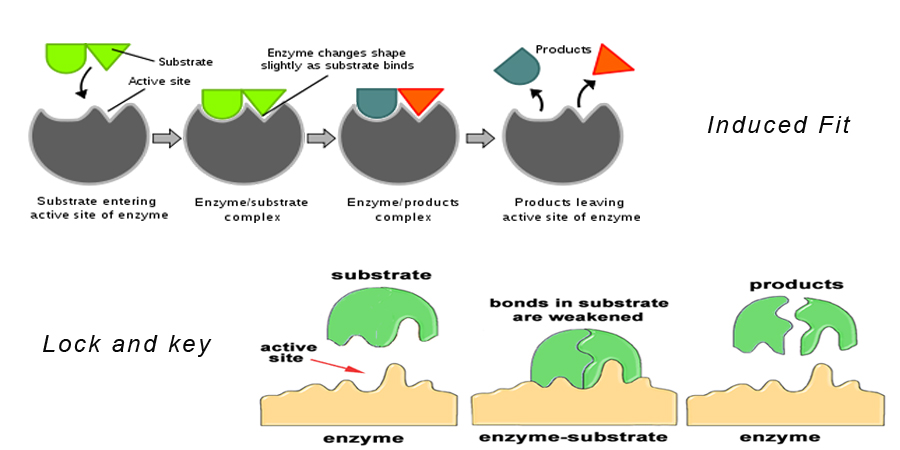
Teoria 2: Hipótese de Ajuste Induzido
Esta é semelhante à hipótese de fechadura e chave. Ela diz que a forma da molécula enzimática muda à medida que ela se aproxima da molécula do substrato de tal forma que a molécula do substrato se encaixa exatamente no local ativo da enzima.
Que fatores afetam a atividade enzimática na célula?
- Concentração de Enzimas e Substratos: A taxa de reação aumenta com o aumento da concentração do substrato até um ponto, a partir do qual qualquer aumento adicional na concentração do substrato não produz nenhuma alteração significativa na taxa de reação. Isto ocorre porque após uma certa concentração do substrato, todos os locais ativos na enzima estão cheios e nenhuma outra reação pode ocorrer.
- Temperatura: Com o aumento da temperatura, a atividade enzimática aumenta devido ao aumento da energia cinética das moléculas. Existe um nível óptimo quando as enzimas funcionam no melhor e no máximo. Esta temperatura é frequentemente a temperatura corporal normal do corpo. Quando a temperatura aumenta além de um certo limite, as enzimas, que na realidade são constituídas por proteínas, começam a desintegrar-se e a taxa de reacção abranda.
- pH: As enzimas são muito sensíveis a mudanças no pH e funcionam numa janela muito pequena de níveis de pH admissíveis. Abaixo ou acima do nível ótimo de pH, há um risco de desintegração das enzimas e assim a reação abranda.
- Inibidores: Presença de certas substâncias que inibem a acção de uma determinada enzima. Isto ocorre quando a substância inibidora se liga ao local ativo da enzima, impedindo assim a ligação do substrato e retardando o processo.
Exemplo resolvido para você
Q: Uma enzima age por?
a. Aumentando a energia de ativação
b. Diminuindo a energia de ativação
c. Diminuindo o pH
d. Aumentando o pH
Sol: a. Aumentando a energia de ativação
Os reagentes não sofrem alteração química automaticamente. Eles o fazem no estado de transição. O estado de transição tem mais energia livre do que os reagentes ou produtos. A incapacidade dos reagentes de sofrerem mudança devido à necessidade de energia extra para convertê-los em estado de transição é chamada de ‘Barreira de Energia’. A energia necessária para superar a barreira energética é chamada de ‘Energia de Ativação’.