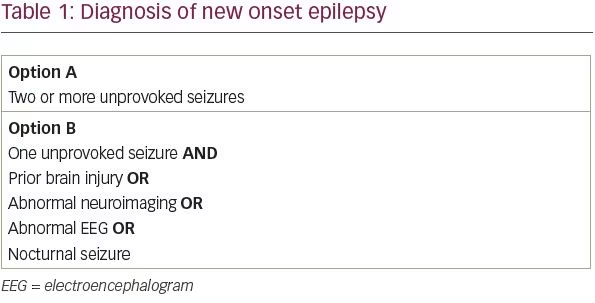
A Liga Internacional Contra a Epilepsia (ILAE) revisou sua definição de epilepsia em 2014 a fim de maximizar a identificação precoce e o tratamento de pacientes com epilepsia.1 A definição conceitual de epilepsia da ILAE, formulada pela primeira vez em 2005, é “uma desordem do cérebro caracterizada por uma predisposição duradoura para gerar convulsões epiléticas”. Na prática, esta definição correspondeu a pacientes com duas ou mais convulsões não provocadas com mais de 24 horas de intervalo. Sabemos, entretanto, que nem todos os pacientes com uma única crise não provocada têm a mesma probabilidade de ter uma segunda crise. Sob a nova definição de ILAE, pacientes com uma única convulsão não provocada e uma probabilidade de convulsão recorrente acima de 60% agora atendem aos critérios para o diagnóstico de epilepsia.
Em uma revisão sistemática de estudos avaliando o risco de recorrência de convulsões após uma única convulsão não provocada, entre 21 e 45% dos pacientes tiveram outra convulsão não provocada nos primeiros 2 anos.2 Do ponto de vista prático, foram identificados quatro fatores de risco que aproximadamente dobram o risco de recorrência de convulsões de um paciente: uma lesão cerebral anterior, um achado neuroimagroso anormal que corresponde à suspeita de foco de convulsão, descargas de epileptiformes focais ou generalizadas no eletroencefalograma (EEG), ou uma convulsão noturna.3-6 Assim, pacientes com uma única convulsão não provocada e pelo menos um desses quatro fatores de risco provavelmente tem uma chance maior que 60% de convulsão recorrente e pode ser diagnosticado com epilepsia (Tabela 1).
Embora um grande estudo precoce tenha sugerido que um exame neurológico anormal estava associado a um risco aumentado de recorrência de convulsões, um estudo de acompanhamento do mesmo grupo não encontrou aumento no risco.3,7 O mesmo estudo de acompanhamento descobriu que ter um irmão com epilepsia aumenta o risco de recidiva entre pacientes com epilepsia idiopática, mas mesmo entre esses pacientes, o risco de recidiva é de apenas 46% aos 5 anos. Assim, os achados do exame neurológico e a história familiar de epilepsia devem ser levados em consideração ao avaliar um paciente com uma primeira convulsão, mas essas características sozinhas não são suficientes para se fazer um diagnóstico de epilepsia.
Consideração do tratamento com fármacos antiepilépticos em novos casos de epilepsia inicial
Estudos mais precoces de recorrência de convulsões após uma convulsão inicial não provocada incluíram tanto pacientes tratados com fármacos antiepilépticos (DEA) como não tratados, dificultando a estimativa do verdadeiro risco de convulsões recorrentes. O PRIMEIRO estudo constatou que 51% dos pacientes que não iniciaram um DEA após uma primeira convulsão tiveram outra dentro de 2 anos, enquanto apenas 25% dos que iniciaram um DEA tiveram outra convulsão dentro do mesmo período.8 Entretanto, estudos posteriores mostraram que, embora o tratamento com DEA reduza o risco de recorrência de convulsões dentro dos primeiros 2 anos após uma convulsão inicial, ele não afeta a probabilidade de remissão de convulsões a longo prazo ou a qualidade de vida.9,10 Como não é garantido que o tratamento precoce do DEA mude o resultado geral de um paciente, e os DEA não são medicamentos totalmente benignos, nem todos os pacientes que são diagnosticados com epilepsia escolhem iniciar o tratamento imediatamente.
>
Todas as decisões sobre o tratamento do DEA devem ser tomadas em colaboração com o paciente após uma discussão cuidadosa dos riscos e benefícios, ponderando o risco de danos devido a convulsões contra os potenciais efeitos adversos dos DEA. A presença de um tipo de convulsão associada a um risco maior de lesão ou morte, como convulsões tônico-clônicas ou estado epiléptico, pode ser um fator que influencia a decisão do paciente e do médico de iniciar um DEA.11-13
Caracterização do tipo de epilepsia
Determinação do tipo de epilepsia do paciente – de foco ou generalizada – no momento do diagnóstico inicial é importante porque ajuda a prever o prognóstico e orientar a seleção de um DEA apropriado. Essa determinação é normalmente feita com base na semiologia das convulsões, juntamente com os achados da ressonância magnética (RM) e do EEG. Sintomas motores ou sensoriais lateralizados, desvio ocular forçado ou rotação da cabeça, automatismos, distúrbios da linguagem e fenômenos experienciais sugerem um início focal, enquanto o jerking mioclônico bilateral ou a atividade tônica bilateral inicial sugerem um início generalizado.
No entanto, a semiologia sozinha pode ser enganosa: as crises focais podem não ter características de lateralização no início, e mais da metade dos pacientes com epilepsia generalizada tem sintomas de crises focais.14 Além disso, três quartos dos pacientes com epilepsia focal são amnésicos para pelo menos algumas de suas crises, e 30% são amnésicos para todas as crises.15 Além disso, até 60% dos pacientes não têm aura antes das crises.16 Esses fatores tornam o diagnóstico e a caracterização da epilepsia um desafio em muitos pacientes.
A maioria dos pacientes com uma primeira crise deve fazer uma RM, a menos que haja contra-indicação. A RM tem um rendimento maior que a tomografia computadorizada (TC) para detecção de lesões epilépticas focais.17-19 A presença de uma lesão focal pode confirmar um início focal se a localização da lesão corresponde à semiologia do paciente. Para pacientes com síndrome de epilepsia generalizada primária eletroclínica clara, como epilepsia mioclônica juvenil, a neuroimagem pode não ser necessária.
Se uma RM for obtida, as seqüências recomendadas incluem uma seqüência 3D T1 com cortes isotrópicos de 1 mm (por exemplo eco de gradiente rápido preparado por magnetização ), sequências axiais e coronais T2 e FLAIR com cortes de ≤3 mm, e uma sequência axial T2* para hemossiderina e calcificação (por exemplo, imagens de susceptibilidade ou eco de gradiente).20 O contraste não é necessário para todos os pacientes, mas deve ser considerado para pacientes acima de 50 anos de idade, devido à maior probabilidade de tumor cerebral metastático ou primário nesta faixa etária. Quando possível, 3 Tesla MRI é preferível a 1,5 Tesla por ser mais sensível a lesões epilépticas.21,22 Recentemente, 7 tomógrafos de Tesla MRI aumentaram ainda mais a sensibilidade, mas estes normalmente só estão disponíveis através de protocolos de pesquisa.23
EEG é a outra modalidade essencial para o diagnóstico e caracterização de novas epilepsia de início. Um único EEG de rotina pode ser insuficiente para a detecção de anormalidades epilépticas; uma meta-análise recente de 15 estudos constatou que a sensibilidade de um EEG de rotina era de 17%.24 Para aumentar esse rendimento, os médicos devem considerar a realização de um EEG prolongado de 60 minutos, um EEG com privação de sono ou até três EEGs de rotina em série.25-27 Os registros de EEG ambulatoriais também aumentam a probabilidade de detecção de anormalidades epilépticas; os benefícios do registro prolongado diminuem após 48 horas, pois 95% das anormalidades são detectadas dentro desse período de tempo.28 Um estudo de EEG em vídeo internado pode ser considerado em cenários específicos, como diferenciar as crises epiléticas de ataques psicogênicos não-epiléticos.29
Selecionando uma epilepsia de foco antiepiléptico
O ensaio SANAD – tratamento de primeira linha da nova epilepsia focal de início
O objetivo do tratamento do DEA na nova epilepsia de início é controlar as crises com um único DEA enquanto minimiza os efeitos adversos. Embora haja muitos medicamentos disponíveis para o tratamento da epilepsia focal, há poucos estudos controlados comparando sua eficácia e tolerabilidade. O estudo SANAD, publicado em 2007, foi um estudo seminal de 1.721 pacientes com epilepsia focal randomizados para tratamento com carbamazepina, gabapentina, lamotrigina, oxcarbazepina ou topiramato.30 O desfecho primário foi o tempo para o insucesso do tratamento, definido como descontinuação da droga devido a convulsões não controladas ou efeitos adversos. A lamotrigina foi significativamente melhor que a carbamazepina, gabapentina e topiramato, e não significativamente melhor que a oxcarbazepina. Por tempo até a remissão de 12 meses, entretanto, a carbamazepina foi significativamente melhor que a gabapentina e não significativamente melhor que a lamotrigina, o topiramato e a oxcarbazepina.30
Os resultados do ensaio SANAD sugerem que a lamotrigina é o melhor tratamento de primeira linha para epilepsia focal devido à sua combinação de eficácia e tolerabilidade, com a carbamazepina como uma alternativa razoável em pacientes que são capazes de tolerá-la.
Novos medicamentos antiepiléticos para o tratamento de primeira linha da epilepsia focal
Desde a publicação do ensaio SANAD, vários novos medicamentos para epilepsia focal entraram no mercado. Enquanto todos esses medicamentos foram inicialmente estudados como tratamentos adjuvantes, muitos são agora usados como monoterapia, e alguns, particularmente o levetiracetam, são agora comumente usados como tratamento de primeira linha. Uma grande vantagem desses novos medicamentos é que as doses podem ser aumentadas rapidamente em pacientes com convulsões frequentes, sem o risco de síndrome de Stevens-Johnson, um efeito adverso conhecido da lamotrigina e, em menor extensão, da carbamazepina.
entre os novos DEA, quatro-levetiracetam, zonisamida, lacosamida e eslicarbazepina foram comparados com DEAs mais antigos em ensaios controlados aleatórios, como mostra a Tabela 2.31-41 Os ensaios foram identificados usando o filtro de ensaios clínicos do PubMed e os termos de pesquisa “monoterapia” e “”, e foram incluídos se estudassem pacientes adultos com epilepsia focal comparando um DEA mais recente com um dos DEA padrão (aqueles incluídos no ensaio SANAD).
Dos quatro novos DEA, o levetiracetam é o melhor estudado e mais amplamente prescrito; ele se tornou em grande parte o DEA de primeira linha padrão para nova epilepsia de início devido à sua facilidade de titulação e perfil favorável de efeitos colaterais. Levetiracetam é agora o DEA de primeira linha mais prescrito em adultos idosos, respondendo por 45,5% das prescrições.42 Estudos demonstraram que o levetiracetam tem eficácia semelhante ao DEA de idosos, embora tenha sido inferior à carbamazepina em uma análise de subgrupo de um estudo (Tabela 2).
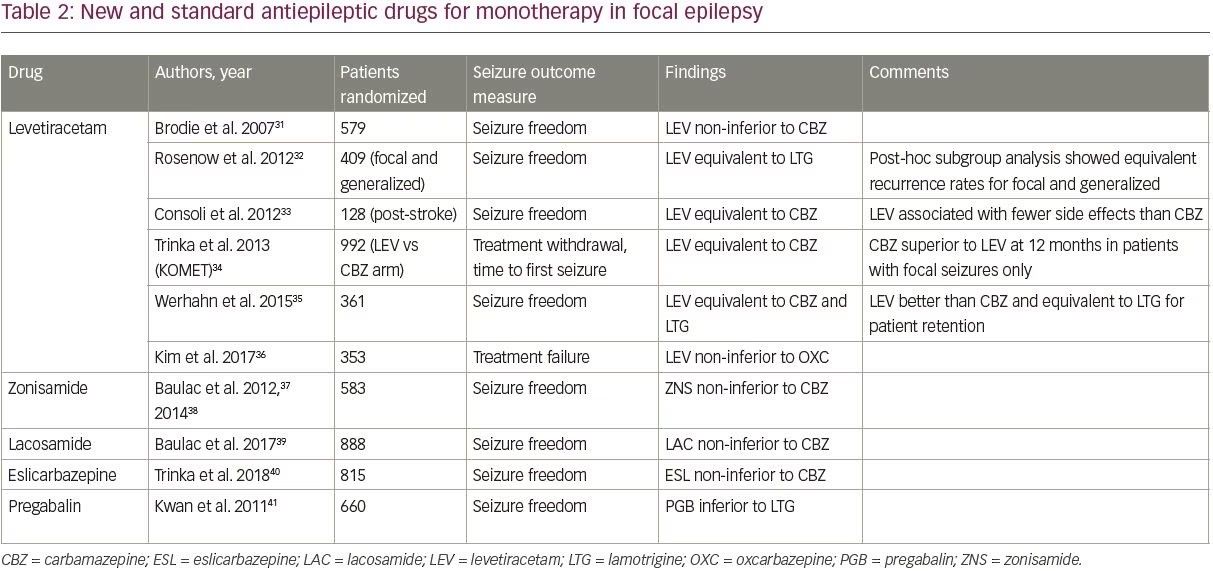
Importante, apenas dois estudos compararam o levetiracetam à lamotrigina; ambos os estudos encontraram eficácia semelhante para os dois medicamentos.32,35 O braço epiléptico focal do ensaio SANAD II, que será o maior estudo para comparar a eficácia a longo prazo e a tolerabilidade do levetiracetam e da lamotrigina, está actualmente em curso (ISRCTN30294119).
Fora do levetiracetam, os dados de alta qualidade que avaliam os novos DEA, uma vez que a monoterapia é limitada. Zonisamida, lacosamida e eslicarbazepina demonstraram ser não-inferiores à carbamazepina em um único estudo cada (Tabela 2); a zonisamida também está sendo estudada no braço focal do ensaio SANAD II. Estes três agentes podem ser considerados como opções de tratamento de primeira linha, dependendo das comorbidades e contra-indicações do paciente. A pregabalina também foi estudada em comparação com a lamotrigina e foi inferior41 e, portanto, não é recomendada como
tratamento de primeira linha.
Brivaracetam foi bem tolerada em dois estudos randomizados de conversão de politerapia para monoterapia, mas o número de pacientes que permaneceram em brivaracetam no final desses estudos foi muito baixo para determinar sua eficácia como monoterapia;43 também não foi estudada em comparação direta com DEAs mais antigos. Portanto, não há evidências suficientes para recomendar a monoterapia com brivaracetam como tratamento de primeira linha neste momento.
Clobazam, perampanel e cenobamato são novos DEA com potencial para uso como monoterapia. Tanto clobazam quanto perampanel foram eficazes e bem tolerados em pequenos estudos retrospectivos que incluíram pacientes com epilepsia focal e generalizada.44,45 Clobazam também foi superior à carbamazepina e à fenitoína em um estudo randomizado de pacientes pediátricos, mas não foi diretamente comparado aos DEA mais antigos em uma população adulta.46 O cenobamato, um potenciador da inativação rápida e lenta do canal de sódio com dosagem única diária, demonstrou recentemente eficácia como agente adjuvante em pacientes com epilepsia focal, mas ainda não foi estudado como monoterapia.47
Sumário de tratamento de primeira linha para epilepsia focal
Levetiracetam tem realizado tão bem quanto, ou ligeiramente pior que, DEAs mais antigos em ensaios cabeça a cabeça,31-36 e é um tratamento de primeira linha razoável em pacientes sem histórico de problemas psiquiátricos, particularmente se as convulsões são freqüentes ou se os pacientes têm dificuldade com o cronograma de titulação da lamotrigina. Em pacientes com comorbidades psiquiátricas, recomendamos a lamotrigina como tratamento de primeira linha. O ensaio SANAD II pendente irá responder mais definitivamente à questão de qual destes dois DEA é superior, tanto em termos de eficácia como de tolerabilidade. Dependendo das comorbidades do paciente e da tolerância aos efeitos colaterais, vários dos DEA mais antigos (carbamazepina, oxcarbazepina, topiramato) e os mais recentes (zonisamida, lacosamida, eslicarbazepina) podem ser alternativas razoáveis. Brivaracetam, clobazam, perampanel, e cenobamato podem ser opções viáveis no futuro, mas não há evidências suficientes neste momento. Gabapentina e pré-gabalina não devem ser usadas como tratamentos de primeira linha.
Selecionar um medicamento antiepiléptico – epilepsia generalizada ou não classificada
O ensaio SANAD – tratamento de primeira linha de novo início de epilepsia generalizada
O ensaio SANAD 2007 incluiu um segundo braço, que estudou pacientes com epilepsia generalizada ou epilepsia que não puderam ser classificados definitivamente no momento do início do tratamento.48 O valproato foi significativamente melhor que o topiramato no tempo de falha do tratamento na análise geral, e significativamente melhor que tanto o topiramato quanto a lamotrigina em pacientes com diagnóstico confirmado de epilepsia generalizada. Para o tempo até a remissão de 12 meses, o valproato foi significativamente melhor do que a lamotrigina em ambos os grupos, mas não significativamente diferente do topiramato em ambos os grupos. Assim, o valproato parece ter a melhor combinação de eficácia e tolerabilidade dos três medicamentos estudados.
Apesar do sucesso do valproato na SANAD, o seu uso fora do ambiente do estudo é problemático devido aos seus efeitos adversos. Entre as mulheres em idade fértil, o valproato está contra-indicado devido à teratogenicidade, pois aumenta significativamente o risco de malformações congênitas e déficits neurocognitivos a longo prazo.49-52 A partir de 2018, a União Européia proibiu o uso de valproato em mulheres em idade fértil, a menos que elas estejam inscritas em um programa de prevenção da gravidez.53 O valproato também tem vários outros efeitos colaterais indesejáveis, incluindo ganho de peso, queda de cabelo, síndrome dos ovários policísticos e encefalopatia hepática.54-57 São necessários tratamentos alternativos de primeira linha, especialmente para mulheres em idade fértil.
Novas alternativas ao valproato para o tratamento da epilepsia generalizada
Levetiracetam é o novo DEA mais amplamente estudado para epilepsia generalizada. Dois dos ensaios de monoterapia descritos acima também incluíram pacientes com epilepsia generalizada.32,34 No estudo KOMET, o levetiracetam foi equivalente ao valproato tanto para a taxa de retirada do tratamento quanto para o tempo até a primeira convulsão.34 Levetiracetam também demonstrou ser equivalente à lamotrigina para a taxa de liberdade de convulsões em uma amostra heterogênea; a análise pós-hoc de subgrupos mostrou que isso era verdade tanto para a epilepsia focal quanto para a generalizada.32
Recentemente, Marson e colegas apresentaram os resultados do braço de epilepsia generalizada do ensaio SANAD II.58 O valproato foi superior ao levetiracetam para tempo de falha no tratamento, tempo para a primeira convulsão e tempo para a remissão de 24 meses. Curiosamente, a diferença no tempo para o fracasso do tratamento foi atribuível ao controle inadequado das crises, e não aos efeitos adversos, o que sugere que o valproato não foi mais mal tolerado do que o levetiracetam nesta amostra.
Como observado acima, tanto o clobazam quanto o perampanel mostraram boa eficácia e tolerabilidade em estudos observacionais retrospectivos que incluíram pacientes com epilepsia generalizada, mas nenhuma das drogas foi comparada com qualquer uma das drogas mais antigas em um estudo randomizado.44,45 Para nosso conhecimento, nenhum dos outros novos DEA foi estudado como monoterapia em pacientes com epilepsia generalizada.
Sumário de tratamento de primeira linha para epilepsia generalizada e não classificada
Embora os resultados do SANAD II sugiram que o valproato continua sendo o DEA mais eficaz para epilepsia generalizada ou não classificada, não o recomendamos como tratamento de primeira linha devido aos seus efeitos adversos. A lamotrigina é uma boa escolha se a frequência das convulsões for suficientemente baixa para permitir um aumento lento da dose. Se for necessário um início rápido, o levetiracetam pode ser usado. Se as convulsões são refratárias a esses dois agentes, o valproato pode ser usado após discussão cuidadosa dos riscos e benefícios.
Aconselhando pacientes com nova epilepsia de início
Patientes com novo diagnóstico de epilepsia tipicamente têm muitas perguntas sobre a doença e seu impacto em suas vidas. As perguntas mais frequentes são sobre o prognóstico a longo prazo da epilepsia, se deve iniciar o tratamento de DEA e se o tratamento de DEA será vitalício. Como discutido acima, os pacientes devem ser informados de que o tratamento imediato do DEA reduz o risco de recorrência de convulsões precoces, mas não altera o prognóstico geral da epilepsia, e a decisão sobre se iniciar um DEA deve ser tomada de forma individualizada. Os pacientes devem ser informados de que cerca da metade dos pacientes alcançará o controle das convulsões com seu primeiro DEA, enquanto 20% adicionais responderão a um segundo ou terceiro medicamento.59 Além disso, eles devem estar cientes de que quaisquer tentativas de interromper o tratamento do DEA só devem ser iniciadas após pelo menos 2 anos de liberdade de convulsões, e que quase metade dos pacientes terá uma recorrência de convulsões após a retirada do DEA.60
Fora do controle das convulsões, as questões práticas mais comuns dizem respeito à condução. Qualquer convulsão com perda de consciência, tónico-clónica ou inconsciência focal, pode causar danos significativos se ocorrer enquanto o paciente conduz. A maioria dos estados requer um intervalo de liberdade de convulsões antes que um paciente possa retomar a condução. Os médicos devem garantir que os pacientes estejam familiarizados com as leis do seu estado. Alguns estados exigem que os médicos informem seus pacientes com epilepsia ou convulsões ao Departamento de Veículos Automotores, enquanto outros não.61 É importante notar que em estados sem notificação obrigatória, os médicos podem não ter proteção legal ao revelar um diagnóstico de epilepsia sem o consentimento do paciente. Nesses casos, os médicos precisarão pesar os riscos de o paciente continuar dirigindo (particularmente no caso de motoristas comerciais) contra os riscos de ramificações legais de violar a confidencialidade do paciente. Todas as conversas sobre direção devem ser documentadas no prontuário médico da paciente.
As mulheres em idade fértil devem também ser aconselhadas sobre as implicações da epilepsia e dos DEA na gravidez. As pacientes devem estar cientes de que convulsões, especialmente convulsões tônico-clônicas generalizadas, e alguns DEAs, podem ter efeitos adversos sobre um feto em desenvolvimento. Em mulheres que não estão planejando a gravidez, a contracepção de longa duração com um dispositivo intra-uterino ou injeção em depósito é preferida, pois minimiza as oportunidades de erro do usuário. As pacientes também devem saber que o tratamento com DEAs indutores de enzimas pode diminuir a eficácia da contracepção hormonal.62 Todas as mulheres com epilepsia que estão planejando uma gravidez devem informar seu neurologista com antecedência; se uma gravidez não estiver planejada, o neurologista deve ser informado o mais rápido possível. Além disso, todas as mulheres com epilepsia em idade fértil devem tomar ácido fólico independentemente de uma gravidez estar ou não planejada, pois isso reduz o risco de defeitos do tubo neural que se desenvolvem no início do primeiro trimestre, geralmente antes de uma gravidez ser conhecida.63
O tópico mais difícil de discutir com pacientes recém-diagnosticadas é a morte súbita inesperada em epilepsia (SUDEP). Fatores de risco para SUDEP incluem alta freqüência de convulsões, idade precoce de início, longa duração da doença, convulsões tônico-clônicas generalizadas, convulsões noturnas, viver sozinho, sexo masculino, dependência do álcool e abuso de substâncias.64-66 A maioria dos neurologistas acredita que todos os pacientes com epilepsia devem ser informados sobre SUDEP, enquanto alguns argumentam que o aconselhamento SUDEP só é necessário para pacientes que estão em alto risco.67 Nós recomendamos discutir o SUDEP com todos os pacientes com epilepsia de início novo como parte de uma discussão inicial sobre a importância da adesão à medicação, com aconselhamento mais frequente e extensivo para pacientes de alto risco.