Conteúdo
- 1 Função
- 2 Desidrogenase Láctica Humana
- 2.1 Estrutura
- 2.2 Catálise
- 2.3 Cinética
- 2.4 Regulação
- 3 Estruturas 3D de desidrogenase láctica
Função
L-lactato desidrogenase (L-LDH) catalisa a interconversão do piruvato e NADH+ para L-lactato e NAD+.
H-lactato desidrogenase (H-LDH) catalisa a interconversão do D-lactato e ferricitocromo c para o piruvato e ferrocitocromo c.
Lactato desidrogenase (LDH) é uma enzima importante em humanos. Ocorre em diferentes regiões do corpo, tendo cada região uma conformação única de diferentes subunidades. LDH é uma enzima-chave na respiração anaeróbica. A Respiração anaeróbica é o oxigénio na ausência. Esta via é importante para a glicólise de duas formas principais. A primeira é que se os piruetas construíssem a glicólise e assim a geração de ATP seria lenta. A segunda é a respiração anaeróbica, que permite a regeneração do NAD+ a partir do NADH. O NAD+ é necessário quando a gliceraldeído-3-fosfato desidrogenase oxida o gliceraldeído-3-fosfato na glicólise, que gera o NADH. A desidrogenase láctica é responsável pela conversão anaeróbica de NADH para NAD+. na desidrogenase láctica de Cryptosporidium parvum (4nd4).
Desidrogenase Láctica Humana
Estrutura
é uma proteína quaternária formada pela combinação de duas subunidades, M e H (Músculo e Coração) em uma estrutura de quatro das subunidades. As várias combinações encontradas no corpo humano são:
- (4H) Coração
- (3H1M) Reticuloendotelial
- (2H2M) Pulmões
- (1H3M) Rins
- (4M) Músculo e Fígado
O do LDH como aqui mostrado é composto por 40% de hélices alfa e 23% de folhas beta. Os dados SCOP classificam esta forma de desidrogenase láctica como beta-alfa-beta mista, com folhas beta principalmente paralelas.
Ver também
- Desidrogenase Láctica Humana
- Jasper Lactate Final
- Dobra Rossmann.
Catálise
Estudos mostraram que o mecanismo de reacção do LDH segue uma sequência ordenada.
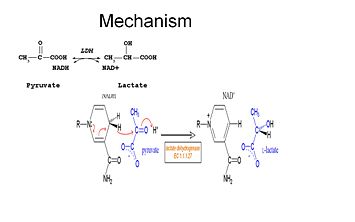
Para que o Lactato seja oxidado o NADH deve ligar-se primeiro à enzima seguida do Lactato. . Uma vez que o NADH está ligado à enzima, é então possível que o lactato se ligue (o oxamato de substrato é mostrado; o grupo -CH3 é substituído por -NH2 para formar o oxamato). O lactato liga-se à enzima entre o anel de nicotinamida e vários resíduos de LDH. A transferência de um íon hidreto acontece rapidamente em qualquer direção dando uma mistura dos dois complexos terciários, enzima NAD+-lactato e enzima NADH-piruvato.
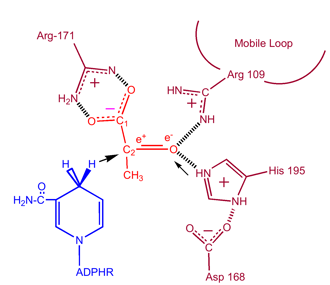
Cinética
Estudos cinéticos de desidrogenase láctica com oxalato e oxamato (análogos estruturais de lactato e piruvato) provaram o mecanismo acima descrito. A etapa limitante da taxa nesta reação é a taxa de dissociação de NAD+ e NADH. A conversão do piruvato em lactato com a regeneração subsequente do NAD+ é muito favorável.

Regulação
Como o mecanismo é de equilíbrio, parece não haver regulação especificamente desenhada para a desidrogenase láctica, em vez disso ela depende da ativação da reparação anaeróbica e da presença de piruvato e NADH, ou lactato e NAD+.
Estruturas 3D de desidrogenase láctica
Estruturas 3D de desidrogenase láctica