Como a vida começou na Terra? Num planeta jovem e rochoso, como é que os químicos se juntaram da maneira certa para formar as primeiras células? Como é que essas células primitivas começaram a comportar-se como a vida: crescendo, dividindo-se e passando traços vantajosos para a geração seguinte?
As origens da vida são especialmente obscuras porque o registo geológico – as camadas de rochas e fósseis incrustados que contêm pistas sobre a história da Terra e da vida – desaparece há cerca de 3,9 mil milhões de anos, apagado por movimentos na crosta do planeta. Como resultado, cientistas faltam evidência direta para condições na Terra cedo, incluindo prova das moléculas que poderiam ter girado em lagoas primordiais e formaram os blocos de construção de vida.
Isto apresenta uma série de perguntas, precisamente o tipo de perguntas grandes para qual Jack Szostak é atraído. Ele e outros acreditam que podem reconstruir no laboratório o longo caminho que levou dos químicos no espaço, à formação da Terra, à química pré-vida no planeta, às protocélulas precoces, e finalmente às células avançadas com metabolismo e síntese de proteínas. Explorações em expansão como estas requerem experiência em muitos campos, incluindo química e bioquímica, geologia e geofísica, e astronomia.
Szostak (pronuncia-se shah-stak) pode ser a pessoa ideal para buscar respostas. Um ganhador do Prêmio Nobel, professor de genética na Harvard Medical School, professor de química e biologia química na Faculdade de Artes e Ciências, o Rich Distinguished Investigator no Massachusetts General Hospital (MGH), e um investigador do Howard Hughes Medical Institute, ele é descrito por outros como um cientista brilhante e motivado. Mas ele também é conhecido pela humildade moderada, incluindo a vontade de mergulhar profundamente em assuntos que são novos para ele, e pela sua colegialidade, por ajudar a fomentar o compartilhamento de idéias que está fazendo a ciência avançar.
A sua própria pesquisa se concentra em um segmento do caminho para a vida: a protocélula, “uma célula primordial realmente, realmente simples que poderia se reunir a partir de produtos químicos que estavam por perto, na superfície da Terra”, explica Szostak. Ele espera entender como ela cresceria e se dividiria e começaria a se replicar, e eventualmente evoluir. “Podemos não saber o que realmente aconteceu, mas talvez possamos traçar diferentes caminhos possíveis”, diz ele. “Tudo que podemos fazer é tentar montar no laboratório coisas que parecem plausíveis”
“Evolução Direcionada”
Este agosto marcou o quadragésimo ano de Szostak em Harvard e o trigésimo quinto em MGH (onde está localizado o seu laboratório), um período marcado por descobertas importantes em uma surpreendente variedade de campos. Nos anos 80, seu laboratório realizou experimentos com leveduras para entender a genética e a bioquímica da recombinação de DNA – trabalho que levou ao modelo de reparo de quebra dupla de DNA, que descreve como os fios longos de DNA quebram, trocam segmentos, e depois se juntam novamente. Isto levou a pesquisas subsequentes sobre o mecanismo de recombinação durante a meiose, a divisão celular que leva ao esperma e aos óvulos.
Durante o mesmo período, sua equipe também fez importantes descobertas sobre os telômeros – as tampas protetoras, encontradas nas extremidades dos cromossomos, que garantem que o DNA se replica corretamente à medida que as células se dividem. Por esta pesquisa, Szostak recebeu mais tarde o Prêmio Nobel de Fisiologia ou Medicina de 2009, que ele compartilhou com os pesquisadores Elizabeth Blackburn, Sc.D. ’06, agora emerita na UC, São Francisco, e Carol Greider de Johns Hopkins.
Quando Szostak recebeu o telefonema de manhã cedo da Suécia, em outubro de 2009, ele já tinha passado mais de 20 anos fazendo contribuições fundamentais em outras áreas da ciência. Após as descobertas dos telômeros em meados dos anos 80 (a pesquisa vinculou os telômeros reduzidos a muitas doenças do envelhecimento), muitos cientistas entraram no campo e Szostak optou por mudar de direção. “Era bastante claro quais seriam as próximas experiências, e parecia que qualquer coisa que fizéssemos seria feita de qualquer maneira”, lembrou ele. “Eu nunca senti que há muito sentido em fazer coisas que vão ser feitas de qualquer maneira”. Então isso realmente me fez olhar em volta e pensar sobre que outros tipos de questões científicas eu poderia começar a abordar”. Em 1984 ele aceitou uma oferta para mudar seu laboratório do que era então o Sidney Farber Cancer Institute para a MGH, para se juntar aos pesquisadores de lá que trabalhavam em ciência básica. “Foi uma oferta incrível: toda a minha pesquisa seria totalmente financiada durante 10 anos”, recorda Szostak. “Foi perfeito para mim, pois me permitiu mudar de direção sem me preocupar em escrever bolsas em uma nova área”
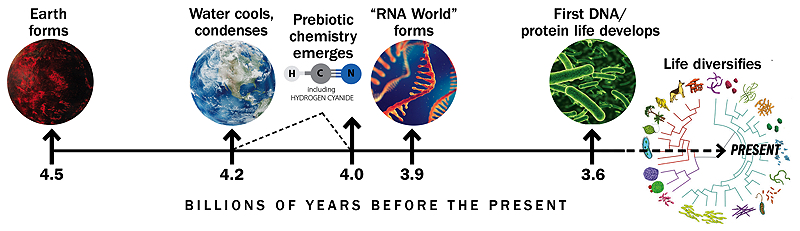
Linha de tempo baseada em gráfico semelhante de Gerald Joyce
Após considerar suas opções, ele se estabeleceu nas enzimas de RNA conhecidas como ribozimas, uma área que ele via como “interessante, traçável e não altamente competitiva”. Ele e seus alunos de pós-graduação começaram a desenvolver ferramentas para evoluir o RNA, as moléculas de cadeia única em células que copiam informações genéticas contidas no DNA. Em tubos de ensaio, a sua equipa empurrou o RNA para assumir novos papéis, tais como o reconhecimento de moléculas alvo e reacções catalisadoras. Conhecido como “evolução dirigida”, este processo envolveu a introdução de mutações nas cadeias de RNA, procurando variantes que poderiam desempenhar funções úteis, e permitindo que essas moléculas novas se reproduzissem. Eles também fizeram trabalho similar com DNA, peptídeos e proteínas.
Em 1994, Szostak recebeu o Prêmio da Academia Nacional de Ciências em Biologia Molecular, junto com o pesquisador Gerald Joyce, agora do Instituto Salk para Estudos Biológicos, por desenvolver simultaneamente, mas independentemente, a evolução in vitro do RNA. “É uma tecnologia para fazer moléculas que fazem a sua vontade”, explicou Joyce em uma entrevista, descrevendo-a como semelhante à forma como os cientistas agrícolas criam vacas para produzir mais leite, ou desenvolver culturas que resistem à seca. “Esta é a versão molecular disso”. E é algo que é agora muito praticado”, acrescenta ele (ver “Harnessing Evolution”, janeiro-fevereiro 2017, página 15), uma forma de desenvolver novas moléculas para uma gama de usos, incluindo medicamentos.
Para Szostak, o trabalho sobre evolução dirigida levantou novas questões. “Fiquei cada vez mais interessado em como a evolução começou sozinha no início da Terra”, lembra-se ele. “Uma coisa é impor pressões seletivas e fazer a evolução darwiniana no laboratório, onde se tem enzimas, estudantes e instrumentos”. Mas de alguma forma a evolução darwiniana começou por si só”. Dado que a capacidade de evoluir é uma característica chave da vida, Szostak estava a fazer uma das questões fundamentais da ciência: Como começou a vida?
Originas: “Três Grandes Perguntas Fundamentais”
O canadiano americano Szostak nasceu em Londres, onde o seu pai estudava para uma licenciatura em engenharia aeronáutica. A família acabou voltando ao Canadá, onde moravam em Ottawa e depois em Montreal, e seu pai trabalhava para a Força Aérea Canadense. (O sotaque de Szostak retém pistas de sua herança canadense). Sua mãe trabalhou por muitos anos em funções administrativas para uma empresa química industrial, e Szostak realizou seu primeiro trabalho de verão lá quando adolescente, testando a solidez da cor no laboratório de tinturaria da empresa. “O trabalho era repetitivo e chato, mas me deu minha primeira visão de como é importante testar e re-testar produtos para uso no mundo real”, ele se lembra. Naquela época, ele estava “seriamente interessado” em ciência, matemática e engenharia. Aos 25 anos, doutorou-se em bioquímica na Cornell, e chama seu conselheiro, Ray Wu, um mentor importante: “Ele criou um grande ambiente de laboratório, mas também me mostrou como obter ajuda num projecto quando enfrentava problemas”
Embora Szostak tenha conduzido alguma pesquisa prática e aplicada na sua carreira – uma das empresas que lançou, Ra Pharma, descobriu um medicamento para a doença myasthenia gravis que está prestes a iniciar a fase III de ensaios clínicos – ele é muito apaixonado pela ciência básica.
“Este é um momento emocionante para entrar na neurociência porque os problemas podem ser abordados agora que não se podia sequer pensar há cerca de 30 anos atrás”, oferece, sentado no seu escritório silencioso e quase vazio no Laboratório Mallinckrodt na Oxford Street, em Cambridge. (O escritório é para reuniões ocasionais; Szostak trabalha principalmente em seu laboratório na MGH). Após a origem da vida, a origem da mente é a que mais lhe interessa. Nos anos 80, quando ele estava planejando o que fazer após sua pesquisa telômera, ele contemplou a mudança para o estudo da neurociência e até mesmo participou de seminários de Harvard sobre o tema. “Era fascinante, mas também deprimente, porque a tecnologia era tão primitiva”, recorda. Ele observou com interesse como as ferramentas do campo avançaram desde então. “Este é um momento emocionante para os jovens entrarem na neurociência porque, com toda a nova tecnologia, há problemas que podem ser resolvidos agora que você não conseguia nem pensar há 30 anos”, diz ele. “No entanto, o problema geral ainda é tão grande e um pouco assustador. Do meu ponto de vista, estou a trabalhar no mais fácil destes grandes problemas”. Porque as perguntas sobre as origens da vida são bem adequadas às tecnologias de pesquisa atuais, ele acrescenta, ele acha que é “um problema que pode ser resolvido”
Protocélulas-Modelo e RNA “Confuso”
A equipe da Szostak tem feito protócélulas-modelo desde o início dos anos 2000, procurando descobrir como elas poderiam ter sido montadas e evoluído originalmente. Estas estruturas primitivas eram “extremamente simples” em comparação com a mais simples bactéria unicelular da Terra hoje em dia, explica ele. Protocélulas provavelmente incluíam uma membrana gordurosa mínima e inicialmente apenas um gene que conferia alguma vantagem à célula. As bactérias modernas, em contraste, “têm pelo menos centenas e tipicamente milhares de genes”
Apesar de algumas teorias de que a vida precoce surgiu perto de fontes hidrotermais no oceano profundo, Szostak está mais convencido pela pesquisa mostrando que as primeiras células se desenvolveram em terra em lagos ou poças, possivelmente em regiões vulcanicamente ativas. A luz ultravioleta e os raios poderiam ter ajudado a converter as moléculas na atmosfera em cianeto e outros materiais úteis para gerar os blocos de construção da vida. A água rasa daria a esses materiais um lugar para acumular em altas concentrações, e a atividade vulcânica poderia criar flutuações de temperatura quente e fria úteis para certas reações químicas.
Uma história da Terra e do início da vida
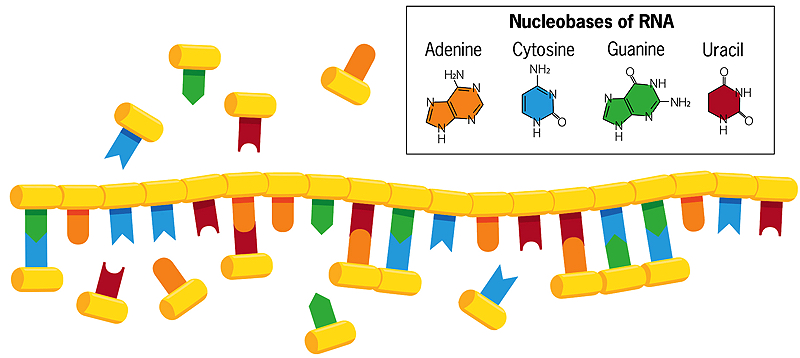
DN não semelhante ao ADN de dupla cadeia, em que as bases citosina e timina com guanina e adenina na cadeia oposta, as bases de uma única cadeia helicoidal de RNA na água podem formar associações com nucleobases flutuantes livres (mostradas na imagem acima). Se estas bases flutuantes livres se fundirem umas com as outras, é criada uma nova cópia espelhada do cordão de RNA, que se rompe com o original quando a água é aquecida. Quando esse novo cordão se repete, ele cria uma cópia espelho de si mesmo que combina com o cordão original de RNA. Às vezes ocorrem erros nesse processo de cópia, e erros benéficos se perpetuam. Cada cadeia, atuando como um modelo para sua própria replicação, assim evolui e interage com seu ambiente.
Alguns cientistas, incluindo Gerald Joyce, sugerem que a vida pode ter começado fora das células, com moléculas flutuantes livres se encontrando e formando laços que lhes permitiriam agir como vida. Mas Szostak argumenta que a membrana celular era necessária, em parte porque manteria moléculas genéticas benéficas juntas e evitaria que os metabólitos úteis feitos por ribozimas geneticamente codificados flutuassem na água ao redor ou fossem apanhados por outras protocélulas passantes.
Experimentos em seu laboratório mostraram como tal membrana poderia crescer e se dividir. Os investigadores combinaram ácidos gordos como o ácido oleico com água e um tampão (para manter o pH da solução estável) e depois agitaram a solução. Quando vistos sob um microscópio, os ingredientes tinham sido montados em vesículas: estruturas circulares, cheias de líquido, com membranas bi-camadas. A adição de ácidos gordos extra ao ambiente – para servir como nutrientes – fez com que as vesículas crescessem filamentos longos e semelhantes aos do cabelo, tão frágeis que até um suave sopro de ar na lâmina do microscópio fez com que se partissem em pedaços. A equipe de Szostak obteve resultados semelhantes com diferentes moléculas formadoras de membrana e em diferentes ambientes, sugerindo que esta é uma maneira plausível para uma membrana protocélica crescer e depois se dividir. Mas como essa estrutura poderia passar material genético benéfico para a próxima geração de células filhas? “É o material genético que realmente parece ser um problema muito mais difícil”, diz ele.
Para compartilhar traços herdados com gerações sucessivas, as células de hoje dependem do DNA – a molécula de dupla hélice composta pelas nucleobases adenina, citosina, guanina e timina – para armazenar e transmitir informações genéticas. Mas a replicação do DNA nas células requer tanto o RNA da molécula de cadeia única quanto as enzimas proteicas, e as proteínas codificadas geneticamente são demasiado complexas para se terem formado espontaneamente no início da Terra. Porque o RNA pode tanto armazenar e transmitir informação genética (como o DNA) e pode catalisar reacções químicas (como as enzimas proteicas), muitos investigadores acreditam que as células primitivas usaram moléculas de RNA para cumprir ambos os papéis genéticos e enzimáticos.
No final dos anos 60, o cientista britânico Leslie Orgel propôs que o RNA, ou algo parecido, poderia ter sido a primeira molécula na Terra a replicar-se e evoluir; isto ficou conhecido como a hipótese do “Mundo do RNA”. Orgel e outros trabalharam durante décadas para entender como as correntes de RNA poderiam ter se unido e se replicado, mas seus esforços não foram totalmente bem-sucedidos. “Houve muito progresso no início, e então ele simplesmente parou porque havia uma dúzia de problemas diferentes e na época não havia uma resposta óbvia para nenhum deles”, explica Szostak. “Praticamente todos ficaram frustrados e pensaram: ‘Talvez a vida não tenha começado com o RNA. Talvez haja algo mais simples, mais fácil de fazer, mais fácil de replicar””
“Sabemos muito mais agora, e só por dividir as coisas em problemas individuais, menores, conseguimos resolver alguns deles””
Pesquisadores procuraram alternativas ao RNA, “e isso levou a 10 a 20 anos de química realmente interessante, chegando a muitas moléculas interessantes”, observa Szostak. “Mas até agora, nada mais simples ou melhor do que o RNA que realmente funciona, surgiu.” Alguns pesquisadores apóiam a hipótese do “metabolismo primeiro”, sugerindo que a vida poderia ter começado sem material genético, através de uma série de reações auto-sustentáveis, mas Szostak e outros continuam não convencidos. Há cerca de sete anos, ele começou a revisitar os obstáculos que a Orgel e seus contemporâneos enfrentaram para entender a síntese do RNA. “Sabemos muito mais agora”, explica ele, “e apenas decompondo as coisas em problemas individuais, menores, temos sido capazes de resolver alguns deles”
O laboratório de Szostak agora se concentra quase inteiramente em como o RNA primordial pode ter se copiado. O RNA moderno vem junto de forma muito regular e previsível, com blocos de construção de nucleotídeos clicando juntos como uma corrente. Cada bloco contém um açúcar (ribose), um fosfato e uma das quatro nucleobases (também chamadas bases nitrogenadas) -adenina, citosina, guanina e uracilo (geralmente chamadas de A, C, G e U). As unidades de fosfato de ribose são unidas para fazer o RNA “espinha dorsal”. Nas células modernas, as enzimas proteicas catalisam a reação que une as unidades nucleotídicas em cadeias de RNA.
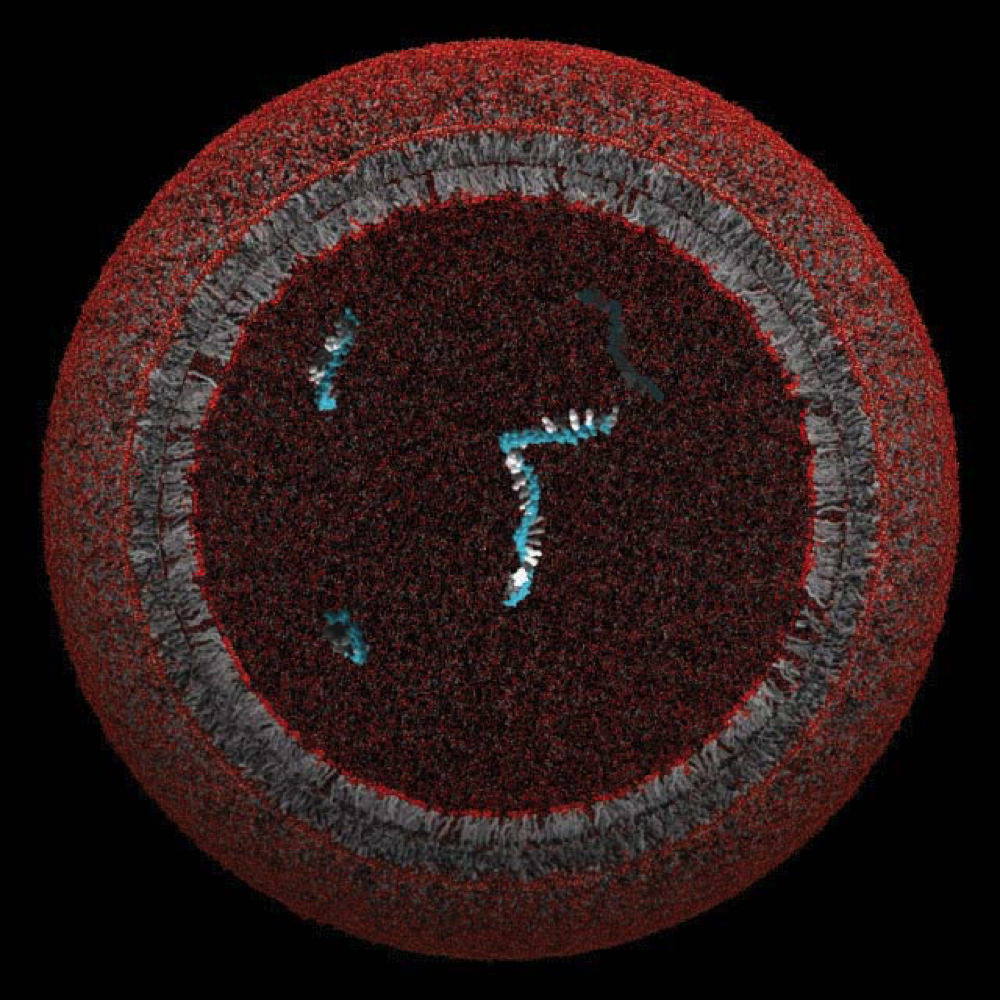
Uma protocélula modelo, cuja membrana lipídica poderia ter fechado e protegido um único gene
Imagem cortesia do Laboratório Szostak
Em protocélulas no início da Terra, a cadeia do RNA teria servido como um modelo no qual uma nova cadeia complementar de nucleotídeos montada antes de se destacar para se tornar um modelo adicional no qual outros nucleotídeos flutuantes poderiam clicar juntos. Mas ao contrário do previsível ARN moderno, o ARN primitivo não tinha o benefício de proteínas para catalisar o processo de construção. (Porque as proteínas não podem formar sem a maquinaria celular complexa e altamente evoluída requerida para a síntese deles, a maioria de investigadores acreditam que eles eram improváveis de existir na Terra primordial). O RNA cedo, portanto, era provavelmente mais confuso, com muito mais variação na espinha dorsal e bases de açúcar, Szostak diz. Sua equipe está atualmente experimentando “para ter alguma idéia de qual variabilidade seria tolerada e o que seria eliminado”. Nosso modelo atual é que você começa com algo que é confuso e tem muitas variações diferentes nele, e ao longo de ciclos de replicação, você acaba com algo que é mais próximo do RNA homogêneo moderno”
A 2018 paper de Szostak e o estudante de pós-graduação Seohyun Kim ilustra a possível variabilidade do RNA inicial, e seus blocos de construção A, C, G, e U. Os cientistas fizeram progressos na compreensão de como C e U poderiam ter sido gerados por reações químicas prebióticas, mas eles têm lutado com A e G. Szostak e Kim sugerem que o RNA pode ter começado com diferentes nucleobases, e suas experiências mostraram que o nucleósido inosina, que pode ser feito de A (adenina), funciona efetivamente no lugar de G (guanosina). “Isto simplifica o problema geral”, explica Szostak. “Agora só precisamos saber como fazer A.”
Outros experimentos recentes no laboratório focaram nos íons metálicos necessários para desencadear o processo de cópia do RNA. Os pesquisadores normalmente usam magnésio, “mas temos que usá-lo em concentrações muito altas”, o que tem efeitos colaterais negativos, provocando a degradação do RNA ou a destruição da membrana celular. “Esperamos encontrar alguma forma simples e plausível de fazer tudo funcionar com menos magnésio, ou talvez tenhamos que repensar todo o problema e chegar a ele de uma direção diferente”, explica Szostak. “Estamos apenas nos sentindo no escuro, tentando ver onde pode haver um caminho para uma solução”.

Aquecimento e resfriamento atribuíveis ao vulcanismo, como na Grande Primavera Prismática de Yellowstone, teria facilitado a evolução precoce do RNA.
Fotografia por Istock Images
Alguns dos caminhos não funcionam, e até mesmo produzem erros. Em 2016, o laboratório de Szostak publicou um trabalho na Nature Chemistry que mostrou que um peptídeo poderia ter ajudado a replicar o RNA sem as enzimas. Logo em seguida, o pesquisador Tivoli Olsen entrou no laboratório e não conseguiu reproduzir essas descobertas. Sua revisão do trabalho revelou que a equipe havia interpretado mal os dados, e Szostak retraiu o trabalho. “Estamos trabalhando em problemas difíceis, e a coisa mais difícil na ciência, como eu acho que Feynman disse, não é enganar a si mesmo”, diz Szostak. A solução potencial era excitante, “e acho que nos cegou para o que estava a acontecer”. A “graça salvadora”, acrescenta ele, é que eles descobriram os erros por conta própria, embora ele desejasse que isso tivesse acontecido “antes do jornal ser publicado, em vez de depois”. Eu diria que muitas das nossas ideias acabam por ser erradas, mas normalmente percebemos isso muito rapidamente”
Ele está optimista acerca do potencial das recentes descobertas noutros laboratórios; por exemplo, John Sutherland do Laboratório de Biologia Molecular do Medical Research Council (MRC) em Cambridge, Inglaterra, descobriu recentemente uma nova técnica para activar os nucleótidos – modificando quimicamente estes blocos de construção para alimentar o processo de replicação. Sutherland compartilhou estas descobertas com o laboratório de Szostak antes de serem publicadas, e Szostak diz que eles estão explorando maneiras de incorporar esta técnica em seus próprios experimentos.
Após a sua equipe montar protócélulas de trabalho que contenham pedaços de RNA, eles esperam que a informação em algumas seqüências específicas de RNA conferam algum benefício à protocélula que a envolve. Por exemplo, trabalhos anteriores sugerem que algumas seqüências de RNA podem dobrar para se tornarem uma ribozima que poderia fazer lipídios ligeiramente mais avançados para a membrana celular. “Qualquer seqüência de RNA que faça qualquer coisa que ajude suas próprias células a sobreviver ou se reproduzir mais rapidamente começará a tomar conta da população”, explica Szostak. “Esse é o início da evolução darwiniana. E então voltamos a ser biólogos novamente”, diz Gerald Joyce. “Depois de ganhar o Prêmio Nobel, Szostak poderia ter deixado o laboratório para se dedicar a viagens e convites para falar, mas “ele permanece focado na ciência”, diz Gerald Joyce. “É isso que eu mais admiro nele.” Alguns podem ver a investigação básica como um luxo intelectual, mas os seus praticantes defendem que toda a ciência aplicada começa com as descobertas da ciência básica. “Quando Crick e Watson se sentaram e começaram a fazer modelos em papelão da estrutura do DNA, eles não tinham idéia de que isso iria gerar uma indústria que valeria bilhões de dólares 70 anos depois”, observa John Sutherland.
Szostak continua empenhado em responder a essas grandes e desafiadoras perguntas, continuando o trabalho de décadas. “Eu espero ser capaz de construir um sistema celular em evolução antes de me aposentar”, diz ele. Ele está otimista quanto às suas chances. “Acho que estamos a chegar lá. Há mais alguns problemas difíceis, e espero que tudo seja resolvido dentro de alguns anos”.