TÓPICOS QUÍMICOS GERAIS
Energia: Conceitos fundamentais
Formas de energia: Cinética e potencial.trabalho e energia.calor e temperatura.energia potencial electrostática.
Energia: cinética e potencial
O conceito de energia é fundamental para as ciências físicas. Aqui pretendemos estabelecer alguns primeiros princípios em relação à energia, e introduzir algumas das formas que a energia assume que são de particular importância para a química. Em primeiro lugar, é muitas vezes muito útil definir um sistema para significar uma parte particular do universo sobre o qual as nossas observações são feitas. O sistema é composto por um objecto ou conjunto de objectos, e distingue-se do resto do universo – a que chamamos ambiente – por uma fronteira real ou imaginária.
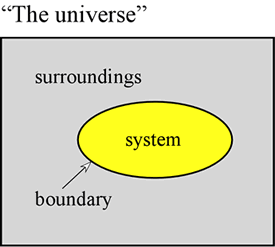
Uma amostra de gás contida num volume fixo, como um cilindro metálico, é um exemplo de um sistema – um sistema que será relevante para nós quando assumirmos o estudo das propriedades gerais dos gases. Outros exemplos são uma amostra de gás dentro de um balão ou uma mistura de combustão em um cilindro com um pistão. Em ambos os casos o sistema é encerrado por um limite físico, mas móvel, de modo que o volume do sistema não é fixo. Um exemplo adicional que consideraremos com freqüência é o de uma mistura de substâncias em solução submetida a uma reação química dentro de um tubo de ensaio ou de um béquer. A terminologia aqui introduzida é de particular importância no estudo de como a energia se manifesta em sistemas químicos, que se enquadra em grande parte no título de termodinâmica.
Em química geral, os sistemas que consideramos relevantes estão tipicamente em repouso e os efeitos gravitacionais são ignorados. Muitas vezes, estamos mais interessados em sistemas nos quais as reações químicas ocorrem, a composição química do sistema mudando com o tempo. Vamos, por enquanto, adotar uma perspectiva mais ampla usando sistemas mecânicos como um pêndulo oscilante, ou bolas de bilhar rolando e colidindo, para nos ajudar a entender princípios gerais relacionados à energia.
Um sistema pode ser dito que possui energia de duas formas diferentes, que chamamos de energia cinética e energia potencial. A energia cinética é a energia da matéria em movimento. A física fornece uma definição matemática exata da energia cinética (KE), mostrada na equação (abaixo à esquerda).
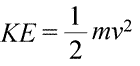
Aqui, a energia cinética de um objeto é representada como um produto da massa do objeto (m) e o quadrado de sua velocidade (v), multiplicado também pela constante ½. Se o sistema consiste em mais de um objeto, a energia cinética total é expressa como uma soma das energias cinéticas dos objetos individuais.
Podemos derivar unidades para a energia dada esta definição. A unidade SI para energia é o joule (J), que é definido como:
1 J = 1 kg-m-s-2
Energia potencial é a energia de um sistema que pode ser tipicamente convertida em energia cinética de alguma forma, e capaz de produzir, em alguma medida, uma quantidade chamada trabalho (discutido mais adiante). Um exemplo claro de energia potencial é um tijolo no parapeito de um edifício. O tijolo tem uma certa quantidade de energia potencial em virtude de sua altura – sua localização em relação a um campo gravitacional. Se dermos um empurrão ao tijolo, para que ele caia do parapeito, ele se move espontaneamente na direção de uma energia potencial gravitacional mais baixa, e ao fazê-lo, ele ganha energia cinética. Outro exemplo é a energia potencial elétrica de uma bateria (que é expressa em termos de voltagem). Quando um circuito é feito com um fio e uma lâmpada, ligando os dois terminais de uma bateria, a diferença de potencial eléctrico entre eles faz com que os electrões do fio se movam (energia cinética), resultando na produção tanto de calor como de luz.
Um importante princípio geral sobre energia é que ela não pode ser criada nem destruída. Isto é conhecido como a lei da conservação da energia. Quantitativamente, isto significa que num sistema como o tijolo que cai ou o pêndulo de um relógio, a soma da energia cinética e potencial é constante. Isto é um pouco de abstração, uma vez que em um pêndulo real, parte da energia está sendo continuamente perdida devido ao atrito, e uma pequena quantidade de energia deve ser adicionada ao pêndulo para mantê-lo balançando (e o relógio funcionando). Mas se contabilizarmos essa energia “perdida” (que na realidade aparece como um aumento da energia térmica das moléculas de ar circundantes) através de medições experimentais cuidadosas, verifica-se que de facto a energia é sempre conservada. Outra ressalva está resumida na famosa equação E = mc2 de Einstein, que expressa uma equivalência fundamental de massa e energia. Uma forma mais geral da lei de conservação da energia, que pode ser chamada de lei de conservação da massa-energia, é responsável por esta equivalência. Voltando à química geral, tais interconversões matéria-energia não são tipicamente sua província, enquanto o estudo das reações nucleares e da radioatividade é englobado pela física nuclear.
Se considerarmos uma reação química na qual as mudanças químicas são acompanhadas pela produção de calor, surge uma questão: E a conservação de energia, neste caso? A resposta é que existe uma forma de energia potencial, que podemos chamar de energia potencial química (ou simplesmente potencial químico), que pode ser pensada como residindo na composição molecular dos reagentes. Esta energia potencial é então convertida em energia sob a forma de calor, mas acontece que a quantidade líquida de energia presente permanece constante, uma vez que somos capazes de definir e medir a produção de calor. Um exemplo diário do que agora podemos entender como energia potencial química é dado por um motor a gasolina, onde a mistura de gasolina e oxigênio possui uma forma latente de energia. Esta energia latente na mistura gasolina/oxigênio é gasta para produzir a energia cinética de um carro.
Trabalho e energia
Trabalho é outro conceito que admite uma definição precisa em física. Além disso, as leis da mecânica podem ser ligadas à energia por meio do teorema trabalho-energia. Um chute de bola de futebol, ou qualquer número de exemplos similares, ilustra a idéia de que a energia cinética de um objeto pode ser aumentada por meio da aplicação de uma força. O teorema energia-trabalho, que é uma generalização desta ideia, pode ser dito mais ou menos como se segue: A mudança na energia que um objeto possui é igual à magnitude da força que atua sobre ele, multiplicada pela distância através da qual a força atua.
A mudança de energia que ocorre num sistema como resultado do trabalho pode ser positiva ou negativa, do ponto de vista do sistema. O trabalho pode ser feito por um sistema, ou um sistema pode ter trabalho feito sobre ele pelo ambiente. Se o trabalho for feito por um sistema, ele perde energia para o entorno. Se o sistema tem trabalho feito sobre ele, a energia do sistema é aumentada. Por exemplo, quando uma faísca que desencadeia uma mistura de combustão em um cilindro com um pistão móvel causa uma rápida expansão do sistema, e a expansão é mecanicamente acoplada ao movimento de uma haste no ambiente, o sistema do cilindro trabalha no ambiente e, ao fazê-lo, perde energia. Isto, naturalmente, faz parte de como um motor de combustão interna converte a energia potencial química em energia cinética de um carro em movimento.
Uma implicação do teorema trabalho-energia é para as unidades, ou seja, que o trabalho pode ser medido nas mesmas unidades que a energia. Como a segunda lei de Newton é força = massa × aceleração, o newton (N), a unidade SI para força, é derivado como M × L × T -2, e assim 1 N = 1 kg m s-2. A distância força vezes a distância tem quantidades M × L2 × T -2, e assim a unidade SI para energia, o joule (J), é definida como 1 J = 1 kg m2 s-2. Neste ponto, você deve verificar por si mesmo que a equação para energia cinética envolve a mesma combinação das quantidades fundamentais massa (M), comprimento (ou distância, L) , e tempo (T).
Calor e temperatura
Usamos as palavras calor e temperatura com bastante frequência, e muitas vezes falamos de calor como uma forma de energia. Todos nós temos uma sensação intuitiva do que são estas coisas, mas aqui queremos pensar nelas mais cientificamente, e dar-lhes definições mais formais se pudermos. Este é um prelúdio necessário para a quantificação da energia correspondente ao calor e, a partir daí, para a verificação da lei de conservação da energia. O que descobrimos é que a energia térmica de um sistema pode ser comparada à energia cinética total (como definida acima) dos átomos e moléculas que o compõem. A temperatura de um objecto ou sistema é na realidade uma medida da energia cinética média dos átomos e/ou moléculas que o compõem. (N.B. A temperatura não é exatamente igual à energia cinética molecular média, mas é diretamente proporcional a ela. Para mais detalhes, veja a página da teoria cinética molecular).
Uma maneira de visualizar o que queremos dizer por calor e temperatura, e a distinção entre eles, é considerar uma analogia de bola de bilhar. Em alguns contextos simples, o comportamento das bolas de bilhar é um modelo adequado para uma coleção de átomos ou moléculas, como em uma amostra de gás. Assim como as bolas de bilhar que acabam de ser atingidas por uma bola branca em movimento rápido, as moléculas de um gás estão se movendo ao redor, ricocheteando umas nas outras e nas paredes do recipiente que as segura. A energia cinética total das bolas de bilhar, que é apenas a soma das energias cinéticas individuais de cada bola, é análoga ao conteúdo de energia térmica de uma amostra de moléculas de gás. Numa “pausa” no início de um jogo de bilhar, a energia cinética inicial da bola branca é distribuída entre todas as bolas da mesa. Algumas estão se movendo bastante rápido, e outras não tão rápido, mas a analogia com “calor” ou “energia térmica” para o sistema de bolas de bilhar é apenas a soma dessas energias cinéticas. Por outro lado, a temperatura do sistema de bolas de bilhar seria proporcional à energia cinética média do conjunto de bolas.
Energia potencial eletrostática
A lei da atração e repulsão eletrostática, ou Lei de Coulomb, descreve a força exercida sobre um objeto carregado devido à presença de outro objeto carregado. A força é mais facilmente calculada quando as cargas podem ser tratadas como cargas pontuais muito pequenas. A magnitude da força que um objeto carregado “sente” é proporcional ao produto das cargas (a unidade SI para carga elétrica é o Coulomb, C), e inversamente proporcional ao quadrado da distância de separação entre as cargas (r na figura à direita). A força é uma força atrativa (como a gravidade, e indicada por pontas de seta para dentro na figura) se as cargas são opostas em sinal, e repulsiva quando as cargas têm o mesmo sinal.
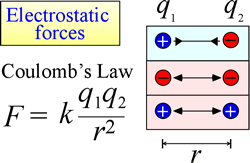
Quando a força (como as forças eletrostáticas, magnéticas e gravitacionais) pode agir a uma distância (através do espaço, sem contato mecânico), diz-se que os objetos sujeitos a tais forças estão em um campo de energia potencial. Falamos de energia potencial gravitacional acima, e de forma semelhante no caso de forças eletrostáticas, um objeto carregado terá energia potencial eletrostática em virtude de sua localização em um campo elétrico. Tal campo existe nas proximidades de qualquer outra carga ou cargas.
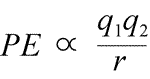
Equação de energia potencial eletrostática: O PE é proporcional às cargas q1 e q2, e inversamente proporcional à distância de separação, r. A forma da função energia potencial segue matematicamente a expressão da força, Lei de Coulomb.
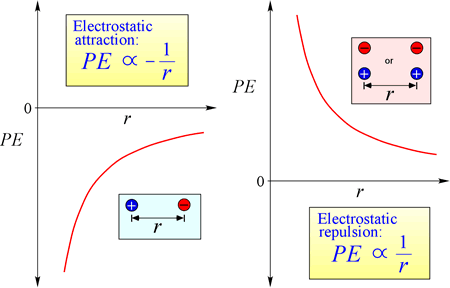
Dados os sinais opostos de cargas na atração, a energia potencial é sempre negativa, e quanto mais próximas as cargas se aproximam, mais negativa – isto é, quanto menor – a energia potencial se torna. À medida que a distância de separação, r se aproxima de zero, a energia potencial torna-se infinitamente negativa. Para cargas do mesmo sinal, a energia de repulsão é sempre positiva, e torna-se infinitamente positiva à medida que a distância de separação, r aproxima-se de zero.
Energia potencial electrostática é uma consideração importante na química. A compreensão da natureza do átomo, a ligação química e as forças intermoleculares são absolutamente dependentes da contabilização da influência das interações carga-carga que contribuem para a energia de um sistema.
Unidades importadoras
Energia (unidade SI) 1 joule = 1 J = 1 kg-m-s-2
Carga elementar, e = 1,60218 × 10-19 C (coulomb, C)
Faraday constant: F = NAe = 9,64853 × 104 C-mol-1
Potencial eléctrico: volts, V 1 V = 1 J C-1